RPL23、MDM2表达与胃癌术后辅助化疗疗效及毒副反应的相关性研究
2017-06-01彭文苗张志敏胡萌余丽芳
彭文苗++++张志敏++胡萌+余丽芳+++章必成+饶智国

[摘要] 目的 研究胃癌組织中核糖体蛋白L23(RPL23)、鼠双微体2(MDM2)蛋白表达与术后辅助化疗效果及毒副反应之间的关系,对胃癌化疗获益人群进行探索性分析。 方法 回顾性收集胃癌根治术并行术后辅助化疗患者34例,免疫组化检测胃癌组织中RPL23、MDM2表达,统计学分析其与3年无病生存期(DFS)及化疗毒副反应之间的关系。 结果 34例患者中,RPL23、MDM2阳性表达率分别为23.5%、58.8%。RPL23(χ2=9.946,P = 0.002)、MDM2(χ2=12.560,P < 0.001)是影响患者3年DFS获益的重要因素,RPL23阳性患者中位DFS为17.4个月,明显低于阴性患者(26.7个月)(χ2=10.90,P = 0.001);MDM2阳性患者DFS为28.2个月,明显高于阴性表达患者(18.4个月)(χ2=20.42,P < 0.001)。血液毒副反应方面,RPL23阳性患者的发生率为50.0%,明显高于阴性表达患者(11.5%)(P = 0.037);MDM2阳性表达患者为5.0%,低于阴性表达患者(42.9%)(P = 0.012);RPL23、MDM2表达与患者胃肠毒性反应发生率之间差异无统计学意义(P > 0.05)。 结论 RPL23、MDM2在胃癌组织中表达有可能作为患者术后辅助化疗效果及血液毒副反应的预测指标。
[关键词] 核糖体蛋白L23;鼠双微体2;胃癌;基因;术后辅助化疗;疗效;毒副反应
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-7210(2017)04(b)-0083-04
[Abstract] Objective To investigate the correlation of expression of ribosomal protein L23 (RPL23), murine double minute 2 (MDM2) in gastric cancer tissue with the curative effect of postoperative adjuvant chemotherapy and adverse reactions, so as to make exploratory analysis for the specific group benefited from chemotherapy of gastric cancer. Methods Thirty-four patients with gastric cancer received radical gastrectomy and postoperative adjuvant chemotherapy were collected retrospectively. The expression of RPL23 and MDM2 in the gastric cancer tissue was detected by immunohistochemistry. The relationship of their expression with 3-year disease-free survival (DFS) and adverse reactions were analyzed statistically. Results Among 34 patients, the positive rate of RPL23, MDM2 was 23.5%, 58.8% respectively. The expression of RPL23 (χ2=9.946, P = 0.002) and MDM2 (χ2=12.560, P < 0.001) were the important factors influencing the benefit from 3-year DFS. The median DFS of patients with positive RPL23 was 17.4 months, which was significantly lower than that of negative patients (26.7 months) (χ2=10.90, P = 0.001), the DFS of patients with positive MDM2 was 28.2 months, which was significantly higher than that of negative patients (18.4 months) (χ2=20.42, P < 0.001). In the aspects of blood adverse reactions, the incidence of patients with positive RPL23 was 50.0%, which was significantly higher than that of negative patients (11.5%) (P = 0.037); the incidence of patients with positive MDM2 was 5.0%, which was significantly lower than that of negative patients (42.9%) (P = 0.012); there were no significant differences of the expression of RPL23, MDM2 with the incidence of gastrointestinal adverse reactions (P > 0.05). Conclusion The expression of RPL23 and MDM2 may be as the predictive indexes for the curative effect of postoperative adjuvant chemotherapy and blood adverse reactions.
[Key words] Ribosomal protein L23; Murine double minute 2; Gastric cancer; Genes; Postoperative adjuvant chemotherapy; Curative effect; Adverse reactions
截至2015年,胃癌仍居我国肿瘤疾病谱发病率第三、病死率第二,是威胁我国人民健康的重大疾病[1]。胃癌根治术是胃癌患者的首要治疗手段,术后化疗仍是胃癌患者生存获益的主要方法之一[2]。然而,化疗敏感性低下常常导致化疗有效率降低甚至失败,并进一步增加化疗毒副反应,参与肿瘤的复发转移[3]。核糖体蛋白L23(RPL23)与鼠双微体2(MDM2)通过参与DNA修复、调控细胞周期、调节多种耐药蛋白分子等方式影响胃癌细胞增殖、分化、转移,是影响乳腺癌、卵巢癌等多种人类肿瘤的化疗敏感性和毒副反应形成的重要因子[4-8]。为进一步阐明RPL23、MDM2在胃癌化疗中的作用,本研究回顾性收集接受术后辅助化疗的胃癌根治术患者34例,免疫组织化学检测癌组织中RPL23、MDM2表达,评估化疗后患者的3年无病生存期(DFS)及化疗过程中的血液、胃肠毒性反应,分析其与蛋白表达之间的内在联系,期望对胃癌化疗人群的筛选和毒副反应的处理提供参考。
1 资料与方法
1.1 一般资料
回顾性收集2010年1月~2013年1月于解放军武汉总医院(以下简称“我院”)接受D2式淋巴结清扫的胃癌根治术患者34例,所有患者均经R0切除且至少送检15枚以上淋巴结[9]。纳入标准:①具有明确病理学、影像学诊断依据的原发性胃癌;②有完整的病例资料和术后病理组织存档;③术后8周内我院肿瘤科行进一步治疗者,体能状态评分(ECOG)0~2分;④有明确的化疗指征,至少完成4个周期的术后辅助化疗,均未接受新辅助化疗者;⑤没有严重的心肝肾疾病,无活动性肝炎、结核等感染性疾病,无其他原发性肿瘤病史。共筛选出34例患者,年龄29~76岁,中位年龄55岁;其中男24例,女10例;术后病理低分化腺癌19例,中分化腺癌6例,印戒细胞癌5例,黏液性腺癌2例,未分化癌1例;Her-2阳性表达4例,阴性表达24例,状态不明6例;病理学分期根据美国癌症联合委员会(AJCC)第7版分期标准:Ⅰb期5例,Ⅱ期9例,Ⅲ期20例,无Ⅰa期及Ⅳ期患者;化疗周期数为4~6个周期。
1.2 免疫组化检测胃癌组织RPL23、MDM2蛋白表达
制备石蜡包埋切片,采用免疫组化染色方法检测RPL23、MDM2在癌组织中的表达情况,具体按说明书步骤进行操作。羊抗人RPL23单克隆抗体、羊抗人MDM2单克隆抗体购自Santa公司,SP试剂盒和DAB试剂盒均购自福建迈新试剂有限公司。光学显微镜下观察染色结果,细胞核或细胞质有明确棕黄色着色者为阳性细胞,高倍镜下随机选取5个视野,计不少于100个细胞中的阳性细胞数取平均值,并结合染色深度进行评分,0分:阳性细胞数 < 5%,染色深度弱;1分:阳性细胞数5%~<25%,染色深度为轻度;2分:阳性细胞数25%~<50%,染色深度为中度;3分:阳性细胞数≥50%,染色深度为重度。将阳性细胞数评分与染色深度评分相乘 < 2分计阴性,≥2分为阳性[10]。
1.3 化疗方案
术后辅助化疗选择FOLFOX4方案,包括氟脲嘧啶、亚叶酸钙、奥沙利铂,根据患者体表面积及一般状况适当调整化疗剂量,化疗中出现的血液及胃肠毒性均对症处理。
1.4 化疗疗效及毒副反应评价
所有患者化疗前后参考影像学及肿瘤标志物等资料进行病情评估,化疗过程中及时评价血液及胃肠毒性反应。以电话和查阅住院资料的方式,严密随访3年,主要观察目标:3年DFS,随访终止时间为2016年1月31日,中位随访时间25个月。化疗副反应评估,参照2010年WHO化疗药物毒性反应分级[11],主要考察血液学和胃肠毒性反应,依次分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ度,具体观察指标包括血红蛋白、白细胞、粒细胞、血小板、恶心呕吐、腹泻等。
1.5 统计学方法
用SPSS 19.0软件进行数据处理,预后分析使用COX比例风险回归模型,生存分析使用Kaplan-Meier,Log Rank进行检验,计数资料使用χ2检验及Fisher确切概率法,以P < 0.05为差异有统计学意义。
2 结果
2.1 RPL23、MDM2在胃癌组织中的表达
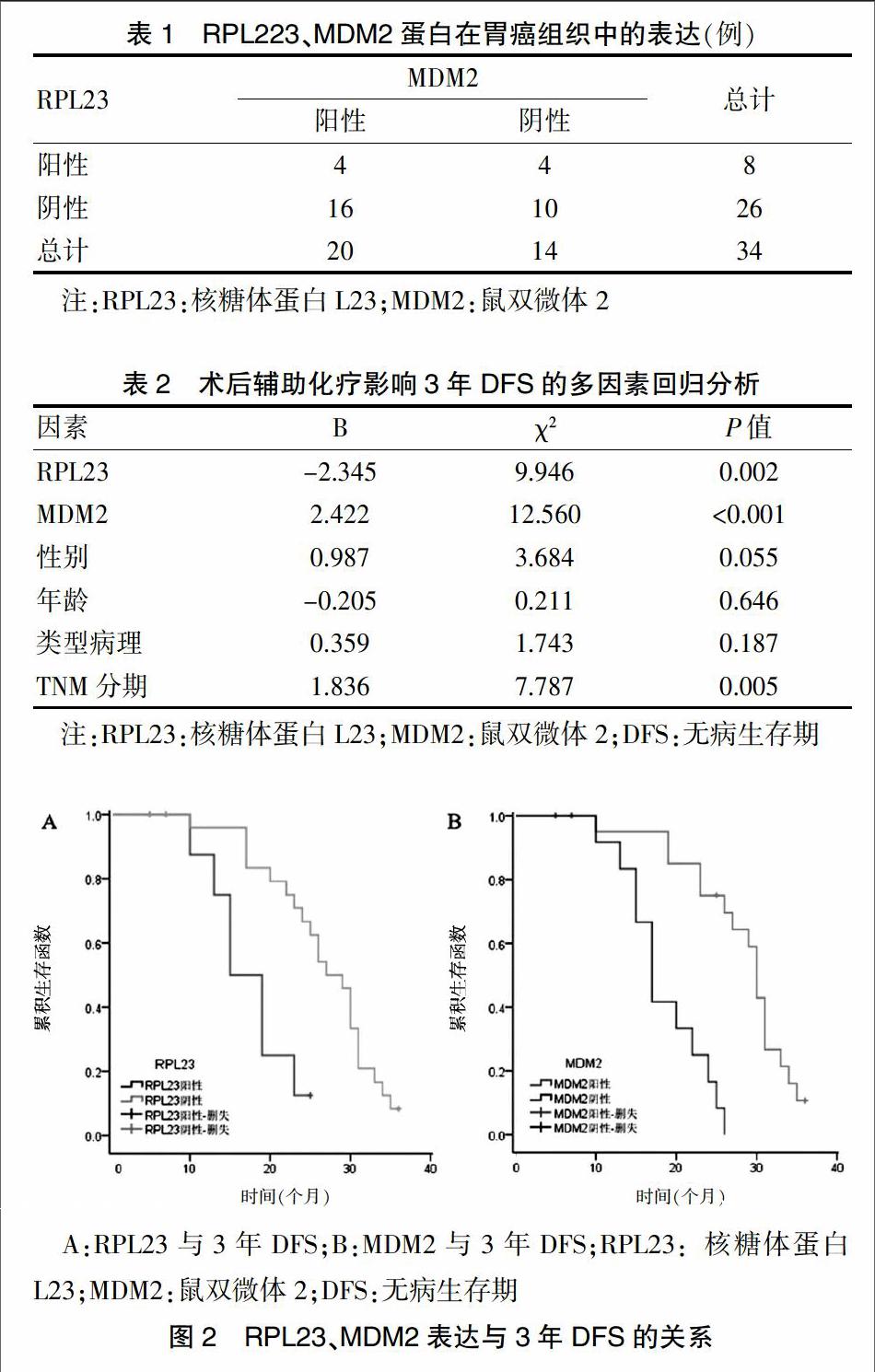
RPL23、MDM2蛋白在胃癌组织标本中的表达见图1(封三)。在34例组织标本中,RPL23、MDM2阳性表达率依次为23.5%(8/34)、58.8%(20/34),其中二者共阳性表达的有4例,见表1。
2.2 术后辅助化疗疗效的评价
将RPL23、MDM2、性别、年龄、病理类型、TNM分期等因素纳入COX比例风险回归模型,结果显示:患者的性别、年龄、病理类型对3年DFS的影响差异无统计学意义(P > 0.05),RPL23阳性表达是减少患者3年DFS的重要因素(P = 0.002),更早的TNM分期及MDM2阳性表达则是患者3年DFS的获益性因素(P = 0.005、P < 0.001)(表2)。34例患者中位DFS为24.5个月,RPL23阳性患者中位DFS为17.4个月,明显低于阴性患者(26.7个月),差异有统计学意义(χ2=10.90,P = 0.001);MDM2阳性患者中位DFS为28.2个月,明显高于阴性表达患者(18.4个月),差异有统计学意义(χ2=20.42,P < 0.001)(图2)。
2.3 血液及胃肠毒性反应评价
在术后辅助化疗中,有7例患者出现Ⅲ度以上的血液毒性反应,主要为贫血、白细胞及粒细胞减少;13例患者出现Ⅲ度以上的胃肠毒性反应,主要表现为恶心、呕吐。在Ⅲ度以上的血液毒性发生率方面,RPL23阳性表达患者为50.0%(4/8),高于阴性表达患者11.5%(3/26),差异有统计学意义(P = 0.037);MDM2阳性患者为5.0%(1/20),低于陰性表达患者[42.9%(6/14)],差异有统计学意义(P = 0.012)。在胃肠毒性方面,RPL23阳性与阴性、MDM2阳性与阴性患者的Ⅲ度胃肠毒性反应发生率依次为25.0%(2/8)、42.3%(11/26)、35.0%(7/20)、42.9%(6/14),差异均无统计学意义(P > 0.05)(表3)。
3 讨论
化疗疗效降低是导致化疗失败的重要原因,也是增加化疗毒副反应的重要机制,并可进一步影响患者的DFS[12]。目前,细胞膜保护剂已广泛应用于临床,并在一定程度上能减轻化疗毒副反应,增加患者的耐受能力,然而也有研究表明,这些措施并不能使患者明显获益,并有可能成为降低化疗敏感性、促使继发耐药的重要因素[13]。FOLFOX4是胃癌常用的术后辅助化疗方案,尽管如此,临床中仍然不可避免地会出现化疗有效率不高、毒副反应过重的现象[14]。有针对性地选择化疗获益人群,降低化疗毒副作用的同时提高有效率,将成为胃癌个体化治疗的挑战。
RPL23在胃癌多个耐药细胞株中表现出蛋白或mRNA过表达,是导致胃癌细胞周期阻滞、诱导耐药,并进一步降低化疗敏感性的重要分子[4,15]。RPL23阳性表达的患者术后辅助化疗后的3年DFS明显低于阴性表达者,且此类患者对化疗血液毒性反应耐受性不佳,更容易出现Ⅲ度以上的骨髓抑制,在胃肠毒性反应方面没有统计学差异。这说明,RPL223有可能是诱导降低胃癌化疗疗效、增加血液学毒性反应,进而导致术后化疗失败的不良因素。
MDM2基因扩增或过表达是导致人类至少40余种肿瘤低分化、晚分期、易转移的不良因素,是区分不同肿瘤类型或亚型、协助病理诊断的重要指标[16-17],新的研究也表明,MDM2的异常表达是影响肿瘤患者化疗敏感性的重要分子[18]。本研究发现,MDM2阳性患者在术后辅助化疗后的3年DFS明显优于阴性患者,且血液毒性反应耐受性良好,发生Ⅲ度以上的骨髓抑制比例更低,在胃肠毒性反应方面没有统计学差异。鉴于MDM2阳性表达对术后辅助化疗有效率高、血液学毒性耐受性好的预测价值,MDM2阳性患者可能是胃癌术后辅助化疗获益的主要人群。
现已证实,RPL23、MDM2是调控p53活性及稳定性、影响胃癌疾病预后转归的一对因子[7,19]。当前,靶向作用于MDM2的小分子及多肽多数已处于Ⅰ期或Ⅱ期临床试验[20],RPL23作为极具潜力的基因新药,在扩大p53基因治疗的适应证方面的价值也已引起国内外学者的重视。本研究着眼于RPL23、MDM2蛋白表达与术后化疗后DFS及毒副反应的关系研究,是对现有RPL23基因新药、MDM2抑制剂研究数据的补充,常规免疫组化检测二者在胃癌中的表达,将为胃癌个体化治疗提供更多参考,但仍存在诸多局限性,比如样本量不足、未完成与Her-2的相关性分析等。
[参考文献]
[1] Chen WQ,Zheng RS,Baade PD,et al. Cancer statistics in China,2015 [J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Izuishi K,Mori H. Recent strategies for treating stage Ⅳ gastric cancer:roles of palliative gastrectomy,chemotherapy,and radiotherapy [J]. J Gastrointestin Liver Dis,2016, 25(1):87-94.
[3] Li Y,Tan BB,Zhao Q,et al. Tumor chemosensitivity is correlated with expression of multidrug resistance associated factors in variously differentiated gastric carcinoma tissues [J]. Hepatogastroenterology,2013,60(121):213-216.
[4] 于海燕,张志勇,王凯,等.下调RPL23对胃癌耐药细胞SGC7901/ADR药物敏感性的影响[J].现代肿瘤医学,2015,23(10):1340-1343.
[5] Oliner JD,Saiki AY,Caenepeel S. The Role of MDM2 Amplification and Overexpression in Tumorigenesis [J]. Cold Spring Harb Perspect Med,2016,6(6),pii:a026336.
[6] Zhang YF,Zhang BC,Zhang AR,et al. Co-transduction of ribosomal protein L23 enhances the therapeutic efficacy of adenoviral-mediated p53 gene transfer in human gastric cancer [J]. Oncol Rep,2013,30(4):1989-1995.
[7] 蔣雨薇,张志敏,冯俊明,等.鼠双微体2与核糖体蛋白L23在胃癌组织中的表达及临床意义[J].世界华人消化杂志,2016,24(4):513-520.
[8] Oba MS,Teramukai S,Ohashi Y,et al. The efficacy of adjuvant immunochemotherapy with OK-432 after curative resection of gastric cancer:an individual patient data meta-analysis of randomized controlled trials [J]. Gastric Cancer,2016,19(2):616-624.
[9] Min C,Bangalore S,Jhawar S,et al. Chemoradiation therapy versus chemotherapy alone for gastric cancer after R0 surgical resection:a meta-analysis of randomized trials [J]. Oncology,2014,86(2):79-85.
[10] Avallone G,Roccabianca P,Crippa L,et al. Histological Classification and Immunohistochemical Evaluation of MDM2 and CDK4 Expression in Canine Liposarcoma [J]. Vet Pathol,2016,53(4):773-780.
[11] 孙燕,石远凯.临床肿瘤内科手册[M].北京:人民卫生出版社,2014:96-105.
[12] Wang LL,Zhang XH,Zhang X,et al. MiR-30a increases cisplatin sensitivity of gastric cancer cells through suppressing epithelial-to-mesenchymal transition(EMT)[J]. Eur Rev Med Pharmacol Sci,2016,20(9):1733-1739.
[13] Jena G,Vikram A,Tripathi DN,et al. Use of chemoprotectants in chemotherapy and radiation therapy:the challenges of selecting an appropriate agent [J]. Integr Cancer Ther,2010,9(3):253-258.
[14] Matsusaka S,Lenz HJ. Pharmacogenomics of fluorouracil-based chemotherapy toxicity [J]. Expert Opin Drug Metab Toxicol,2015,11(5):811-821.
[15] Hu HD,Ye F,Zhang DZ,et al. iTRAQ quantitative analysis of multidrug resistance mechanisms in human gastric cancer cells [J]. J Biomed Biotechnol,2010,2010:571343.
[16] Deb SP,Singh S,Deb S. MDM2 Overexpression,Activation of Signaling Networks,and Cell Proliferation [J]. Subcell Biochem,2014,85:215-234.
[17] Zhang P,Wu SK,Wang Y,et al. p53,MDM2,eIF4E and EGFR expression in nasopharyngeal carcinoma and their correlation with clinicopathological characteristics and prognosis:A retrospective study [J]. Oncol Lett,2015,9(1):113-118.
[18] Okamoto H,Fujishima F,Kamei T,et al. Murine double minute 2 predicts response of advanced esophageal squamous cell carcinoma to definitive chemoradiotherapy [J]. BMC Cancer,2015,15:208.
[19] Ye Y,Li X,Yang J,et al. MDM2 is a useful prognostic biomarker for resectable gastric cancer [J]. Cancer Sci,2013,104(5):590-598.
[20] Burgess A,Chia KM,Haupt S,et al. Clinical overview of MDM2/X-targeted therapies [J]. Front Oncol,2016,6:7.
(收稿日期:2016-12-06 本文編辑:张瑜杰)
