抗氧化胁迫促进地衣芽孢杆菌合成杆菌肽
2017-06-01刘道奇杨华陈守文李俊辉陈雄王志
刘道奇,杨华,陈守文,李俊辉,陈雄,王志*
(1.发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,湖北工业大学,湖北武汉430068;2.湖北大学生命科学学院,湖北武汉430062;3.绿康生化股份有限公司,福建浦城353400)
抗氧化胁迫促进地衣芽孢杆菌合成杆菌肽
刘道奇1,杨华1,陈守文2,李俊辉3,陈雄1,王志1*
(1.发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,湖北省工业微生物重点实验室,湖北工业大学,湖北武汉430068;2.湖北大学生命科学学院,湖北武汉430062;3.绿康生化股份有限公司,福建浦城353400)
地衣芽孢杆菌(Bacillus licheniformis)发酵合成杆菌肽过程中存在的氧化胁迫影响了杆菌肽的合成效率。添加0.2%抗坏血酸和0.4%半胱氨酸使杆菌肽效价在摇瓶水平分别比对照提高了20.7%和29.4%。另外,胞内过氧化氢酶活比对照分别降低了68.3%和43.8%。半胱氨酸合成加强工程菌株在10 L罐发酵过程中,峰值生物量(84×109CFU/mL,26 h)比出发菌株提高了9.0%,杆菌肽效价(1 090 U/mL,32 h)也提高了13.5%。Cys含量(213.3 mg/L,24 h)和过氧化氢酶活力(14~32 h)分别比对照提高了约60%和降低了15%~40%。说明Cys作为前体氨基酸参与杆菌肽合成与参与氧化自由基清除之间存在竞争关系,工程菌株通过增强Cys合成更好地满足了细胞对两者的生理需求,维持了细胞活性、促进了杆菌肽合成效率。
地衣芽孢杆菌;杆菌肽;抗坏血酸;半胱氨酸;过氧化氢酶

LIU Daoqi1,YANG Hua1,CHEN Shouwen2,LI Junhui3,CHEN Xiong1,WANG Zhi1*
(1.Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Hubei Key Laboratory of Industrial Microbiology,Hubei University of Technology,Wuhan 430068,China; 2.Lifecome Bioengineering Institute of Hubei University,College of Life Sciences,Hubei University,Wuhan 430062,China; 3.Lifecome Biochemistry Co.,Ltd.,Pucheng,353400,China)
地衣芽胞杆菌以淀粉、豆粕等为主要原料进行高密度发酵合成杆菌肽过程中,发酵液固形物含量高、黏度大,并且菌体生长迅速促使溶氧在发酵早期跌零,因此溶解氧是影响杆菌肽合成的关键因素[1-2]。曾新年等[3]在转速为300 r/min和通风量为600 L/h的发酵条件下通过流加双氧水有效地缓解了供氧不足的问题,促进了杆菌肽的合成效率,但发酵周期仍然过长(42 h)。提高搅拌速度和增加通气流量可以促进细胞生长和产物的合成,在本实验条件下(转速600 r/min和通风量600 L/h)发酵周期显著缩短了约10 h,放罐效价略有提高。但是也出现了“新的矛盾”,表面上看是发酵中期细胞衰老自溶,杆菌肽合成效率难以维持。
细胞进行有氧代谢过程中产生的过氧化氢(H2O2)、羧自由基(ROO·)、羟自由基(·OH)等会导致细胞衰老和生理代谢紊乱[4]。VOIGT B等[5]对地衣芽胞杆菌在发酵条件下的蛋白组学进行了系统的分析,确定地衣芽胞杆菌在快速生长过程存在严重的氧化胁迫效应,整个发酵周期过氧化氢酶和过氧化物还原酶被强烈而持续的诱导表达。因此,在高通风和高转速条件下促使地衣芽胞杆菌的生长代谢的同时,很可能也加剧了细胞清除高活性氧自由基的负担,并对细胞造成了氧化胁迫,而突出的氧化胁迫很可能是上述“新的矛盾”的内在因素,并使细胞活力急剧而持续的下降、自溶。
作为应激反应,细胞会激活氧自由基清除系统的表达,如超氧化物歧化酶、过氧化氢酶和过氧化物酶等酶系统[6]从而降低其对细胞的损害。另外,微生物生长代谢过程中也特异性的存在谷胱甘肽和半胱氨酸等非酶解氧化应激的形式,这对于清除高活性氧自由基也起到了积极作用,赵素娟[7]研究了加入外源还原型谷胱甘肽后,可以提高酿酒酵母细胞存活率及膜完整性,降低O2-和H2O2水平。
基于以上分析,本试验基于发酵过程中胞内过氧化氢酶活力和前体氨基酸浓度的时序变化趋势,研究了还原性物质—抗坏血酸(vitamin C,VC)和半胱氨酸对地衣芽孢杆菌生长和合成杆菌肽的影响,通过一株半胱氨酸合成加强型工程菌株在10 L发酵罐水平进行验证,为抗氧化胁迫促进杆菌肽合成的研究提供数据支持。
1 材料与方法
1.1 材料与试剂
地衣芽孢杆菌LC(BacilluslicheniformisLC)、半胱氨酸合成加强型地衣芽孢杆菌CY(Bacillus licheniformisCY):湖北大学绿康生物工程研究所。
斜面培养基:酵母浸膏20 g/L,NaCl 5 g/L,琼脂20 g/L,调pH 7.5。
种子培养基:豆粕50 g/L,玉米淀粉20 g/L,轻质碳酸钙4 g/L,(NH4)2SO41 g/L,玉米浆2.5 g/L。
发酵培养基:豆粕90 g/L,淀粉40 g/L,碳酸钙4 g/L,硫酸铵0.7 g/L,蛋白胨10 g/L。
1.2 仪器与设备
DELTA 320 pH计:梅特勒托利多仪器(上海)有限公司;YXQ-LS-50SII立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;CJ-2D型无菌操作台:天津市泰斯特仪器有限公司;SGJ-10 L/C发酵罐:上海联环生物工程设备有限公司;TG18M台式高速离心机:长沙平凡仪器仪表有限公司;HNY-211B全温振荡培养箱:天津欧诺仪器仪表有限公司;5417R型冷冻离心机:Eppendorf(德国)公司;UVmini-1240紫外可见分光光度计:日本岛津公司;PURELAB Flex 1/2/3/4纯水仪:英国ELGA公司;E100光学显微镜:日本Nikon公司;BQ50-1J蠕动泵:保定兰格恒流泵有限公司;高效液相色谱(high performance liquid chromatography,HPLC):美国安捷伦公司。
1.3 方法
1.3.1 培养方法
(1)种子活化:无菌竹签转接-80℃保藏甘油管菌液至250 mL茄子瓶斜面(装量60 mL),在恒温培养箱中37℃培养24 h。
(2)种子培养:培养好的茄子瓶斜面加50 mL无菌水洗菌苔,倒入装有玻璃珠的无菌三角瓶(250 mL三角瓶,种子培养基装量50 mL)中,轻轻摇匀,接种4 mL菌悬液,并在37℃、250 r/min培养24 h。
(3)摇瓶发酵:250 mL三角瓶,装量25 mL。接种3 mL种子培养液于摇瓶发酵培养基中,并在37℃、250 r/min培养约44 h。
(4)10 L罐培养:基料5 L,接种量6%(V/V),通气量600 L/h,转速600 r/min,罐压控制在0.03 MPa,37℃培养32 h左右。
1.3.2 分析方法
(1)生物量的测定:由于是浊液发酵,为了较快得到生物量的数据,采取细菌计数板进行细胞计数,并建立了显微计细胞数(x)与平板计数(y,CFU/mL)之间的关系(y=0.350 1x-8.805 6,R2=0.986 8)。
(2)氨基酸测定:发酵液8 000 r/min离心10 min,取0.5mL上清液,加入等体积的磺基水杨酸,振荡摇匀,再4℃、12 000 r/min离心15 min,用0.02 mol/L HCl进行适当稀释,0.22 μm膜过滤,滤液用氨基酸分析仪检测氨基酸含量[8]。
(3)高效液相色谱测定杆菌肽含量:取预处理后的上清液1 mL,加入体积分数50%乙醇4 mL,振荡摇匀,再10 000 r/min离心10 min,上清液经0.22 μm膜过滤后,备用。HPLC测定杆菌肽效价方法按文献进行[9]。
(4)过氧化氢酶活测定:a.样品保存与洗涤:发酵中期进行周期取样,液氮冻存后备用。保留5mL发酵液离心(4℃、8 000 r/min、10 min)后的菌体沉淀,加入4 mL磷酸盐缓冲液(phosphate buffer solution,PBS)缓冲液(pH 7.0),充分振荡摇匀,洗涤,再次离心(4℃、8 000 r/min、10 min)。重复此操作6次,保留细胞沉淀。b.提取过氧化氢粗酶液:洗涤后的细胞加入PBS缓冲液(pH 7.0),定容至5 mL,充分振荡摇匀。然后将菌悬液置于超声细胞破碎仪超声破碎,并进行冰浴处理。工作条件:功率60%,超声工作4 s,间歇5 s,超声时间15min。待超声细胞完成后,取出离心管离心(4℃、8 000 r/min、10 min),上清液即为过氧化氢粗酶液提取液。c.酶活测定:取10 mL试管2支,编号0和1,并按表1顺序依次加入试剂[10]。

表1 过氧化氢酶活测定体系Table 1 Determination system of catalase activity
对照组加入0.3 mL蒸馏水,在波长240 nm处调零。实验组加入0.3 mL 0.1 mol/L的H2O2,测定吸光度值,间隔15 s读数1次,记录数据3~5 min。酶活定义:1 min内A240nm减少0.1所用的酶量为1个酶活单位(U)。

式中:VT为破碎后过氧化氢酶总体积,mL;V1为用于测定的过氧化氢酶体积,mL;FW为破碎后胞内蛋白质量,g;0.1为A240nm每下降0.1为1个酶活单位,U;t为反应时间,min。
本实验中样品蛋白(FW)为粗酶液中的蛋白含量,采用考马斯亮蓝G-250方法测定粗酶液蛋白含量。
2 结果与分析
2.1 发酵过程中胞外氨基酸浓度的时序变化
杆菌肽是一种非核糖体合成酶催化合成的12环肽次级代谢产物,前体氨基酸的种类主要有Asp、Glu、Cys、Val等[11]。氨基酸不仅为杆菌肽合成的前体分子,有些氨基酸(如Cys)还可能具有缓解氧化胁迫的功能。因此,有必要对发酵过程中相关前体氨基酸进行检测。

图1 地衣芽孢杆菌在10 L罐发酵过程中胞外氨基酸含量及杆菌肽效价的变化Fig.1 Change of the extracellular amino acids content and bacitracin titreB.licheniformisLC fermentation in 10 L fermentor
由图1可知,在发酵过程中Glu、Asp、Leu、Phe、Lys和His的含量持续上升,在放罐时(32 h)分别达到626 mg/L、140mg/L、480mg/L、933mg/L、394mg/L和151mg/L。而Cys和Val在26 h分别达到峰值134 mg/L和196 mg/L之后,便开始迅速下降,至32 h分别下降了81.1%(74 mg/L)和30.7%(150 mg/L),而且发酵过程中Val含量始终高于Cys近50%以上。30 h杆菌肽效价达到峰值960 U/mL,后开始降解。这可能与Cys在28 h后处于低水平状态不足以维持杆菌肽合成有关。
2.2 单因素摇瓶添加抗坏血酸与半胱氨酸对杆菌肽合成的影响
在杆菌肽高密度发酵过程中,溶氧是限制性因素之一。溶氧不足而导致的“酸胁迫效应”使细胞生长缓慢,发酵周期延长,杆菌肽的合成受到限制[12]。加强供氧够有效的解决以上问题,曾新年等[3]在300 r/min和600 L/h发酵条件下流加双氧水有效地缓解了溶解氧不足的问题,促进了杆菌肽的合成效率,但发酵周期过长的问题没有解决。本实验条件下(转速600 r/min和通风600 L/h)发酵周期缩短了约10 h,放罐效价也略高于曾新年的报道[3]。但是也出现了着新的矛盾:发酵中后期细胞便开始自溶,这势必会影响杆菌肽的合成效率。VOIGT B等[5]报道了地衣芽胞杆菌在快速生长过程存在严重的氧化胁迫效应。因此,在实验条件下(高通风和高转速)促使地衣芽胞杆菌的生长代谢的同时,很可能也加剧了细胞清除高活性氧自由基的负担,并对细胞造成了氧化胁迫,而突出的氧化胁迫很可能是使细胞活力急剧而持续的下降、自溶的内在因素。而微生物生长代谢过程中也特异性的存在谷胱甘肽和半胱氨酸等非酶解氧化应激的形式,这对于清除高活性氧自由基也可起到积极作用,因此,在摇瓶水平研究了VC和半胱氨酸对地衣芽孢杆菌合成杆菌肽的影响,结果见图2。
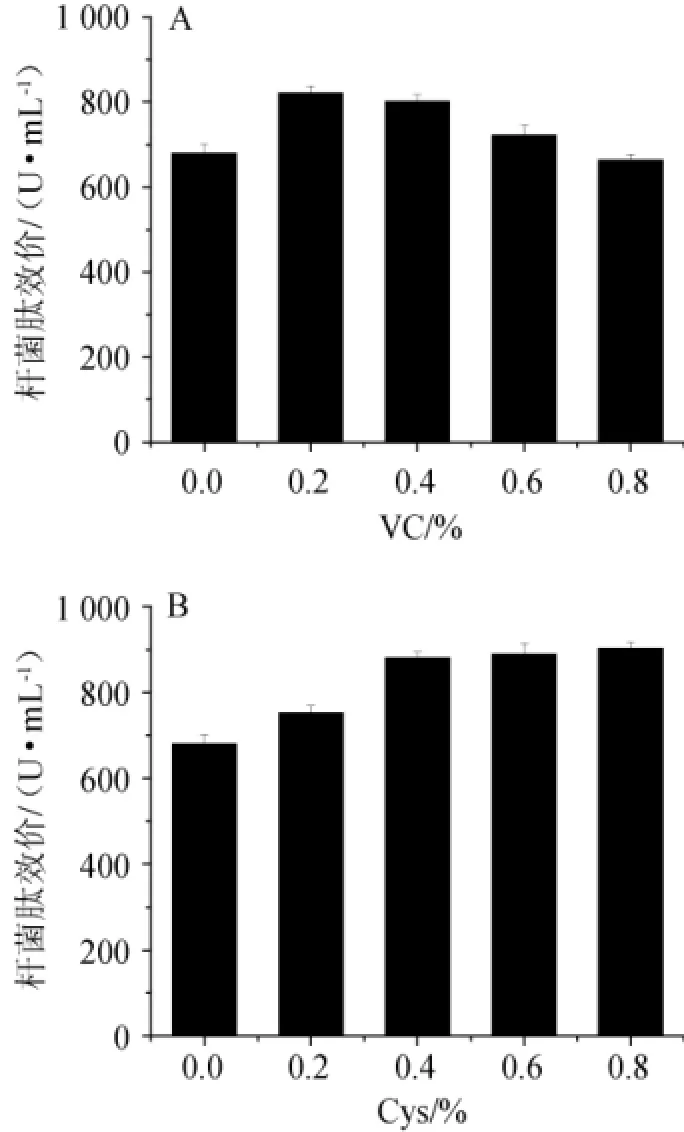
图2 抗坏血酸(A)及半胱氨酸(B)对出发菌株摇瓶发酵合成杆菌肽的影响Fig.2 Effects of VC(A)and Cys(B)addition on bacitracin production byB.licheniformis LC in shake flask fermentation
由图2A可知,单因素摇瓶添加VC或半胱氨酸都能促进地衣芽孢杆菌合成杆菌肽,添加0.2%抗坏血酸时,杆菌肽效价最高为821 U/mL,比对照提高了20.7%(680 U/mL)。0.4%和0.6%添加量都促进了杆菌肽合成,但是不如0.2%的添加量明显,然而0.8%的添加量却抑制杆菌肽的合成,只有对照组的97.5%(663 U/mL)。另外,VC添加量越多,发酵液的pH值反而越低(资料未显示),这可能与过量的抗坏血酸被氧化、增强的供氧矛盾导致细胞能量供给不足以及溢流酸代谢加剧有关[13]。
由图2B可知,当添加0.4%半胱氨酸时,杆菌肽效价达到了880 U/mL,比对照提高了29.4%,比VC添加的最高值(821 U/mL)提高了7.2%,但是继续增加Cys的浓度(0.6%和0.8%)并没有进一步提高杆菌肽的效价,但没有VC组添加抑制杆菌肽合成的现象。同样的,放瓶pH也随着Cys添加量的增多而降低(资料未显示)。
2.3 单因素摇瓶添加抗坏血酸和半胱氨酸对过氧化氢酶
活的影响
抗坏血酸(VC)是酸性多羟基化合物,而半胱氨酸含有巯基(-SH),都具很强的抗氧化性,可保护细胞免于活性氧自由基的威胁[14]。为了考察添加Cys或VC是否能够促进杆菌肽的合成,对发酵过程的胞内过氧化氢酶活性进行了检测,结果见图3。
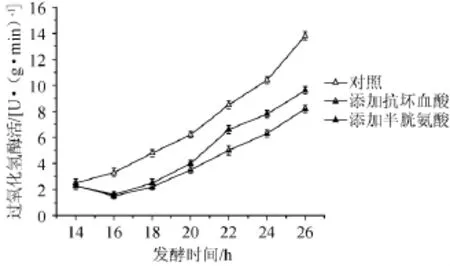
图3 摇瓶添加抗坏血酸或半胱氨酸对出发菌株胞内过氧化氢酶活的影响Fig.3 Effects of VC or Cys addition on the intracellular catalase activity of strain LC in shake flask fermentation
由图3可知,随着摇瓶发酵的进行,对照组和实验组(添加Cys或VC)过氧化氢酶活力均呈现逐渐上升的趋势。26 h分别达到13.8 U/(g·min)(对照组)、9.6 U/(g·min)(Cys组)和8.2 U/(g·min)(VC组)。但是,实验组酶活较对照组分别降低了43.8%(Cys组)和68.3%(VC),说明了添加VC或Cys确实起到了抗氧化胁迫的作用,它们分担了胞内过氧化氢酶的氧自由基清除负担。
虽然半胱氨酸的还原性(氧自由基去除能力)没有VC强[15],但是Cys是杆菌肽的前体氨基酸之一,又是限制性因素(图1),而且添加Cys相比VC更能有效的提高杆菌肽效价(图2)。因此,提高杆菌肽发酵菌株内源性Cys的供给效率可能会更有效的促进效价合成。
2.4 半胱氨酸合成加强型基因工程菌株在10 L罐上进行发酵验证
菌株LC(对照组)和CY(实验组)在10 L发酵罐上的发酵特性,如:杆菌肽效价、生物量、过氧化氢酶活和Cys含量的变化如图4所示。

图410 L罐发酵过程中地衣芽孢杆菌LC和CY生物量、Cys、过氧化氢酶和杆菌肽产量的变化Fig.4 Change of cell growth,Cys,catalase and bacitracin production in a 10 L bioreactor by strain LC and CY
由图4可知,对照组和实验组杆菌肽效价变化趋势几乎一致,分别达到最高效价960 U/mL(30 h)和1 090 U/mL(28 h),后者杆菌肽效价比对照提高了13.5%。细胞生长趋势几乎一致,分别在26 h(实验组,84×109CFU/mL)和24 h(对照组,77×109CFU/mL)达到峰值。但是,CY菌株自溶时间比对照延后了2 h。对过氧化氢酶活力和Cys含量而言,20h之前Cys的含量几乎一样,但是进入主发酵期(20 h)后,实验组Cys含量明显高于出发菌株,分别到达峰值213.3mg/L(24h)和133.6 mg/L(26 h),比对照提高了近60%。
过氧化氢酶活变化与摇瓶实验结果一致,呈现持续上升的趋势,由于发酵罐培养过程中氧的供给效率远高于摇瓶培养过程,氧自由基生成效率以及对其去除所需要的过氧化氢酶也要远高于摇瓶水平,因此过氧化氢酶活明显高于摇瓶80%~120%。另外,CY菌株相比LC菌株过氧化氢酶活力(14~32 h)降低了15%~40%。由于半胱氨酸既是杆菌肽合成的前体氨基酸之一,同时其分子中的巯基(-SH)又是消除氧自由基的活性基团[16],因此,杆菌肽合成对Cys前体分子的需求与氧自由基去除(抗氧化胁迫)之间存在竞争性关系。CY菌株增强了Cys的合成,更好地满足了细胞对两者的生理需求,显著维持了细胞活性(生物量提高以及细胞自溶延后2 h)、促进了杆菌肽合成效率。另外,实验组的杆菌肽合成时间(28 h)比对照减少了2 h,可能与高活性细胞生长代谢更快速地消耗了营养物质,致使其在后期不足有关。这也为进一步的杆菌肽补料发酵研究提供了较为明确的补料窗口信息。
3 结论
由地衣芽孢杆菌发酵合成杆菌肽过程中的上清液前体氨基酸的含量变化,确定了Cys是限制氨基酸之一。另外,在高密度耗氧发酵过程中,尤其是高通风量和高转速培养条件下,活性氧自由基生成以及其对细胞造成的氧化胁迫是限制杆菌肽高效合成的限制性因素之一。发酵中期添加Cys可促进活性氧自由基的清除,但是内源性Cys作为前体氨基酸参与杆菌肽分子合成与参与自由基去除反应之间的矛盾不可调和。菌体为了保持其细胞活性而存活的生理需求很可能使Cys处于加速参与自由基去除系统的状态,这样就对其“前体氨基酸”的功能产生了竞争性抑制。半胱氨酸加强型工程菌株通过提高Cys的供给效率既满足了细胞清除自由基、减弱氧化胁迫效应的需求,又加强了Cys参与杆菌肽合成的效率,可谓是一举两得。同时,发酵后期工程菌株杆菌肽效价不再上升以及细胞自溶可能与发酵后期碳源不足有关,这也提供了较为准确的补料窗口信息,将在以后的研究中进行补料优化。
[1]邓坤,冀志霞,陈守文.溶氧对地衣芽胞杆菌DW2合成杆菌肽的影响[J].中国抗生素杂志,2009,34(11):664-669.
[2]KABISCH J,PRATZKA I,MEYER H,et al.Metabolic engineering of Bacillus subtilis,for growth on overflow metabolites[J].Microbial Cell Fact,2013,12(1):1-10.
[3]曾新年,鲍帅帅,李洪杰,等.双氧水对地衣芽胞杆菌合成杆菌肽的影响[J].中国酿造,2013,32(3):94-97.
[4]段菁菁,刘立明,华兆哲,等.氧化胁迫对Alkalibacteriumsp.F26防御酶和辅因子的影响[J].微生物学通报,2008,35(9):1385-1392.
[5]VOIGT B,SCHWEDER T,BECHER D,et al.A proteomic view of cell physiology ofBacillus licheniformis[J].Proteomics,2004,4(5):1465-1490.
[6]宋道军,李红,余增亮.N~+离子注入对不同辐射敏感性微生物超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的影响[J].生物物理学报,1998,14(2):325-330.
[7]赵素娟.活性氧在酿酒酵母乙醇胁迫中的作用[D].郑州:河南工业大学,2012.
[8]何桂珍.游离氨基酸和脂肪酸分析的应用[J].国际检验医学杂志,2001,22(3):162-163.
[9]鲍帅帅,张默,王新平,等.谷氨酸对地衣芽孢杆菌产杆菌肽的影响[J].中国酿造,2014,33(3):49-51.
[10]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2006,32(3):98-102.
[11]林纲.杆菌肽发酵过程中氨基酸等成分的测定方法研究和应用[D].上海:上海医药工业研究院,2006.
[12]WANG Z,WANG Y,XIE F,et al.Improvement of acetoin reductase activity enhances bacitracin production byBacillus licheniformis[J]. Process Biochem,2014,49(12):2039-2043.
[13]王勇.地衣芽胞杆菌发酵合成杆菌肽优化研究[D].武汉:湖北工业大学,2015.
[14]王镜岩.生物化学.上册[M].北京:高等教育出版社,2002:42-46.
[15]王文君.VC和VE的抗氧化和免疫功能[J].饲料工业,2000(12):14-15.
[16]刘建忠,刘杰,翁丽萍,等.巯基乙酸对过氧化氢酶的激活及其机制研究[J].中山大学学报:自然科学版,2001,40(6):39-41.
Q815
0254-5071(2017)05-0113-05
10.11882/j.issn.0254-5071.2017.05.024
2017-01-22
湖北大学绿康生物工程研究所开放课题(2015LBIHU603)
刘道奇(1991-),男,硕士研究生,主要从事农业生物技术研究工作。
*通讯作者:王志(1971-),男,副教授,博士,主要从事微生物工程研究工作。
