酒醅中产纤溶酶细菌的分离及发酵产酶研究
2017-06-01邓永平杨敏郭建华李琰刘晓兰艾瑞波
邓永平,杨敏,郭建华,李琰,刘晓兰*,艾瑞波
(1.齐齐哈尔大学食品学院,黑龙江齐齐哈尔161006;2.黑龙江省普通高校农产品深加工重点实验室,黑龙江齐齐哈尔161006;3.齐齐哈尔大学理学院,黑龙江齐齐哈尔161006)
酒醅中产纤溶酶细菌的分离及发酵产酶研究
邓永平1,2,杨敏1,郭建华1,2,李琰1,2,刘晓兰1,2*,艾瑞波3
(1.齐齐哈尔大学食品学院,黑龙江齐齐哈尔161006;2.黑龙江省普通高校农产品深加工重点实验室,黑龙江齐齐哈尔161006;3.齐齐哈尔大学理学院,黑龙江齐齐哈尔161006)
该研究从酒醅中筛选高产纤溶酶的细菌。经过初筛和复筛得到1株高产纤溶酶的菌株,命名为DL-1。通过菌株形态学和生理生化试验初步鉴定菌株DL-1为芽孢杆菌(Bacillussp.)。菌株DL-1产纤溶酶发酵试验结果表明,最适菌龄为4 h,最适碳源为牛肉膏,最适氮源为豆饼粉。在此条件下,所产的纤溶酶在血纤维蛋白平板上形成的溶圈面积可达379.79 mm2。
酒醅;纤溶酶;细菌;分离;鉴定

DENG Yongping1,2,YANG Min1,GUO Jianhua1,2,LI Yan1,2,LIU Xiaolan1,2*,AI Ruibo3
(1.College of Food and Biological Engineering,Qiqihar University,Qiqihar 161006,China;2.Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar 161006,China;3.College of Science,Qiqihar University,Qiqihar 161006,China)
心脑血管血栓栓塞性疾病是世界范围内引起死亡的主要原因,溶栓疗法是主要的治疗手段。纤溶酶可以预防和治疗心脑血管血栓栓塞症,具有溶解血栓和疏通血管的功效。目前,临床上使用的大多数溶栓药物是纤溶酶原激活剂或纤溶酶样蛋白如组织型纤溶酶原激活剂(tissue-type plasminogen activator,t-PA)、尿激酶(urokinase-type plasminogen activator,u-PA)和链激酶(streptokinase)[1]。这些药物疗效肯定,但是具有抗再灌注、发生急性冠状动脉再闭塞、出血并发症等副作用,并且价格昂贵[2]。因此,亟需开发天然来源的副作用较小或无副作用的替代品。为此,研究人员进行了大量的工作,分离到了多种纤溶酶产生菌,如根霉、芽孢杆菌、放线菌、好食脉孢菌、北虫草等[3-7]。其中芽孢杆菌是生产纤溶酶的优势菌,如纳豆激酶、枯草激酶及豆豉纤溶酶都是芽孢杆菌发酵的产物[4]。
在白酒生产工艺中,酒醅发酵是加入曲的粮糟在窖池内糖化发酵的过程,窖池中各种微生物类群的协同作用,对白酒的风格和质量影响很大,因此关于酒醅中微生态的研究一直倍受关注[8-9]。芽孢杆菌是酒醅发酵过程产生酱香味的主要菌群,能够产生酯类、醇类、芳香族类、醛酮类、吡嗪类等酱香味的典型物质[9-10]。有研究表明,已经从酒醅中分离到了芽孢杆菌[11-14],但是还没有获得产纤溶酶的菌株。
因此,本研究对酒醅中的产纤溶酶细菌进行了分离,经过初筛和复筛获得一株高产纤溶酶的菌株,对该菌株的形态特征、生理生化特征及发酵产纤溶酶进行了研究,以期为后续该菌产纤溶酶的分离纯化及性质研究奠定基础。
1 材料与方法
1.1 材料与试剂
酒醅样品:黑龙江北大仓集团有限公司。
牛血纤维蛋白原、牛凝血酶(200 U/支):中国医学科学院天津血研所;巴比妥钠(分析纯)、琼脂糖(生化试剂):国药集团化学试剂有限公司;其余试剂均为国产分析纯。
脱脂奶粉培养基:将脱脂奶粉10 g溶解于100 mL蒸馏水中,在115℃灭菌20 min;将琼脂15 g溶解于500 mL蒸馏水中,在121℃灭菌30 min;待冷却至45~50℃时,将两液混匀倒于平板,即为脱脂奶粉平板。
复筛培养基:10g/L葡萄糖,10g/L蛋白胨,2g/LNa2HPO4,1 g/L NaH2PO4,0.2 g/L CaCl2,0.5 g/L MgSO4,1 000 mL蒸馏水,调节pH值为7.0,121℃灭菌30 min。
纤维素培养基:羧甲基纤维素钠(sodiumcarboxymethyl cellulose-Na,CMC-Na)8 g,酵母膏l g,KH2PO30.25 g,琼脂15 g,溶解后,用蒸馏水定容至1 000 mL,加入10 mg/mL刚果红溶液5 mL,于121℃灭菌20 min,冷却倒平板,凝固后待用[14]。
种子培养基:葡萄糖1%,蛋白胨2%,NaCl 1%,pH7.0。液体发酵培养基:牛肉膏1%,豆饼粉1%,pH7.0。
血纤维蛋白平板:将0.25 g琼脂糖溶于50 mL生理盐水中,置于45℃水浴中保温30 min后,加入200 U的凝血酶,混匀;称取0.2 g牛血纤维蛋白原,溶于50 mL的巴比妥钠缓冲液(pH值为7.8)中,置于45℃水浴中保温5min。取5mL凝血酶溶液与5 mL纤维蛋白原溶液混合均匀,倒入直径为9cm的培养皿中,水平放置30min后即制得血纤维蛋白平板。
牛肉膏蛋白胨液体培养基、牛肉膏蛋白胨固体培养基、淀粉培养基、糖发酵培养基等的配制方法参照文献[15]。
1.2 仪器与设备
PYX-DHS隔水式电热恒温培养箱:上海跃进医疗器械厂;PHS-25型酸度计:上海精密科学仪器有限公司;Himac CF15RX冷冻离心机:天美科学仪器有限公司;Nikon 50i生物显微镜:尼康仪器(上海)有限公司。
1.3 实验方法
1.3.1 产纤溶酶细菌的筛选
(1)产纤溶酶细菌的初筛
用无菌水将采集的酒醅样品制成均匀悬液,系列稀释后选取适合稀释度的悬液涂布于脱脂奶粉培养基平板上,37℃倒置培养48 d。挑取溶圈直径与单菌落直径之比较大的菌株进一步纯化,获得的纯培养物转接于营养琼脂斜面,4℃保存。
(2)产纤溶酶细菌的复筛
将初筛所得产蛋白酶菌株挑取一环,接种于装液量为50 mL/250 mL的复筛培养基中,37℃、150 r/min通风培养24 h。将培养物在4℃条件下,10 000 r/min离心10 min,去除固形物,取10 μL上清液点接到血纤维蛋白平板上,37℃恒温保存6 h,测量血纤维蛋白溶解所形成的溶圈直径,求得溶圈面积,以溶圈面积表示菌株产纤溶酶的活力。
1.3.2 菌种形态学与生理生化特征
(1)微生物形态和染色观察:将产纤溶酶菌株接种于牛肉膏蛋白胨固体培养基表面,37℃培养48 h后观察菌落特征。利用光学显微镜观察产纤溶酶菌株的细胞形态,采用革兰氏染色法和芽孢染色法对菌株进行形态特征鉴定。
(2)生理生化特征:将复筛得到的产纤溶酶菌株接种于牛肉膏蛋白胨液体培养基中,37℃培养48 h,观察菌体培养特征。将该菌株接入不同pH值(分别为3.0、4.0、5.0、6.0、7.0、8.0)的牛肉膏蛋白胨液体培养基中,于37℃培养箱中培养48 h,观察菌株生长情况,判断其最适生长pH值;将该菌接种到牛肉膏蛋白胨液体培养基中,分别在不同温度(4℃、10℃、20℃、30℃、40℃、45℃)条件下培养48 h,确定其最适生长温度;利用淀粉培养基判断该菌是否可以向细胞外分泌淀粉酶;采用糖发酵试验确定该菌产酸产气情况。利用纤维素培养基确定该菌是否向胞外分泌纤维素酶;基础培养基(配制方法见参考文献[5])灭菌后分别加入过滤灭菌的10%含碳化合物溶液(供试碳源包括:葡萄糖、蔗糖、木糖、半乳糖、果糖、阿拉伯糖和麦芽糖),使其最终含量为1%,以未接菌培养基的作为对照,于37℃静置培养48 h,确定该菌对碳源的利用情况[16]。
1.3.3 液体发酵试验
斜面培养:采用牛肉膏蛋白胨固体斜面培养基活化所分离的菌株,在37℃静置培养24h,培养结束后于4℃保存。
种子生长曲线的绘制:将斜面保存的菌株接种于装液量为50 mL/250 mL的种子培养基中,37℃、180 r/min振荡培养10 h,定时取样,在波长600 nm处测定吸光度值,绘制所分离菌株的种子生长曲线。
液体发酵试验:在50mL/250mL的液体发酵培养基中接入培养4h的种子液,接种量为10%(V/V),37℃、180r/min振荡培养48 h。
1.3.4 纤溶酶活力的测定
酶的制备:发酵结束后,将发酵液于4℃、10 000 r/min离心10 min,收集上清液即为粗酶液。
纤溶酶活力的测定参照刘晓兰等[17]方法,采用血纤维蛋白平板法测定纤溶酶活力。取10 μL粗酶液点加于平板表面,37℃保温6 h后测溶圈面积。纤溶酶的活力与其在血纤维蛋白平板上形成的溶圈面积呈正相关[18],因此,以溶圈面积大小表示菌株产纤溶酶活力的高低。
2 结果与分析
2.1 产纤溶酶菌株的筛选
2.1.1 产纤溶酶菌株的初筛
纤溶酶可以水解血纤维蛋白,属于蛋白酶,所以先利用脱脂奶粉平板分离酒醅中产蛋白酶的微生物。经脱脂奶粉平板分离到12株产蛋白酶的菌株,测定这12株菌株形成的溶圈直径和菌落直径,结果见表1。由表1可知,这12株菌的菌落周围均有透明圈,说明这12株菌都可以向细胞外分泌蛋白酶,但是产酶活力高低有所差异。

表1 酒醅中产蛋白酶菌株的初筛结果Table 1 Preliminary screening results of protease-producing strains in the fermented grains
2.1.2 产纤溶酶菌株的复筛
将初筛所得的12株产蛋白酶菌株进行液体发酵,所得发酵液在4℃、10000r/min离心10min后,取10μL上清液点加于血纤维蛋白平板表面,37℃恒温保存6 h后测定血纤维蛋白平板上所形成的溶圈直径,计算溶圈面积,平行试验3次,结果如表2所示。

表2 产纤溶酶菌株的复筛结果Table 2 Secondary screening results of fibrinolytic enzyme-producing strains in the fermented grains
由表2可知,12株分离菌株中10株菌能够产纤溶酶,其中4号菌株的发酵液在血纤维蛋白平板上形成的溶圈面积最大,为(307.13±67.30)mm2,说明该菌株所产纤溶酶活力最大,因此选取4号菌株为高产纤溶酶的菌株,并命名为DL-1。
2.2 DL-1菌株的形态学与生理生化特征
2.2.1 菌落及菌株形态观察结果
利用牛肉膏蛋白胨固体培养基平板培养产纤溶酶菌株DL-1,用光学显微镜对菌株形态进行镜检,对产纤溶酶菌株DL-1进行革兰氏染色,结果见图1。由图1可知,菌株DL-1在平板上形成的菌落为圆形或者近似圆形,边缘锯齿状,菌落的中央稍凸起,不透明,灰白色,质地软,具有一定的湿度,有光泽。菌体呈杆状,两端钝圆,单个散生或3~5个链状排列,且菌株DL-1革兰氏染色结果呈紫色,为革兰氏阳性菌。
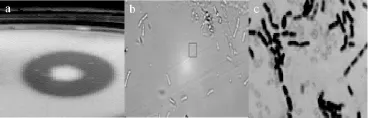
图1 菌株DL-1的菌落特征(a)和菌株形态(b)及革兰氏染色结果(c)Fig.1 Colony characteristics(a)and strain morphology(b)and gram staining(c)of strain DL-1
2.2.2 生理生化试验
对菌株DL-1进行液态静置培养,以判断该菌对氧气的需求情况。结果发现,该菌生长在液体培养基的表面,并贴试管内壁生长,因此判断该菌为好氧菌。菌株DL-1生理生化试验结果见表3。

表3 菌株DL-1生理生化试验结果Table 3 Results of physiological and biochemical experiments of strain DL-1
由表3可知,菌株DL-1在培养液pH值为5~7时均可以生长,当pH值为6~7时生长良好;在4℃、10℃、20℃条件下该菌不生长,在30 ℃、40℃条件下该菌皆可生长,在45℃、50℃条件菌株DL-1菌生长最旺盛,表明该菌在一定程度较耐热。由产胞外酶试验结果可知,淀粉水解试验、蛋白质水解试验和明胶液化试验结果均呈阳性,表示菌株DL-1可产生淀粉酶、蛋白酶,并且可以液化明胶;菌株DL-1不能再纤维素平板上形成溶圈,说明该菌不能向细胞外分泌纤维素酶。该菌能够利用葡萄糖、蔗糖、半乳糖、果糖、阿拉伯糖和麦芽糖作为碳源,均能产酸,不能利用木糖。结合形态学特性,初步鉴定该菌株为芽孢杆菌(Bacillussp.)。
2.3 菌株产纤溶酶的液体发酵研究
2.3.1 菌株DL-1种子生长曲线的绘制
将菌株DL-1接种于种子培养基,每隔1 h取样测定培养液吸光度值,绘制菌株DL-1种子生长曲线,结果如图2所示。由图2可知,在0~3 h内,培养液OD600nm值缓慢增长,说明菌体处于延迟期;在3~8 h培养时间内,OD600nm值迅速增长,菌体进入快速生长期,在培养时间为8 h时菌体生物量达到最大。养时间内>8 h后,OD600nm值不再增多,表明菌体生长进入稳定期。

图2 菌株DL-1的种子生长曲线Fig.2 Growth curve of seed of strain DL-1
处于快速生长期的菌种酶系活跃,代谢旺盛,可以缩短发酵的延迟期,最适宜作为发酵的种子[19]。因此,分别将培养3~8 h的新鲜种子液进行液体发酵试验,结果见图3。由图3可知,菌龄为4 h的种子液发酵产溶圈面积最大,即产纤溶酶活力最高,因此,确定种子培养时间为4 h。

图3 菌株种龄对产纤溶酶活力的影响Fig.3 Effect of cell age on the fibrinolytic enzyme activity
2.3.2 液体发酵培养基的优化
以蛋白胨为氮源,分别以葡萄糖、蔗糖和牛肉膏为碳源,研究不同碳源对菌株DL-1产纤溶酶的影响,结果见图4。
由图4可知,不同种类碳源对菌株产纤溶酶影响较大,葡萄糖属于速效碳源,易于被菌体利用,菌体生长迅速但是不利于积累代谢产物,而使纤溶酶活力较低。以蔗糖为碳源时酶活力略有升高,以迟效碳源牛肉膏为碳源时酶活力最高,可能因为牛肉膏中成分复杂,其中富含生长因子,对酶合成具有促进作用,因此,选择牛肉膏为碳源。

图4 不同碳源对产纤溶酶活力的影响Fig.4 Effect of different carbon sources on the fibrinolytic enzyme activity
以硫酸铵、蛋白胨、豆粕粉和豆饼粉为氮源,研究不同氮源对产纤溶酶的影响,结果见图5。

图5 不同氮源对纤溶酶活力的影响Fig.5 Effect of different nitrogen sources on the fibrinolytic enzyme activity
由图5可知,不同种类氮源对菌株DL-1产纤溶酶影响较大,硫酸铵作为速效氮源,能够被菌体快速利用,导致培养基pH降低,不适于菌体继续生长及产纤溶酶,所以产纤溶酶活力较低;蛋白胨、豆粕和豆饼均为迟效氮源,蛋白质含量较高,这些有机氮源可提高产纤溶酶活力,可能是因为其含有的蛋白质降解产生的短肽可作为产酶诱导剂[15]。其中,豆饼粉为氮源时酶的活力最高,因此,选择豆饼为氮源,此时,发酵液中的纤溶酶在血纤维蛋白平板上可形成面积为379.79mm2的溶圈,是鸡腿菇纤溶酶活力的2.3倍[18]。
3 结论
本研究以酒醅为试验材料,经过初筛和复筛试验,筛选出高产纤溶酶的菌株DL-1,结合形态学和生理生化学试验初步鉴定菌株DL-1为芽孢杆菌(Bacillussp.)。对菌株DL-1产纤溶酶液体发酵培养基进行了研究。结果表明,当以牛肉膏为碳源,以豆饼粉为氮源,接入菌龄为4 h的液体种子,菌株DL-1的发酵液在血纤维蛋白平板上可形成面积为379.79 mm2的溶圈。
本研究为后续研究菌株DL-1产纤溶酶的培养条件、分离纯化和酶学性质奠定了基础,也为纤溶酶提供了新的来源。
[1]CUI L,DONG M S,CHEN X H,et al.A novel fibrinolytic enzyme from Cordyceps militaris,a Chinese traditional medicinal mushroom[J].World J Microbiol Biotechnol,2008,24(4):483-489.
[2]KIM J H,KIM Y S.Characterization of a metalloenzyme from a wild mushroom,Tricholoma saponaceum[J].Agr Biol Chem,2001,65(2): 356-362.
[3]LIU X L,DU L X,LU F P,et al.Purification and characterization of a novel fibrinolytic enzyme fromRhizopus chinensis12[J].Appl Microbiol Biotechnol,2005,67(2):209-214.
[4]YEO W S,SEO M J,KIM M J,et al.Biochemical analysis of a fibrinolytic enzyme purified fromBacillus subtilis strain A1[J].J Microbiol, 2011,49(3):376-380.
[5]邓永平,刘晓兰,韩杨,等.一株产纤溶酶放线菌YY21的生理生化特征和抑菌活性研究[J].食品工业科技,2015,36(4):163-166.
[6]LIU X L,KOPPARAPU N K,ZHENG H C,et al.Purification and characterization of a fibrinolytic enzyme from the food-grade fungusNeurospora sitophila[J].J Mol Catal B Enzym,2016,134:98-104.
[7]LIU X L,KOPPARAPU N K,SHI X,et al.Purification and biochemical characterization of a novel fibrinolytic enzyme from culture supernatant ofCordyceps militaris[J].J Agr Food Chem,2015,63(8):2215-2224.
[8]WANG C L,SHI D J,GONG G L.Microorganisms in daqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24 (10):2183-2190.
[9]SHI S,ZHANG L,WU Z,et al.Analysis of the fungi community in multiple-and single-grainsZaopeifrom aLuzhou-flavorliquor distillery in western China[J].World J Microbiol Biotechnol,2011,27(8):1869-1874.
[10]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[11]钟姝霞,邓杰,汪文鹏,等.酱香型酒醅产香芽孢杆菌的分离鉴定及其代谢产物分析[J].现代食品科技,2017,33(4):1-8.
[12]杨春霞,廖永红,刘峻雄,等.牛栏山二锅头酒醅中芽孢杆菌分离鉴定及发酵风味分析[J].食品工业科技,2012,33(9):69-74.
[13]罗俊成.浓香型白酒糟醅中芽孢杆菌属细菌的分类鉴定和16S rDNA序列系统发育分析[D].成都:四川大学,2007.
[14]郭娟.固态发酵酒醅中微生物群落的分析鉴定方法浅析[J].中国酿造,2013,32(9):116-119.
[15]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,1999:214-222.
[16]张玲玲,崔德杰,洪永聪,等.氯氰菊酯降解放线菌的分离与筛选[J].青岛农业大学学报:自然科学版,2008,25(4):280-284.
[17]刘晓兰,张雯舒,郑喜群,等.蛹虫草发酵产物新纤溶酶的分离纯化[J].华南理工大学学报:自然科学版,2012,40(5):107-114.
[18]李巍巍,刘晓兰,时晰,等.鸡腿菇产溶栓酶液体发酵条件优化[J].工业微生物,2009,39(2):49-54.
[19]岑沛霖,蔡谨.工业微生物学[M].北京:化学工业出版社,2012:139-140.
Q815
0254-5071(2017)05-0067-05
10.11882/j.issn.0254-5071.2017.05.014
2016-12-27
齐齐哈尔市科学技术计划项目(SFGG-201578)
邓永平(1978-),女,副教授,硕士,研究方向为微生物学与酶学。
*通讯作者:刘晓兰(1962-),女,教授,博士,研究方向为发酵工程与酶工程。
