川渝地区部分猪场猪瘟、猪伪狂犬病和口蹄疫的抗体监测
2017-06-01骆泽礼王敬铭蒋尚蓉彭思毅李明朔赵光伟杨晓伟
骆泽礼,王敬铭,李 威,蒋尚蓉,彭思毅,李明朔,赵光伟,杨晓伟
(西南大学荣昌校区动物医学系,重庆 402460)
川渝地区部分猪场猪瘟、猪伪狂犬病和口蹄疫的抗体监测
骆泽礼,王敬铭,李 威,蒋尚蓉,彭思毅,李明朔,赵光伟,杨晓伟
(西南大学荣昌校区动物医学系,重庆 402460)
为评价猪场的疫苗免疫效果,制定合理的免疫程序。利用酶联免疫吸附(ELISA)的方法,对四川省、重庆市6个规模化养猪场的409份血清,分别进行猪瘟、猪伪狂犬病和口蹄疫的抗体检测。结果显示,A、B、C、D、E和F等6个猪场的猪瘟抗体阳性率分别为91%、85.71%、92.5%、79.8%、75%和97.33%,猪伪狂犬病gB抗体阳性率分别为100%、80.2%、100%、93%、75%和96%,猪口蹄疫抗体阳性率分别为72%、76.7%、79.59%、80.8%、0和82.67%,场间差异显著。统计学分析显示,母猪中的这3种疫病抗体阳性率均显著高于仔猪。其中,母猪、仔猪的猪瘟抗体阳性率分别为98.21%、27.27%,猪伪狂犬病gB抗体阳性率分别为98.21%、42.5%,猪口蹄疫抗体阳性率分别为83.41%、42.5%。本研究结果可为川渝地区规模化猪场疫苗免疫程序的制定提供参考。
猪瘟;伪狂犬病;口蹄疫;抗体检测
猪瘟(Classical swine fever,CSF)、伪狂犬病(Pseudorabies,PR)和口蹄疫(Foot and mouth disease,FMD)均是猪场的常见传染病,会给猪场造成重大经济损失[1]。近年来,随着我国养猪业的集约化、规模化发展,猪饲养密度越来越大,种猪交流越来越频繁,这为猪病的发生、传播创造了条件。目前,这几种猪病在全国各地不断暴发和流行,并呈现持续蔓延趋势,对集约化养猪业危害更为严重,极大影响和制约了我国畜牧业的健康发展[2]。到目前为止,对这些疫病还没有特效的治疗手段,只能以预防为主[3]。
随着越来越多猪病疫苗的陆续上市,准确评价疫苗的免疫效果极为重要,而检测免疫后的抗体水平是评价疫苗的有效方法。疫苗的免疫效果受很多因素影响,诸如疫苗的质量、疫苗的储存和运输条件、免疫程序、接种途径、接种对象的个体差异等[4]。了解猪场的免疫水平,实时监测猪群的免疫状况,及时微调免疫程序,对于保证猪群的健康十分重要。同时,一定阶段的抗体监测数据,可为猪场制定更为科学合理的免疫程序提供依据[5]。及时开展免疫效果监测、评估免疫保护效果是重大动物疫病强制免疫工作的重要手段。本监测获得的这3种疫病的抗体数据,为该地区的猪场制定科学合理的免疫程序提供了依据。
1 材料和方法
1.1 血清样本
A、B、C、D、E场均为重庆市养猪场,F场是四川省万源县某养猪场。2016年6月在四川省、重庆市6个规模化养殖场抽检409份血清(均为有效血清),进行CSF、PR和FMD抗体检测。其中,母猪按20%~35%的比例随机抽样;仔猪按照10%左右的比例抽检,日龄为(63±7)天;种公猪100%检测(表1)。6家猪场均使用上海某生物制品有限公司商品疫苗进行免疫。对母猪和种公猪血清样本,在2次免疫后21~42天采集;仔猪的免疫程序为1日龄接种PR疫苗,45日龄接种CSF疫苗,52日龄接种FMD疫苗,对FMD血清样本,在疫苗免疫后10~14天采集。
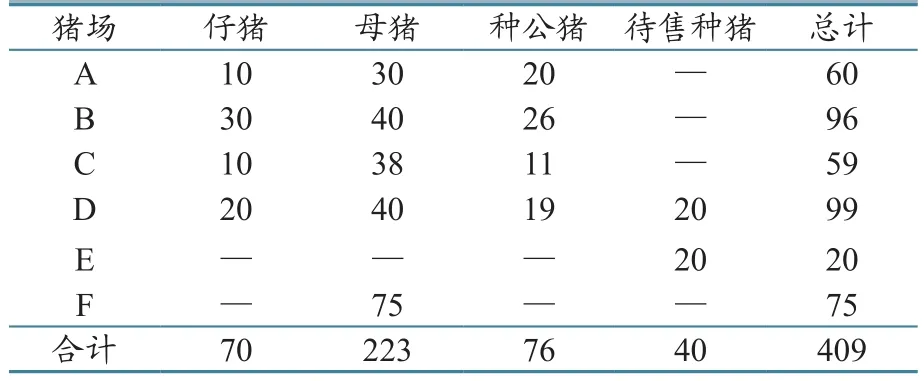
表1 各猪场采集的血清样品数量 (单位:份)
1.2 检测试剂盒
FINDE CSF抗体快速检测试剂盒(生产批号20160602)、FINDE PR gB抗体快速检测试剂盒(生产批号20160602)和FINDE猪FMD抗体快速检测试剂盒(生产批号20160602),均购自深圳芬德生物科技有限公司。
1.3 检测方法
对CSF、PR gB和FMD抗体的检测,采用酶联免疫(ELISA)方法,分别应用FINDE CSF、PR gB和FMD抗体快速检测试剂盒,按照各自的试剂盒说明书操作。
1.3.1 样品准备。①取动物全血,按常规方法制备血清,要求血清清亮,无溶血、无污染。样品在1周内可于2~8 ℃保存,长期保存需置-20 ℃以下。②用样品稀释液将待检血清按40倍稀释(将5 µL血清加入195 µL样品稀释液中,混匀),对阴、阳性对照,不用稀释。③浓缩洗涤液使用前,应恢复至室温,使沉淀溶解,然后用蒸馏水或去离子水作20倍稀释。
1.3.2 检测步骤。①使用前将试剂盒置室温30 min,使其恢复至室温。②取所需用量酶标板,设空白对照1孔,阴、阳性对照各2孔,将未用的板条尽快密封,2~8 ℃保存。③在空白对照孔,加样品稀释液100 µL;在阴、阳性对照孔,分别加入阴、阳性对照100 µL;在每个样品孔,加入稀释后的样品100 µL(97.5 µL样品稀释液+2.5 µL血清)。④混匀,置37 ℃反应30 min。⑤抽去孔内液体,每孔加满洗涤液,静置30 s后弃去,重复洗涤5次,拍干。⑥每孔加酶标记物100 µL(空白孔除外),置37 ℃反应30 min。⑦洗涤,同步骤⑤。⑧每孔依次加底物液A、B各50 µL,混匀,37 ℃避光反应10 min。⑨每孔加终止液50 µL,混匀,用空白孔调零,于450 nm(可用630 nm做参比波长)测定各孔吸光值(A值)。
1.3.3 结果判定。样品A值≥0.38为阳性;样品A值在0.2~0.38之间为可疑;样品A值<0.2为阴性。本实验结果为阴性或可疑时,表明猪只抗体水平不足,建议补打相应疫苗。
1.4 统计分析
应用Microsoft Excel软件进行数据分析,利用其中的CHITEST统计函数,求出两两比较的概率(P)值,与常用概率P=0.05比较,得出两两比较间的显著水平。判定标准:P>0.05,差异不显著;P≤0.05,差异显著。
2 检测结果
2.1 CSF抗体检测结果
A、B、C、D、E和F场的CSF抗体总阳性率分别为91%、85.71%、92.5%、79.8%、75%和97.33%。统计学分析显示:F场与B、D、E场之间,C、A场与D、E场之间差异显著;F、C、A场之间,C、A、B场之间,B与D场之间,B、D、E场之间差异不显著(表2)。

表2 CSF抗体阳性率统计对比结果 (单位:%)
2.2 PR gB抗体检测结果
A、B、C、D、E和F场的PR gB抗体总阳性率分别为100%、80.2%、100%、93%、75%和96%。统计学分析显示:A、C场与F、D、B、E场之间,F场与B、E场之间,D场与B、E场之间差异显著;A与C、F与D、B与E场之间差异不显著(表3)。
2.3 FMD抗体检测结果
A、B、C、D、E和F场的FMD抗体总阳性率分别为72%、76.7%、79.59%、80.8%、0和82.67%。统计学分析显示:F与E、D与E、C与E、B与E、A与E场之间差异显著,F、D、C、B、A场之间差异不显著(表4)。

表3 PR gB抗体阳性率统计对比结果 (单位:%)

表4 FMD抗体阳性率统计对比结果 (单位:%)
2.4 6个猪场母猪与仔猪总阳性率比较
母猪、仔猪的CSF抗体总阳性率分别为98.21%、27.27%,PR gB分别为98.21%、42.5%,FMD分别为83.41%、42.5%。统计学分析显示,母猪与仔猪的CSF、PR(gB)、FMD抗体阳性率均为差异显著(表5)。
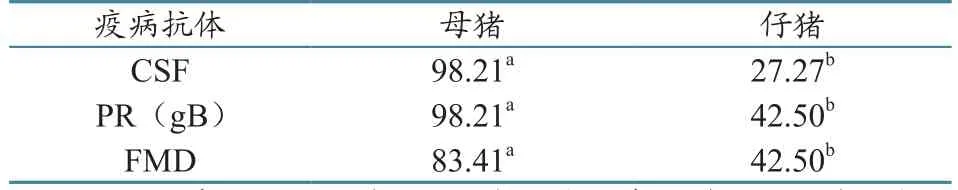
表5 6个猪场3种疫病的母猪与仔猪总阳性率比较(单位:%)
3 分析与讨论
抗体检测的作用主要是评估疫苗免疫效果和调整免疫程序,指导和完善猪场的疾病防控方案[6]。国家强制免疫计划规定CSF、PR和FMD抗体的合格率必须达到70%以上。从上述检测结果可知,这6个规模化养殖场的血清抗体阳性率均处于可接受的水平。但是要想控制上述3种疫病,最为理想的猪群抗体阳性率应在90%以上[1]。
从这6个猪场409份血清的CSF、PR gB和FMD抗体检测结果来看,不同猪场的不同疫病抗体阳性率存在不同程度的差异:在CSF抗体检测中,A、B、C和D场的种公猪阳性率均达了100%,D场和E场的待售种猪阳性率分别为95%和75%;在PR gB抗体检测中,A、B、C和D场的种公猪阳性率均为100%,A、D和E场的待售种猪阳性率分别为100%、100%和75%;在FMD抗体检测中,A、B、C、D场的种公猪阳性率分别为95%、96.15%、63.63%、89.47%,D场和E场的待售种猪阳性率分别为60%和0。
造成这些差异的原因可能与疫苗的接种次数、免疫程序、免疫对象、人为误差等因素有关。这6个养殖场的CSF和PR gB抗体阳性率均较高,免疫效果较好;在FMD抗体检测中,A、B、C、D、F场的免疫效果达到了国家要求,但E场的阳性率却为0,因此应及时对E场的猪群进行补免。
6个猪场母猪的CSF、PR gB和FMD抗体总阳性率远远大于仔猪,这主要与免疫接种的次数有关。母猪年龄较大,接种次数多,产生的抗体水平较高,而仔猪年龄小,接种次数少,产生抗体水平自然就低。所以,应加强对仔猪的免疫,以减少疾病的发生。
目前,对于规模化猪场来说,科学的做法是做好整体猪群重要传染病的预防工作。首先根据猪群抗体的动态水平,制定个性化的免疫程序,并对疫苗的免疫效果进行跟踪监测,对免疫不合格的猪及时补免;其次对猪群要定期进行重要传染病(如CSF、PR、FMD、PRRS等)的检测,及时淘汰带毒猪,控制传染源,逐步净化猪群[7];最后要加强养殖管理,坚持猪群全进全出制度,尽量减少从外界引种而带入病原的机会,认真做好隔离、检疫、消毒工作,实施封闭式管理[8]。只有采取以上综合防控措施,才能有效控制猪传染病的发生及传播。
[1]陈溥言. 兽医传染病学 [M]. 5版 北京:中国农业出版社,2006.
[2]殷震,刘景华. 动物病毒学[M]. 2版 北京:科学技术出版社,2007:1180-1181.
[3]熊丁杰. 猪瘟抗体阻断检测方法的建立和对猪瘟活疫苗免疫效果的评价[D]. 成都:四川农业大学,2010.
[4]郭小玲. 河南省猪瘟、高致病性禽流感疫苗临床应用效果调查评估[D]. 郑州:河南农业大学,2012.
[5] 黄增燕,张任娜,朱建国. 某规模化养猪场猪瘟、蓝耳病及伪狂犬抗体检测与分析[J].中国猪业,2012(10):43-45.
[6]刘兆文,郭林,肖焕星. 江苏某规模化猪场猪瘟、蓝耳病、伪狂犬gE抗体检测与分析[J].今日养猪业,2015(8):73-75.
[7]韩崇江,张大丙. 部分猪场猪瘟抗体有效保护水平的探讨[J]. 中国畜牧兽医,2009,36 (10):191-192.
[8] 王大林,索绪峰,王建新,等. 海南省规模化猪场猪瘟免疫抗体的检测与免疫效果分析[J]. 养猪,2005(5):32.
(责任编辑:朱迪国)
Antibody Surveillance on Classical Swine Fever,Pseudorabies and Foot-and-mouth Disease in Some Swine Farms of Sichuan-Chongqing Region
Luo Zeli,Wang Jingming,Li Wei,Jiang Shangrong,Peng Siyi,Li Mingshuo,Zhao Guangwei,Yang Xiaowei
(Department of Veterinary Medicine,Rongchang Campus of Southwest University,Chongqing 402460)
In order to recognize the immune status and to establish proper immune program,levels of specific antibodies against Classical swine fever virus(CSFV),Pseudorabies virus(PRV)and Foot-and-mouth disease virus(FMDV)in some farms of Sichuan-Chongqing region were investigated. By the method of ELISA,409 serum samples from 6 large scale farms were conducted detection. Results showed that the antibody positive rates of CSFV in these six farms were 91%,85.71%,92.5%,79.8%,75% and 97.33%,that of PRV gB were 100%,80.2%,100%,93%,75% and 96%,and that of FMDV were 72%,76.7%,79.59%,80.8%,0 and 82.67%,respectively,showing significant difference. Furthermore,through statistical analysis,antibody levels against the 3 viruses existing in sows were all higher than those in piglets. The antibody positive rates of CSF in sows and piglets were 98.21% and 27.27%. And the corresponding numerical values were 98.21% and 42.5% in PRV,83.41% and 42.5% in FMD. These findings would offer references for determining the immunization procedure for large-scale swine farms in Sichuan-Chongqing region.
Classical swine fever;Pseudorabies;Foot-and-mouth disease;antibody detection
S851.3
B
1005-944X(2017)04-0016-04
10.3969/j.issn.1005-944X.2017.04.005
西南大学教育教学改革研究项目(2016JY097、2016JY100);西南大学基本科研项目(XDJK2013C057)
杨晓伟
