阿托伐他汀对淀粉样β蛋白诱导大鼠原代海马神经元损伤保护作用的研究
2017-06-01王楠隋海娟张玲玲金英赵彬
王楠 隋海娟 张玲玲 金英 赵彬
阿托伐他汀对淀粉样β蛋白诱导大鼠原代海马神经元损伤保护作用的研究
王楠 隋海娟 张玲玲 金英 赵彬
目的 探讨阿托伐他汀(atorvastatin,Ato)对β淀粉样蛋白(Aβ)诱导的体外培养原代海马神经元损伤保护作用。方法 选用出生0~24 h Sprague-Dawley大鼠乳鼠,解剖显微镜下分离海马,进行海马神经元体外培养,培养10 d后用于实验。将培养的海马神经元分为3组:(1)正常对照组:加入含有1%(质量浓度) DMSO培养基;(2)Aβ1-42组:加入1.25 μmol/L Aβ;(3)Aβ(1.25 μmol/L)+不同浓度阿托伐他汀组(0.1、0.5、1、2.5 μmol/L)。应用CellTiter-GloTM荧光细胞活性试剂盒检测培养海马神经元ATP含量,用以反映神经元活力;通过CytoTox-ONETM试剂盒测定培养细胞上清液中乳酸脱氢酶(LDH)含量,用以测定神经元细胞膜的损伤程度;应用免疫荧光染色观察神经元突触素(SYP)、突触后致密蛋白95(PSD-95)、bassoon蛋白表达。Western印迹法半定量检测海马神经元突触蛋白SYP、PSD-95、bassoon的改变。结果 与正常对照组比较,培养10 d海马神经元经1.25 μmol/L Aβ1-42作用48 h后,其ATP和LDH水平均明显降低(均P<0.01),而0.5、1.0、2.5 μmol/L Ato组能够明显抑制Aβ1-42引起的ATP和LDH水平降低(P<0.01)。免疫荧光及Western blot结果显示,1.25 μmol/L Aβ1-42可使海马神经元SYP、PSD-95、bassoon蛋白表达明显降低,而Ato能够明显抑制Aβ1-42引起的SYP、PSD-95、bassoon蛋白表达降低。结论 Ato对Aβ诱导的体外培养海马神经元毒性有保护作用,这种保护作用可能与Ato对抗Aβ1-42引起的海马神经元SYP、PSD-95、bassoon表达降低有关。
阿尔茨海默病;阿托伐他汀;海马神经元;淀粉样β蛋白;突触蛋白
阿尔茨海默病(Alzheimer disease,AD)是一种中枢神经系统退行性疾病,是老年痴呆的主要原因[1]。虽然AD患者脑内的病理学改变比较明确,但其发病机制尚不清楚。许多研究表明β淀粉样蛋白(amyloid-β peptide,Aβ)在AD患者脑内沉积是AD发病的中心环节。AD临床表现为进行性记忆功能障碍和认知行为异常。大量研究表明AD的记忆功能障碍与可溶性Aβ1-42触发的突触功能失调和过度磷酸化tau蛋白聚集有关[2]。离体和再体实验研究表明Aβ1-42能激活谷氨酸受体,导致异常钙离子内流,抑制长时程突触传递增强,最终导致突触功能丧失[3-4]。阿托伐他汀(atorvastatin,Ato)属于他汀类药物,因其具有半衰期长、代谢好、强效安全的调脂作用,而广泛用于临床。目前认为长期服用他汀类药物能降低AD的发病率[5-6],他汀类药物有降低Aβ产生、抑制炎性反应、抗凋亡、抗氧化作用[7-8]。该研究应用体外培养大鼠乳鼠海马神经元为模型,进一步探讨Ato对Aβ1-42引起的海马神经元损伤保护作用机制。
1 材料和方法
1.1 药品与试剂 Ato购于LKT Laboratories, Inc.公司(批号23922105,纯度>98%),用二甲亚砜(DMSO)溶解。Aβ1-42(批号:SCP0038)为Sigma公司产品,用无菌生理盐水溶解,溶解后37 ℃孵育24 h,使其成为聚集状态。DMEM、F12培养基购于Invitrogen公司;DMSO、胰蛋白、L-多聚赖氨酸均购于Sigma公司;新生胎牛血清、马血清购于广州蕊特生物科技有限公司;HEPES购于Calbiochem公司;阿糖胞苷购于意大利S.P.A公司;CellTiter-GloTM荧光细胞活性试剂盒(G7570)、CytoTox-ONETMHomogeneous Membrane Inte-grity试剂盒(G7890)购自Promega公司;鼠突触相关蛋白突触素(synaptophysin,SYP)多克隆抗体、兔突触后致密蛋白95(PSD95)多克隆抗体购自Santa Cruz公司;兔bassoon多克隆抗体(ab76065)、山羊抗鼠二抗购自Abcam公司;β-肌动蛋白(β-actin)抗体购于Beyotime试剂公司;SuperSignal West Pico化学发光底物购于美国Thermo scientific公司。其他相关试剂均由辽宁医学院药理实验室提供。
1.2 方法
1.2.1 海马神经元原代培养:取出生24 h以内的SD 大鼠乳鼠(辽宁医学院动物实验中心提供),75%(体积分数)酒精消毒,取出海马,剪成1 mm3左右的小块。加入 0.125%(质量浓度)胰蛋白酶进行消化。待细胞分散后,终止消化。200目筛网过滤,1000g离心10 min,用含10%(体积分数)胎牛血清和10%(体积分数)马血清的DMEM/F12培养基制成细胞悬液,调整细胞密度为1×105/L~1×107/L,接种在铺有L-多聚赖氨酸培养皿或6孔培养板中,置于37 ℃、5%(体积分数)CO2培养箱中培养。培养48 h后加入含阿糖胞苷(终浓度为5 mg/L)的培养基,抑制非神经细胞增殖。以后每3 d半量换液1次。
1.2.2 细胞处理及分组:海马神经元培养10 d用于实验,并分为3组:(1)正常对照组:加入含有1%(质量浓度)DMSO培养基;(2)Aβ1-42组:加入浓度1.25 μmol/L的Aβ;(3)Aβ(1.25 μmol/L)+不同浓度Ato组(0.1、0.5、1.0、2.5 μmol/L,以下分别简称Ato 0.1、0.5、1.0、2.5 μmol/L组):将不同浓度Ato加入到培养神经元作用1 h,然后加入Aβ作用48 h。
1.2.3 细胞活力检测:将接种在96孔培养板的海马神经元经各药物处理后,按CellTiter-GloTM荧光细胞活性试剂盒和CytoTox-ONETMHomo- geneous Membrane Integrity试剂盒操作步骤进行ATP含量及乳酸脱氢酶(LDH)释放测定。
1.2.4 免疫荧光染色检测SYP、PSD-95和bassoon表达:培养10 d的海马神经元进行处理后移去培养基,用PBS漂洗3次;用新鲜配制的4%(质量浓度)多聚甲醛室温固定30 min,PBS漂洗3次;0.3%(质量浓度)TritonX-100作用30 min,PBS漂洗3次;室温下3%(体积分数)山羊血清封闭30 min;加入SYP、PSD-95、bassoon抗体(1∶100)4℃过夜,PBS漂洗后,加入异硫氰酸荧光素(FITC)标记的二抗和Cy3标记的二抗作用2 h。荧光倒置显微镜下检测SYP、PSD-95、bassoon表达。
1.2.5 Western印迹法检测SYP、PSD-95、bassoon蛋白表达:原代培养的海马神经元,经各组处理后,用冷的PBS冲洗,立即放入预冷的裂解缓冲液中,4℃超声粉碎后,12 000g离心,取上清,用BCA法测定蛋白质含量,以牛血清白蛋白为标准品,将各组蛋白浓度调成一致。用10%~12%(质量浓度)的SDS-PAGE分离蛋白质,每个泳道蛋白上样量为20 μg。为准确判断目的蛋白带的位置,一个泳道加See Blue Plus 2预染蛋白标记物,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入3%(体积分数)牛血清白蛋白中,封闭60 min。将膜放入一抗中(1∶1000),4℃过夜。TTBS冲洗后,将膜放入二抗(1∶1000)中,室温孵育1~2 h,然后用TTBS洗膜3次,每次10 min,将膜在SuperSignal West Pico底物工作液中孵育5 min,吸干多余试剂,放置化学发光凝胶系统分析仪中进行Ecl化学发光。每个抗体测定时都进行β-肌动蛋白测定,以保证蛋白上样量的一致性。利用Visionworks 6.3.3图像采集及分析软件对蛋白带进行分析。实验重复3次。
1.3 统计学处理 实验数据由Spss11.0统计软件完成,符合正态分布的计量资料用均数±标准差表示,采用One-way ANOVA分析,两两比较采用LSD检验。以P<0.05表示差异有统计学差异。
2 结果
2.1 Ato对Aβ1-42诱导海马神经元细胞活力影响 与正常对照组比较,Aβ1-42组ATP和LDH水平均降低(P<0.01);与Aβ1-42组比较,Ato 0.5、1.0、2.5 μmol/L组ATP和LDH水平均升高(P<0.01),而Ato 0.1 μmol/L组ATP和LDH水平无统计学变化(P>0.05)。结果见表1。

表1 各组海马神经元ATP和LDH水平比较(±s,n=3,%)
注:LDH:乳酸脱氢酶;Ato:阿托伐他汀;Aβ:β淀粉样蛋白,图1、2同;与正常对照组比较,aP<0.01;与Aβ1-42组比较,bP<0.01;与Ato 0.5 μmol/L组比较,cP<0.01;与 Ato 1.0 μmol/L组比较,dP<0.01
2.2 免疫荧光检测 结果见图1。(1)SYP免疫阳性反应呈点状沿神经突起和神经元胞体周围排列。正常对照组海马神经元SYP点状排列密集,荧光强度高,Aβ1-42组海马神经元SYP较正常对照组明显减少,加入Ato 1.0 μmol/L可对抗Aβ引起的SYP减少。(2)bassoon蛋白在神经元成点状分布,应用Aβ1-421.25 μmol/L作用48 h,bassoon蛋白表达量明显降低,荧光结果表现为点状密度和强度明显降低。在加入Aβ1-42前1 h加入Ato 1.0 μmol/L可明显对抗Aβ1-42引起的海马神经元bassoon蛋白表达降低。(3)PSD-95蛋白在神经元胞体和突起成点状分布。Aβ1-42组PSD-95蛋白表达量明显降低,表现为点状密度和强度明显降低,在加入Aβ1-42前1 h加入Ato 1.0 μmol/L可明显对抗Aβ1-42引起的海马神经元PSD-95表达量降低。

注:SYP:突触素,PSD-95:突触后致密蛋白95,图2同 图1 荧光倒置显微镜下观察各组大鼠海马神经元突触蛋白SYP、bassoon、PSD-95表达(免疫荧光,×40)
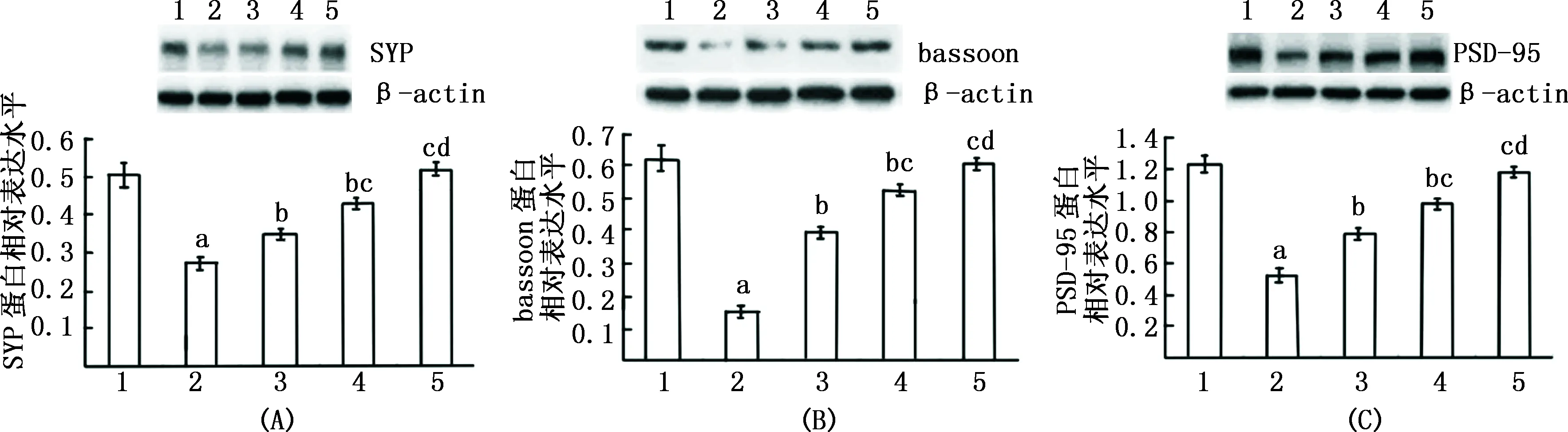
注:1:正常对照组;2:Aβ1-42组;3:Ato 0.5 mmol/L组;4:Ato 1.0 mmol/L组;5:Ato 2.5 mmol/L组;与正常对较照组比,aP<0.01;与Aβ1-42组比较,bP<0.01;与Ato 0.5 μmol/L组比较,cP<0.01;与 Ato 1.0 μmol/L组比较,dP<0.01 图2 Western blot检测各组大鼠海马神经元 SYP、bassoon和PSD-95 蛋白表达比较
2.3 Western blot检测 与正常对照组比较,Aβ1-42组SYP、PSD-95、bassoon蛋白表达减少,而Ato(0.5、1.0、2.5 μmol/L)可明显对抗Aβ1-42引起的海马神经元SYP、bassoon、PSD-95蛋白表达减少,并呈明显浓度依赖性(图2)。
3 讨论
AD患者大脑中老年斑的主要成分Aβ可导致突触功能损害,可能是发病机制中的起始因素和关键环节[9],Aβ有40~43个氨基酸残基,主要有Aβ40和Aβ42两种形式,其中Aβ42聚集性最强,有较强神经细胞毒性[10-11]。研究结果显示沉积状态Aβ可引起神经突退缩和神经元变性[12]。ATP是活细胞新陈代谢的一个指标,通过测定培养细胞ATP的含量可反映细胞活力[13]。测定LDH释放可反映细胞膜受损程度。本研究结果显示,Aβ1-42组ATP和LDH水平较对照组降低,表明Aβ1-42对海马神经元有明显的神经毒性作用,而Ato组ATP和LDH水平高于Aβ1-42组,提示Ato可对抗Aβ1-42对海马神经元的损伤作用;另外,通过采用不同浓度Ato进行干预显示,在一定范围内,随着Ato浓度从0.5、1.0、2.5 μmol/L逐渐增加,ATP和LDH水平逐渐增加,提示Ato对抗Aβ1-42对海马神经元的损伤作用逐渐增强,具有剂量依赖关系。
大脑是由相互连接的神经元网络形成,突触-突触连接是神经元之间信息传递的重要部位,与学习、记忆密切相关,突触容易发生动态变化,突触可塑性是学习和记忆的基础。研究表明突触的功能异常和丢失被广泛认为是AD患者认知功能下降的细胞机制[14]。突触蛋白是一组与突触相关的具有神经元特异性的磷酸蛋白,能够调节神经递质的释放并参与神经元早期发育。SYP是最丰富的突触囊泡蛋白,高度集中在脑组织突触前部的轴突末梢,SYP调控神经递质的释放。bassoon是一种突触鹰架蛋白,主要集中在突触前活性部位,与突触递质释放和突触可塑性方面有关。PSD-95是另一种鹰架蛋白,该蛋白在突触可塑性中产生重要的作用。雷公藤可减少AD转基因小鼠海马区Aβ沉积,增加AD转基因小鼠海马区PSD-95和SYP表达,从而明显改善突触变性和认知损害[15],提高快速老化的SAMP8鼠海马CA1区PSD-95和脑源性神经营养因子(BDNF)表达,从而改善快速老化的SAMP8鼠认知功能[16]。本研究免疫荧光结果及Western blot半定量结果显示,Aβ1-42组海马神经元SYP、bassoon、PSD-95蛋白较正常对照组明显减少,表明Aβ可引起海马神经元相关突触蛋白表达减少。这与Zeng等[15]研究结果一致。另外,本研究采用不同浓度Ato对Aβ引起的海马神经元损伤的影响进行观察发现,Ato能明显对抗Ab1-42引起的SD大鼠海马神经元SYP、PSD-95、bassoon蛋白的降低,提示Ato对Aβ1-42引起的突触损伤具有明显的对抗作用,且随Ato浓度增加,其SYP、PSD-95、bassoon蛋白表达逐渐增加,表明Ato对抗Aβ1-42引起的突触蛋白SYP、PSD-95、bassoon表达降低存在剂量依赖关系。
Ato属于他汀类调血脂类药物,是羟甲基戊二酰辅酶A还原酶抑制剂,已被广泛应用于临床治疗高胆固醇血症、预防心脑血管事件。最近研究结果提示他汀类药物有独立于降脂作用之外的神经细胞保护作用。长期服用他汀类药物能降低AD的发病率,改善AD患者认知障碍[17]。另有研究对AD模型犬应用阿托伐他汀钙大剂量(80 mg/d)干预14.5个月,结果显示阿托伐他汀钙可明显改善AD模型犬的认知功能,其作用机制与Ato的抗氧化损伤及抗炎性反应作用有关[18]。
综上所述,本研究通过观察Ato对Aβ诱导的大鼠原代海马神经元培养细胞及大鼠海马突触相关蛋白表达变化的影响,结果证实Ato有助于突触损伤修复,为他汀类药物阻止Aβ引起的神经毒性,改善AD临床症状提供了一定的实验证据。他汀类药物详细作用机制值得进一步深入研究,为AD预防和治疗提供更多的依据。
[1]Selkoe DJ, Schenk D. Alzheimer’s disease: molecular understanding predicts amyloid-based therapeutics[J]. Annu Rev Pharmacol Toxicol,2003,43:545-584.
[2]Reifert J, Hartung-Cranston DA, Feinstein SC. Amyloid beta-mediated cell death of cultured hippocampal neurons reveals extensive Tau fragmentation without increased full-length tau phosphorylation[J].J Biol Chem,2011, 286(23):20797-20811.
[3]Ferreira ST, Klein WL. The Aβ oligomer hypothesis for synapse failure and memory loss in Alzheimer’s disease[J].Neurobiol Learn Mem, 2011, 96(4):529-543.
[4]Benilova I, Karran E, De Strooper B. The toxic Aβ oligomer and Alzheimer’s disease: an emperor in need of clothes [J].Nat Neurosci, 2012, 15(3):349-357.
[5]Bettermann K, Arnold AM, Williamson J,et al.Statins, risk of dementia, and cognitive function: secondary analysis of the Ginkgo Evaluation of Memory Study(GEMS) [J].J Stroke Cerebrovasc Dis, 2012,21(6):436-444.
[6]Wong WB, Lin VW, Boudreau D,et al.Statins in the prevention of dementia and Alzheimer’s disease: a meta-analysis of observational studies and an assessment of confounding[J]. Pharmacoepidemiol Drug Saf, 2013,22(4):345-358.
[7]Abrahamson EE, Ikonomovic MD, Dixon CE, et al. Simvastatin therapy prevents brain trauma-induced increases in beta-amyloid peptide levels [J]. Ann Neurol, 2009,66(3):407-414.
[8]Hosaka A, Araki W, Oda A, et al. Statins reduce amyloid beta-peptide production by modulating amyloid precursor protein maturation and phosphorylation through a cholesterol-independent mechanism in cultured neurons[J].Neurochem Res, 2013,38(3):589-600.
[9]Puzzo D, Privitera L, Fa M, et al. Endogenous amyloid-β is necessary for hippocampal synaptic plasticity and memory[J]. Ann Neurol, 2011, 69(5):819-830.
[10]Bate C, Williams A. Amyloid-β-induced synapse damage is mediated via cross-linkage of cellular prion proteins[J]. J Biol Chem, 2011, 286(44):37955-37963.
[11]Moreno JA, Mallucci GR. Dysfunction and recovery of synapses in prion disease: implications for neurodegeneration[J]. Biochem Soc Trans, 2010, 38(2):482-487.
[12]Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer’s amyloid beta-peptide[J]. Nat Rev Mol Cell Biol, 2007, 8(2):101-112.
[13]Pannese E. Morphological changes in nerve cells during normal aging[J]. Brain Struct Funct, 2011, 216(2):85-89.
[14]Zhang LL, Sui HJ, Liang B, et al. Atorvastatin prevents amyloid-beta peptide oligomer-induced synapto toxicity and memory dysfunction in rats through a p38 MAPK-dependent pathway[J]. Acta Pharmacol Sin, 2014,35:716-726.
[15]Zeng Y,ZhangJ,Zhu Y,et al. Tripchlorolide improves cognitive deficits by reducing amyloid β and upregulating synapse-related proteins in a transgenic model of Alzheimer’s disease[J].J Neurochem,2015,133(1):38-52.
[16]Lin N,Pan XD,Chen AQ,et al.Tripchlorolide improves age-associated cognitive deficits by reversing hippocampal synaptic plasticity impairment and NMDA receptor dysfunction in SAMP8 mice[J]. Behav Brain Res,2014 ,258:8-18.
[17]Nadkarni NK, Perera S, Hanlon JT, et al. Statins and brain integrity in older adults:secondary analysis of the Health ABC study[J]. Alzheimers Dement,2015,11(10):1202-1211.
[18]Sparks DL,Sabbagh MN,Connor DJ,et al.Atorvastatin therapy lowers circulating cholesterol but not free radical activity in advance of identifiable clinical benefit in the treatment of mild-to-moderate AD[J].Curr Alzheimer Res,2005,2(3):343-353.
(本文编辑:时秋宽)
Neuroprotective effect of atorvastatin on amyloid-β protein-induced neurotoxicity in cultured hippocampal neurons
WANGNan,SUIHaijuan,ZHANGLingling,JINYing*,ZHAOBin.
*DepartmentofPharmacology,LiaoningMedicalUniversity,JinzhouLiaoning121001,China
Corresponding author:JIN Ying, Email:jyjinying1130@163.com
Objective To investigate the neuroprotective effect of atorvastatin(Ato) on amyloid-β protein-induced neurotoxicity in cultured hippocampal neurons. Methods Primary cultures were obtained from hippocampi of 0 h to 24 h-old Sprague-Dawley rats. After 10 days in culture, the hippocampi cells were divided into a control group, an Aβ1-42(1.25 μmol/L) group, and a treatment group with different Ato concentrations (0.1, 0.5, 1.0, 2.5 μmol/L). The ATP content of the culture was quantified using CellTiter-GloTMassay. The lactate dehydrogenase released into the culture media was measured using CytoTox-ONETMassay. The changes of SYP, bassoon and PSD-95 proteins were observed by immunofluorescence staining. SYP, bassoon and PSD-95 protein were evaluated using Western blotting. Results Compared with the normal control group, in hippocampal neurons cultured for 10 d by Aβ1-42(1.25 μmol/L) for 48 h, ATP% and LDH% decreased significantly(P<0.01). Adding Ato (0.5, 1.0, 2.5 μmol/L) significantly inhibited Aβ1-42induced ATP% and LDH% decreases (P<0.01). Immunofluorescence and Western results showed that Aβ1-42(1.25 μmol/L) decreased SYP, bassoon and PSD-95 protein expression. Compared with the Aβ1-42group, Ato could significantly inhibit the Aβ1-42induced above effects. Conclusions Ato has a protective effect against the neurotoxicity of amyloid beta protein to cultured hippocampal neuronsinvitro, which may be related to the inhibition of synaptic proteins.
Alzheimer’s disease; atorvastatin; hippocampal neurons; amyloid-β peptide; synapse protein
10.3969/j.issn.1006-2963.2017.03.007
121001辽宁医学院药理学教研室〔王楠(现工作于沈阳市第五人民医院)、隋海娟、张玲玲、金英〕;110023沈阳市第五人民医院(赵彬)
金英,Email:jyjinying1130@163.com
R742.8+9
A
1006-2963(2017)03-0178-05
2016-06-02)
