低共熔溶剂对丹酚酸B药物组织分布的影响
2017-05-25陈珏张立伟
陈珏,张立伟
(1.山西大学 分子科学研究所,山西 太原 030006;2.山西大学 中医药现代研究中心,山西 太原 030006)
低共熔溶剂对丹酚酸B药物组织分布的影响
陈珏1,2,张立伟1*
(1.山西大学 分子科学研究所,山西 太原 030006;2.山西大学 中医药现代研究中心,山西 太原 030006)
为了研究低共熔溶剂对丹酚酸B在小鼠体内的药物组织分布影响,将健康小鼠随机分为对照组和受试组,其中对照组和受试组分别给予溶解在水中的丹酚酸B和溶解在氯化胆碱-甘油(摩尔比1∶2)中的丹酚酸B,小鼠按200 mg/kg灌胃给予丹酚酸B后收集不同时间点的心、脑、肝组织器官,并采用HPLC-MS法测定给药后组织中的丹酚酸B含量。结果表明,受试组中丹酚酸B在肝组织的达峰时间为20 min,较对照组相比提前了10 min;且达峰浓度为1.66 μg/g,约为对照组峰浓度的1.63倍。由此可见,低共熔溶剂可以增加丹酚酸B在小鼠肝组织中的分布,并且加快其吸收和消除,起到一定的减毒增效作用。
低共熔溶剂;丹酚酸B;药物组织分布
0 引言
低共熔溶剂是由氢键受体(常为季铵盐)与氢键供体(多元醇、多元酸、金属盐和尿素等)以一定化学计量比通过氢键形成的均一稳定体系,且形成的低共熔溶剂熔点低于组成原料[1]。低共熔溶剂的理化性质(密度、粘度、导电性等)与离子液体相似,因此被称为“新型离子液体”[2-3];但与离子液体相比,低共熔溶剂具有基本无毒、合成简单、原料利用率高、价格低廉、可生物降解等优势[4-6]。由此可见,低共熔溶剂有望替代离子液体,广泛应用到各个领域[7-9]。
丹酚酸B为中药丹参的主要水溶性活性成分之一,目前在临床上主治缺血性中风[10]。现代研究表明丹酚酸B具有抗氧化、抗纤维化、清除自由基等多种活性[11-13],对心、肝、脑等均有显著的药理作用[14-15]。现有文献报道丹酚酸B口服给药后在动物体内的药代动力学数据显示,它具有吸收差、稳定性差和首过效应等缺陷[16-17]。而我们之前的研究证明低共熔溶剂可以增强丹酚酸B的稳定性[18],并且促进丹酚酸B的透膜吸收。因此,本研究采用低共熔溶剂溶解丹酚酸B,对小鼠灌胃给药,用来研究低共熔溶剂对丹酚酸B体内组织分布的影响,以期为低共熔溶剂作为药物载体在药效学和制剂学的进一步研究和开发提供依据。
1 材料和方法
1.1 仪器和试剂
METTLER TOLEDO分析天平(万分之一级);离心机;匀浆机;涡旋仪;美国 Waters 2695高效液相色谱仪,2998PDA检测器。
甲醇、乙醇、乙腈、乙酸乙酯、甲酸均为色谱纯;水为娃哈哈纯净水;丹酚酸B标准品纯度>99%,由成都曼斯特生物科技有限公司提供。
1.2 动物
4-5周的清洁级小鼠(北京海淀兴旺动物养殖场提供,许可证号:SCXK-(军)2012-2004),体重20~22 g,数量108只,雌雄各半。小鼠雌雄分开饲养于小鼠笼内,保持恒温(22 ± 2℃)、恒湿(40%)及12 h光暗周期的饲养条件。小鼠适应环境一周后进行实验,实验前小鼠禁食12 h,但允许自由饮水。
1.3 低共熔溶剂的合成
低共熔溶剂是由氯化胆碱和甘油以摩尔比1∶2的比例(ChCl-GL,1∶2)混合后,在100℃的恒温磁力搅拌器中持续加热搅拌直至形成宏观上均一稳定的透明液体。
1.4 色谱条件
丹酚酸B在小鼠组织中的分析测定采用Waters Acquity H-class UPLC®液相系统(Waters,Milford,MA,USA),含在线真空脱气机、高压四元泵、自动进样器、柱温箱、UPLC®-光电二极管阵列(PDA)检测器和QDA质谱检测器。QDA质谱检测器采用正离子模式和负离子模式,ESI毛细管电压为±0.8 kV,锥孔电压为15 V,探头温度为600℃,离子扫描范围设置为m/z100~1 000。色谱分离采用ACQUITY UPLC®BEH C18反相柱(50 mm×2.1 mm, 1.7 μm, Waters, USA);柱温:20℃;流动相:0.4%甲酸水溶液(V/V)(A)-乙腈(B);梯度洗脱程序:0~8 min 时10%~50% B,8~12 min时50%~80% B,12~15 min 时80%~100% B。流速:0.3 mL/min。进样体积:10 μL。数据采集及处理采用Empower 2分析软件(Waters, Milford, MA, USA)。
1.5 组织样品的采集和处理方法
将适量丹酚酸B标准品分别置于两个10 mL离心管中,分别加入适量纯水和低共熔溶剂(ChCl-GL 1∶2),其中丹酚酸B的浓度均为40 mg/mL。
取禁食12 h的昆明小鼠(雌雄各半)随机分为两组,分别灌胃给药丹酚酸B溶解于水中(对照组,SAB-H2O)和丹酚酸B溶解于ChCl-GL 1∶2(受试组,SAB-DES)。每组每个时间点均为6只小鼠,给药剂量为200 mg/kg,给药体积为5 mL/kg,并于给药前和给药后0.083、0.33、0.5、1、2、5、12、24 h处死6只小鼠并放净血液,立即在冰盘中剖取心脏、肝脏和大脑等组织样品。
组织样品用预冷的生理盐水漂洗净残血,滤纸吸干后称重,用2倍量生理盐水匀浆,然后4 500 r/min离心10 min,取上清液作为组织匀浆液备用。精密吸取0.20 mL组织液,置于2 mL离心管中,精密加入内标溶液50 μL和10%盐酸(V/V,10 μL),涡旋1 min;然后加入600 μL乙酸乙酯经2 min 涡旋震荡后,以4 500 r/min 离心10 min,取上清液转移到一个新的离心管中,氮气流吹干后用100 μL乙腈使残留物溶解,再涡旋2 min,12 000 r/min离心10 min,取上清液,HPLC-MS进样测定。
1.6 标准工作液的制备
精密称取丹酚酸B适量,用水配成1.0 mg/mL的母液,然后稀释为一系列的标准溶液。内标氯霉素用水配成1.0 μg/mL的工作液。取200 μL空白组织液,加入10 μL 10%盐酸水溶液混合和50 μL内标工作液,然后加入50 μL稀释到合适浓度的丹酚酸B工作液。该混合溶液涡旋混匀1 min之后,在4℃于12 000 r/min离心10 min,制得0.05、0.15、0.75、3.75、5.00和10.00 μg/mL的丹酚酸B标准曲线工作液。三个高中低浓度的质控(quality control,QC)样品以同样方法制备,丹酚酸B的浓度分别为0.05、0.75、5.00 μg/mL。所有溶液置于-20℃冰箱待用。绘制标准曲线时,待测物与内标的峰面积比值为纵坐标,丹酚酸B浓度为横坐标。
2 结果与讨论
2.1 方法学考察
2.1.1 专属性考察
图1为小鼠心、肝、脑的空白组织色谱图(A)、空白组织中加入丹酚酸B及内标后的色谱图(B)及给药30 min后组织样品处理所得的色谱图(C),通过比较证明小鼠组织中所含内源性物质对丹酚酸B和内标均无干扰,待测物的专属性良好。其中,在该检测条件下,内标和丹酚酸B的保留时间分别为4.28和4.71 min。

Fig.1 Chromatograms of blank tissue (A), blank tissue spiked with salvianolic acid B and IS (B) and tissue sample after oral administration for 30 min and IS(C)图1 空白组织(A)、空白组织加丹酚酸B及内标(B)和给药后的组织样品及内标(C)色谱图
2.1.2 线性关系及最低定量限
精密取大鼠空白组织匀浆液 200 μL,分别精密加入系列浓度0.05、0.15、0.75、3.75、5.00和10.00 μg/mL的丹酚酸B标准工作液200 μL,涡旋混匀 1 min,按照“1.5” 节下方法操作,测定标准曲线。每个浓度平行制备6份样品。每个样品测定3次,记录各对照品与内标峰面积比,以峰面积比为纵坐标Y,对照品浓度(mg/L)为横坐标X,计算回归方程及相关系数(R2),结果见表1。在测定浓度范围内,丹酚酸B的峰面积和浓度具有良好的线性关系,R2>0.993 5,且定量限(LOQ)>37.55 ng/mL,检测限(LOD)>8.96 ng/mL。
2.1.3 稳定性考察
按照“1.6标准工作液的制备”节下方法操作,分别制备高、中、低浓度的组织质控样品,每个浓度平行制备6份样品。在以下条件下考察高、中、低3个浓度组织样品的稳定性:于20℃下放置12 h;4℃下保存24 h;于-20℃下反复冻融-冷冻循环三次。表2中为小鼠不同组织中丹酚酸B的稳定性结果,表明组织匀浆液中丹酚酸B较稳定,符合生物样品的检测要求。

表1 小鼠不同组织中丹酚酸B的标准曲线方程

表2 小鼠不同组织中丹酚酸B的稳定性
2.1.4 精密度和回收率考察
按“1.6”节下的方法制备高、中、低浓度(为0.05、0.75、5.00 μg/mL)的组织质控样并测定,计算日内、日间精密度和回收率。结果如表3,不同组织的日内、日间精密度的RSD值均小于13.05,准确度范围为87.40%~113.19%;回收率均大于70%。
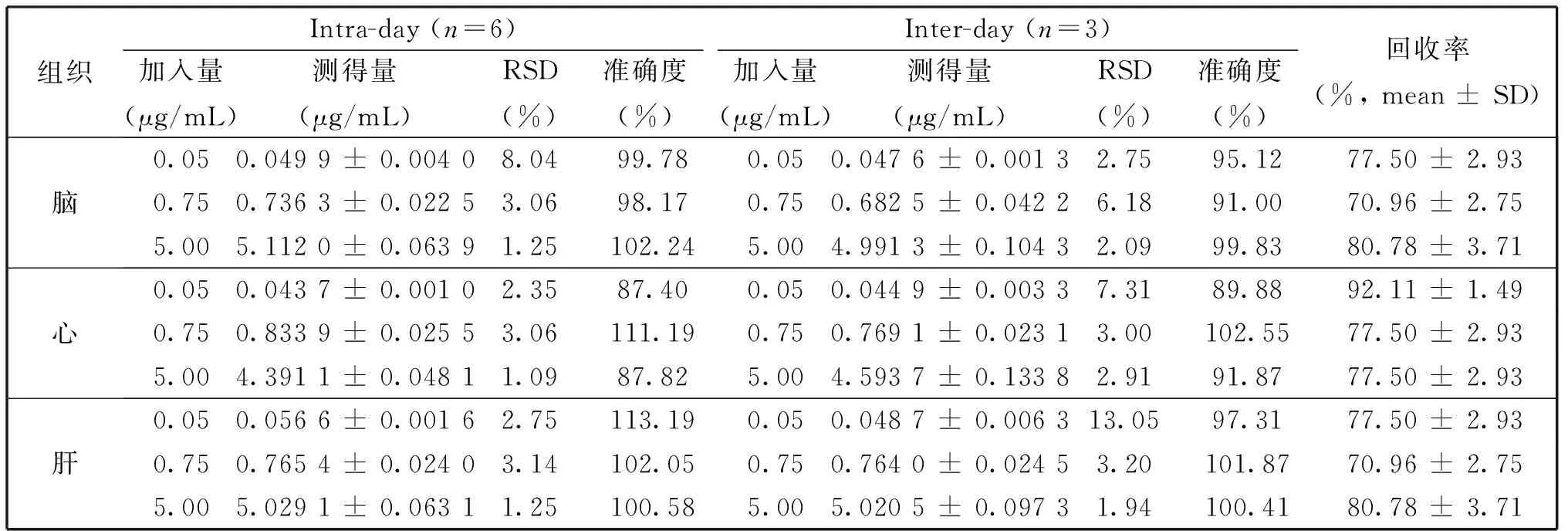
表3 小鼠不同组织中丹酚酸B的精密度和回收率
2.2 药物组织分布的影响
小鼠灌胃给予丹酚酸B后,测定结果表明,丹酚酸B在脑内的含量低于检测限,仅能通过光谱和质谱信息(见图2)确定有微量的丹酚酸B存在,推测其基本不能透过血脑屏障。此外,并没有在心脏组织中检测到丹酚酸B,该结果与之前的文献报道相符[19],表明低共熔溶剂对丹酚酸B在心和脑组织的分布没有显著影响。

Fig.2 Spectrogram and mass-spectrogram of SAB图2 丹酚酸B的光谱和质谱图
图3可见,灌胃给药后,受试组与对照组在肝组织中丹酚酸B浓度呈现出先增加后降低的特点,且分布和清除速度均较快。给药5 min后即可在小鼠肝脏检测到丹酚酸B,给药2 h后丹酚酸B的含量很低,5 h后基本已经清除干净。但受试组中丹酚酸B的达峰时间在20 min,较对照组提前10 min;且受试组中丹酚酸B在肝脏中的浓度为1.66 μg/g,显著高于对照组(1.02 μg/g)。由此可见,ChCl-GL(1∶2)对丹酚酸B在肝组织中的分布情况有一定的影响,可以明显加快丹酚酸B在肝脏的吸收和清除,并且提高丹酚酸B在肝脏的分布,从而可能有利于丹酚酸B对肝脏疾病的治疗。
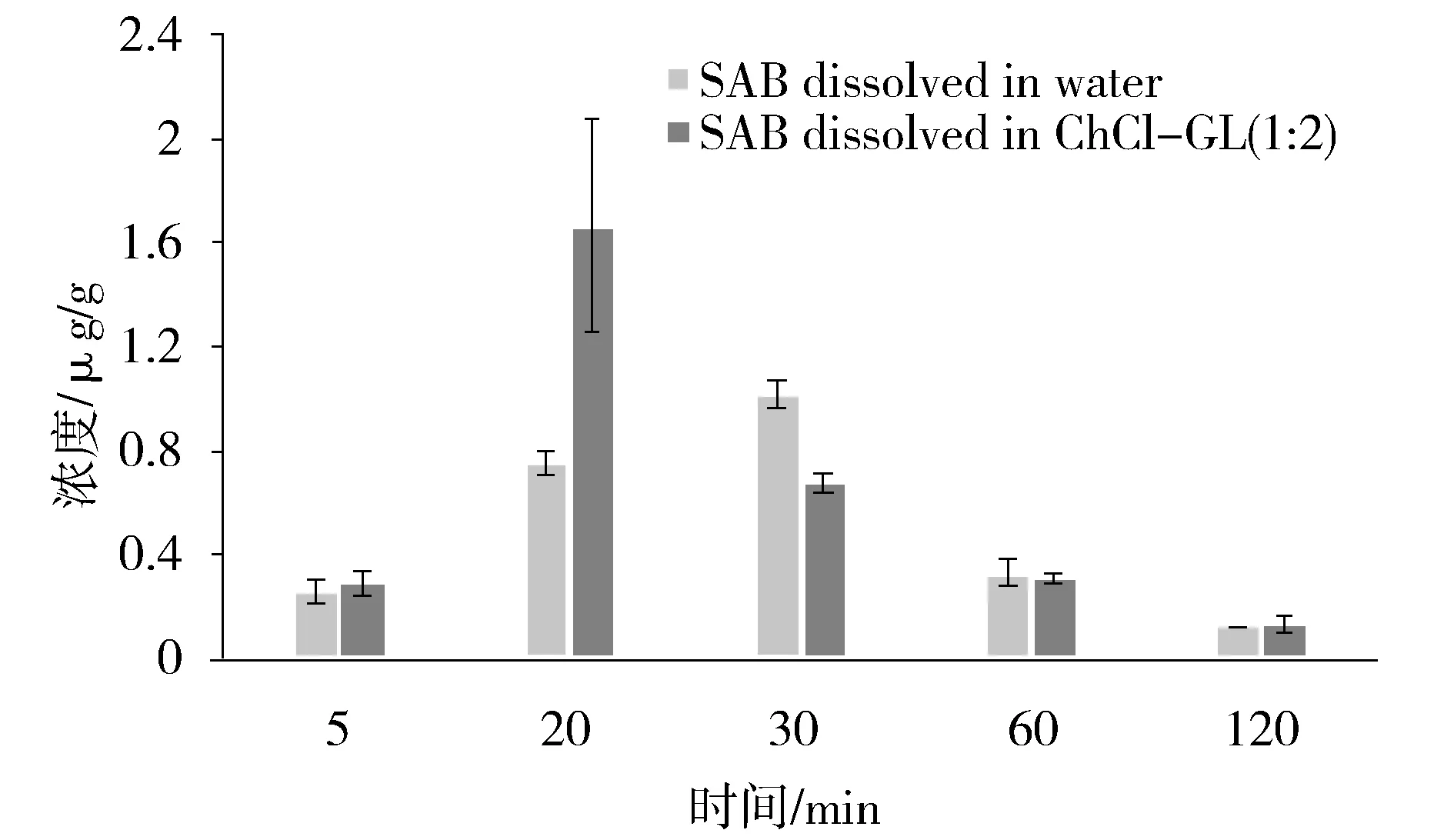
Fig.3 Concentration vs time profiles of SAB in liver after oral administration图3 给药后丹酚酸B在小鼠肝组织的药物浓度与时间的关系图
3 结论
本研究根据课题组前期对丹酚酸B的血浆药代动力学的实验结果,选择在丹酚酸B血药浓度时间曲线的吸收相、分布相和消除相各选择几个时间点;此外,根据文献报道,丹酚酸B主要的药理作用为抗心脑缺血、抗肝纤维化作用等,因此,选取脑、心和肝作为研究组织。
实验结果表明,与对照组相比,低共熔溶剂对丹酚酸B在小鼠肝组织中的分布情况产生了一定的影响,具体表现为:丹酚酸B溶解在ChCl-GL(1∶2)后给药,增加了其在肝组织的分布,并且加快其吸收和消除,起到一定的减毒增效的作用。该结果与我们前期研究的结果基本一致,为低共熔溶剂在临床应用及实验研究提供了一定的参考。
[1] Abbott A P,Capper G,Davies D L,etal.Novel Solvent Properties of Choline Chloride/Urea Mixtures[J].ChemicalCommunications,2003,9:70-71.DOI:10.1039/b210714g.
[2] Abbott A P,Boothby D,Capper G,etal.Deep Eutectic Solvents Formed between Choline Chloride and Carboxylic Acids:Versatile Alternatives to Ionic Liquids[J].JournaloftheAmericanChemicalSociety,2004,126:9142-9147.DOI: 10.1021/ja048266j.
[3] Kareem M A,Mjalli F S,Hashim M A,etal.Phosphonium-based Ionic Liquids Analogues and Their Physical Properties[J].JournalofChemicalandEngineeringData,2010,55:4632-4637.DOI: 10.1021/je100104v.
[4] Alonso D A,Baeza A,Chinchilla R,etal.ChemInform Abstract:Deep Eutectic Solvents:The Organic Reaction Medium of the Century[J].EuropeanJournalofOrganicChemistry,2016,47:612-632.DOI:10.1002/ejoc.201501197.
[5] Francisco M,Bruinhorst A V D,Kroon M C.ChemInform Abstract:Low-Transition-Temperature Mixtures (LTTMs):A New Generation of Designer Solvents[J].AngewandteChemie,2013,52:3074-3085.DOI:10.1002/chin.201327237.
[6] Hammond O S,Bowron D T,Edler K J.Liquid Structure of the Choline Chloride-urea Deep Eutectic Solvent (Reline) from Neutron Diffraction and Atomistic Modelling[J].GreenChemistry,2016,18:2736-2744.DOI:10.1039/C5GC02914G.
[7] Tang B,Row K H.Recent Developments in Deep Eutectic Solvents in Chemical Sciences[J].MonatsheftefürChemie-ChemicalMonthly,2013,144:1427-1454.DOI: 10.1007/s00706-013-1050-3.
[8] Espino M,Fernández M D L,Gomez F J V,etal.Natural Designer Solvents for Greening Analytical Chemistry[J].TrendsinAnalyticalChemistry,2016,76:126-136.DOI:10.1016/j.trac.2015.11.006.
[9] Li X,Row K H.Development of Deep Eutectic Solvents Applied in Extraction and Separation[J].JournalofSeparationScience,2016,39:3505-3520.DOI:10.1002/jssc.201600633.
[10] Li Y E,Yuan H E.Pathway-pathway Network-based Study of the Therapeutic Mechanisms by Which Salvianolic acid B Regulates Cardiovascular Diseases[J].科学通报: 英文版.2012,57(14):1672-1679.DOI:10.1007/s11434-012-5142-y.
[11] Yang T L,Lin F Y,Chen Y H,etal.Salvianolic acid B Inhibits Low-density Lipoprotein Oxidation and Neointimal Hyperplasia in Endothelium-denuded Hypercholesterolaemic Rabbits[J].JournaloftheScienceofFoodandAgriculture,2011,91:134-141.DOI:10.1002/jsfa.4163.
[12] Zhao G R,Zhang H M,Ye T X,etal.Characterization of the Radical Scavenging and Antioxidant Activities of Danshensu and Salvianolic Acid B.[J].FoodandChemicalToxicology,2008,46:73-81.DOI: 10.1016/j.fct.2007.06.034.
[13] Xu S,Zhong A,Bu X,etal.Salvianolic Acid B Inhibits Platelets-mediated Inflammatory Response in Vascular Endothelial Cells[J].ThrombosisResearch,2015,135:137-145.DOI:10.1016/j.thromres.2014.10.034.
[14] Shu T,Pang M,Rong L,etal.Protective Effects and Mechanisms of Salvianolic Acid B Against H2O2-Induced Injury in Induced Pluripotent Stem Cell-Derived Neural Stem Cells[J].NeurochemicalResearch,2015,40:1133-43.DOI:10.1007/s11064-015-1573-6.
[15] Wu W,Wang Y P.Pharmacological Actions and Therapeutic Applications of Salvia Miltiorrhiza depside Salt and Its Active Components[J].中国药理学报:英文版,2012,33:1119-1130.DOI:10.1038/aps.2012.126.
[16] Zhang Y J,Wu L,Zhang Q L,etal.Pharmacokinetics of Phenolic Compounds of Danshen Extract in Rat Blood and Brain by Microdialysis Sampling[J].JournalofEthnopharmacology,2011,136:129-136.doi:10.1016/j.jep.2011.04.023.
[17] Qi Q,Hao K,Li F Y,etal.The Identification and Pharmacokinetic Studies of Metabolites of Salvianolic Acid B After Intravenous Administration in Rats[J].ChineseJournalofNaturalMedicines,2013,11:560-565.DOI:10.1016/S1875-5364(13)60101-6.
[18] Chen J,Li S,Yao Z,etal.Improved Stability of Salvianolic Acid B from RadixSalviaemiltiorrhizaein Deep Eutectic Solvents[J].AnalyticalMethods,2016,8:2502-2509.DOI:10.1039/c5ay03351a.
[19] Xu M,Fu G,Qiao X,etal.HPLC Method for Comparative Study on Tissue Distribution in Rat After Oral Administration of Salvianolic Acid B and Phenolic Acids fromSalviaMiltiorrhiza[J].BiomedicalChromatography,2007,21:1052-1063.DOI: 10.1002/bmc.852.
Effect of Deep Eutectic Solvents on the Tissue Distribution of Salvianolic Acid B
CHEN Jue1,2,ZHANG Liwei1*
(1.Institute of Molecular Science,Shanxi University, Taiyuan 030006,China;2.Modern Research Center for Traditional Chinese Medicine,Shanxi University,Taiyuan 030006,China)
To investigate the effect of deep eutectic solvents on the tissue distribution of salvianolic acid B (SAB) in mice,the fasted mice were randomly divided into control group and test group, that were oral administration of SAB dissolved in water and SAB dissolved in choline chloride-glycerol (ChCl-GL, molar ratio 1∶2), respectively. After intragastric administration at the dose of 200 mg/mL of SAB, the main tissues (heart, brain and liver) were collected at different time points.The content of salvianolic acid B was determined by HPLC-MS.The result indicated that the peak time of SAB in liver tissue was at 20 min in test group, which was 10 min shorter than in control group. And the peak concentration of test group was 1.66 μg/g, which was 1.63 times of the control group. Therefore, deep eutectic solvent can increase the distribution of SAB in the liver tissue of mice, and accelerate the absorption and elimination of SAB, which may be play a certain role in reducing toxicity and synergism.
deep eutectic solvents;salvianolic acid B;tissue distribution
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.02.022
2017-02-22;
2017-03-10
2016年山西省研究生教育创新项目(2016BY030)
陈珏(1988-),女,山西浑源人,博士研究生,研究方向:生药活性成分与质量评价研究,E-mail:juechenyzm@sina.com
*通信作者:张立伟(Liwei Zhang),E-mail:lwzhang@sxu.edu.cn
R966
A
0253-2395(2017)02-0347-06
