表皮生长因子受体基因表达对胃癌分期的影响及诱导胃癌细胞增殖凋亡的机制
2017-05-25熊小明
彭 力 马 琛 熊小明
(重庆市急救医疗中心病理科,重庆 400014)
表皮生长因子受体基因表达对胃癌分期的影响及诱导胃癌细胞增殖凋亡的机制
彭 力 马 琛 熊小明1
(重庆市急救医疗中心病理科,重庆 400014)
目的 探讨表皮生长因子受体(EGFR)基因表达对胃癌分期的影响及诱导胃癌细胞增殖凋亡的机制。方法 应用免疫组化法检测100例胃癌组织中EGFR基因的表达,分析其与临床病理特征的关系。培养胃癌细胞株SGC-7901,实验分为空白对照组、空载体组、EGFR-siRNA组,3组细胞转染12、24、48、72 h后,CCK8检测EGFR基因对细胞增殖的影响;流式细胞仪检测EGFR基因对细胞凋亡的影响;Western印迹检测凋亡相关蛋白的表达。结果 100例胃癌组织中,EGFR表达阳性41例,对照组无阳性表达,差异有统计学意义(P<0.01);胃癌分化程度、浸润程度、淋巴转移中EGFR的表达差异显著(P<0.05),TNM分期与EGFR的表达差异极显著(P<0.01);随着时间的延长,3组细胞的增殖率均上升,EGFR-siRNA组增殖较缓慢,24 h的增殖率与空白对照组和空载体组比较显著降低(P<0.05),48 h和72 h的增殖率与空白对照组和空载体组比较显著降低(P<0.01);3组细胞转染48 h后,EGFR-siRNA组细胞的凋亡率显著低于空白对照组和空载体组(P<0.01);空白对照组和空载体组细胞中Bcl-2、Bax、酶切Caspase3 3个蛋白表达均无显著差异(P>0.05),EGFR-siRNA组细胞中Bax、酶切Caspase3蛋白表达显著高于空白对照组和空载体组,Bcl-2蛋白表达显著低于空白对照组和空载体组(P<0.01)。结论 EGFR基因的表达参与胃癌生长、侵袭、转移和分化过程,下调EGFR基因的表达能抑制胃癌细胞株SGC-7901增殖,促进细胞凋亡,凋亡可能与Bcl-2、Bax、Caspase3的调控有关。
表皮生长因子;胃癌;增殖;凋亡
胃癌的发病机制复杂〔1〕。表皮生长因子(EGF)是erbB家族成员之一。研究显示,EGF受体(EGFR)在胃癌及多种上皮源性癌组织中高表达,其表达与肿瘤的恶性程度、浸润、转移等有关,许多下调和阻滞EGFR基因表达的途径被用于抑制肿瘤的增殖〔2~4〕。本研究旨在探讨EGFR基因表达对胃癌分期的影响及诱导胃癌细胞增殖凋亡的机制。
1 材料与方法
1.1 一般资料 收集2011年10至2015年10月重庆市急救医疗中心手术的100例胃癌患者的胃癌组织腊块标本,术前未行放化疗及免疫治疗。其中男65例,女35例,平均年龄(60.82±11.51)岁。病例类型均为腺癌,G1、G2、G3、G4期分化分别为18例、29例、20例、33例。根据TNM分期标准:Ⅰ期20例,Ⅱ期52例,Ⅲ期20例,Ⅳ期8例;T1、T2、T3、T4期浸润程度分别为8例、12例、20例、60例;无淋巴转移40例,有淋巴转移60例。从100例胃癌组织腊块标本中随机抽取40例,取癌旁组织作为对照组(距离胃癌组织5 cm以上),其中男25例,女15例,平均(61.42±10.78)岁。
1.2 细胞及主要试剂和仪器 胃癌细胞株SGC-7901由西南科技大学提供。鼠抗人EGFR单克隆抗体、二氨基联苯胺(DAB)显色液购自福建迈新生物技术开发有限公司;磷酸盐缓冲液(PBS)、RPMI1640培养基购自美国Gibco公司;Lipofectamine 2000转染试剂购自Invitrogen公司;鼠抗人Bcl-2单克隆抗体、兔抗人Bax多克隆抗体均购自丹麦DAKO公司;兔抗人Caspase3多克隆抗体购自美国Santa Cruz公司;胆囊收缩素(CCK)8细胞增殖试剂盒购自北京庄盟有限公司;CO2细胞培养箱购自美国西盟公司;倒置荧光显微镜购自日本Nikon,Annexin V-FITC凋亡试剂盒、流式细胞仪均购自美国Becton Dickinson公司;酶标仪购于美国Bio-rad公司。
1.3 方法
1.3.1 免疫组化及结果判定 按照常规方法将切片脱蜡至水,用胃酶进行酶消化抗原修复。过氧化氢(30 ml/L)孵育10 min,蒸馏水冲洗,PBS浸泡5 min,滴加工作浓度的山羊血清孵育20 min,37℃条件下,一抗二抗各孵育1 h,PBS各洗涤3次,3 min/次。DAB显色,PBS洗涤,苏木素复染,脱水、透明、封片。PBS作为阴性对照,相应抗体的阳性切片作为阳性对照。以Olympus数码显微成像系统进行采集、分析。随机选择5个视野,200倍观察,计数每个视野中肿瘤上皮细胞的染色情况,取其均值。根据评分标准,依据染色强度和阳性细胞数所占的比例评分。
1.3.2 细胞培养 从液氮罐中取出装有胃癌细胞株SGC-7901的冻存管,立即放冻存管于37℃的水浴锅中溶解,1 min内轻摇溶解。细胞溶解后加入含有10%胎牛血清(FBS)、100 μg/ml链霉素和100 U/ml青霉素的RPMI1640培养基,800~1 000 r/min离心5 min,弃上清,培养液悬浮细胞,接种到培养瓶中,37℃、5% CO2培养箱中培养。当观察到细胞融合度达到90%以上时,胰酶消化细胞,消化完全后用完全培养基终止消化,离心悬浮细胞,悬浮液转移到离心管中,800~1 000 r/min离心5 min,倒掉培养基,换3组,成完全培养基,传代。
1.3.3 细胞转染 实验分为空白对照组:细胞中加入无血清的RPMI1640培养基;空载体组:细胞中加入Lipofectamine 2000稀释液及无血清的RPMI1640培养基;EGFR-siRNA组:细胞中加入Lipofectamine 2000稀释液和EGFR-siRNA。取生长至对数期的胃癌细胞SGC-7901,0.25%的胰蛋白酶消化细胞,调整细胞浓度为2×105个/孔,接种于24孔板中进行培养。将各组细胞与培养基充分混合后加入到胃癌细胞SGC-7901中,37℃,5% CO2培养箱中培养4 h,细胞融合度达到80%时,用不含血清的RPMI1640培养基继续培养细胞24 h,更换成含血清的RPMI1640培养基继续培养。
1.3.4 CCK8实验检测细胞增殖 取各组生长至对数期的胃癌细胞SGC-7901,胰酶消化后离心,调整细胞浓度为每毫升含有5×103个细胞,每孔加入细胞悬液100 μl,接种于96孔板中,37℃,5%CO2浓度培养箱中培养12、24、48、72 h后,每孔加入10 μl CCK8溶液,37℃,5% CO2培养箱孵育3 h,酶标仪在波长为490 nm处测定并记录OD值,计算细胞增殖率,细胞增殖率(%)=OD实验组/OD对照组×100%。
1.3.5 流式细胞仪检测细胞凋亡 采用Annexin V/PI双染法。 取各组胃癌细胞SGC-7901转染48 h后,胰蛋白酶消化细胞,PBS重悬细胞,调整细胞浓度为每毫升含细胞为3×105个,取出1 ml细胞悬浮液,1 000 r/min,4℃离心8 min,弃上清,PBS洗涤细胞3次,向细胞中加入 200 μl缓冲液重悬细胞,分别加入5 μl PI和 Annexin-V,室温避光静置20 min,加300 μl缓冲液,流式细胞仪观察细胞凋亡情况。
1.3.6 Western印迹检测蛋白的表达 取各组生长至对数期的胃癌细胞SGC-7901,PBS洗涤细胞3次,0.25%胰蛋白酶消化细胞,转移到一个新的离心管中,根据细胞的数量,加入适量的裂解液冰上裂解30 min,4℃ 12 000 r/min,离心10 min,取上清。按照试剂盒说明提取蛋白和测定蛋白浓度。充分混匀蛋白样品与上样缓冲液,100℃煮沸变性5 min,每孔中加50 μl样品。电泳分离后,4℃转膜过夜。取膜,Tris盐酸缓冲液(TBST)洗膜3次,5%脱脂奶粉室温封闭2 h。加入一抗二抗孵育。TBST洗膜3次,显影,通过Odyssey扫描系统分析蛋白表达量。
1.4 统计学方法 应用SPSS20.0软件进行χ2检验、t检验。
2 结 果
2.1 EGFR在胃癌组织和癌旁组织中的表达 EGFR表达阳性41例,对照组无阳性表达,差异具有统计学意义(P<0.01)。
2.2 EGFR表达与胃癌临床病理特征参数之间的关系 不同胃癌分化程度、浸润程度、淋巴转移患者EGFR的表达差异显著(P<0.05),TNM分期与EGFR的表达差异极显著(P<0.01)。见表1。
2.3 EGFR对细胞增殖的影响 随着时间的延长,3组细胞的增殖率均上升,EGFR-siRNA组增殖较缓慢,24、48、72 h的增殖率与空白对照组和空载体组组比较显著降低(P<0.05)(P<0.01)。见图1。
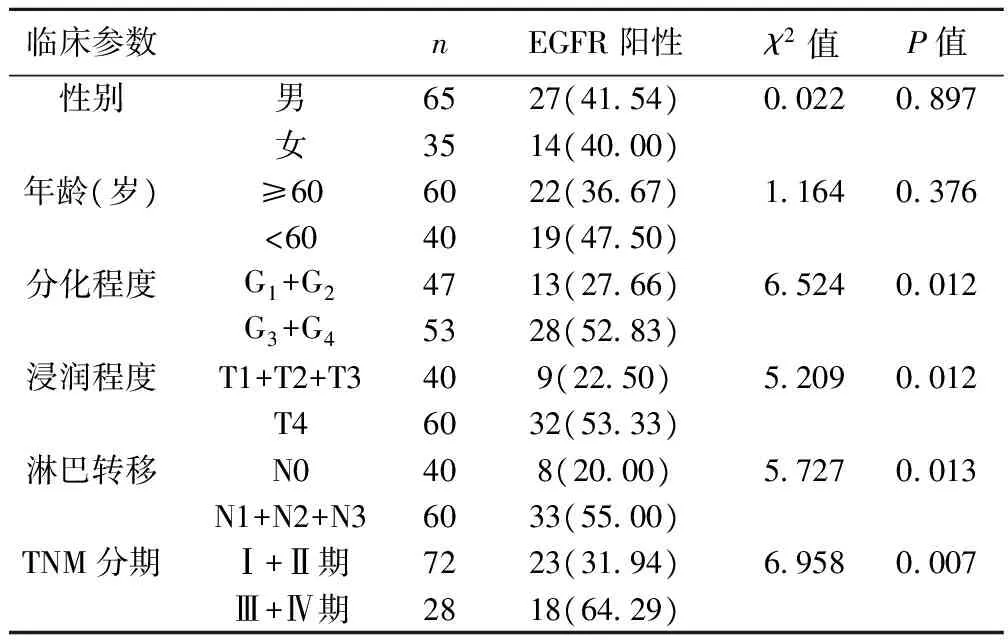
表1 EGFR表达与胃癌临床病理特征参数之间的关系〔n(%)〕
2.4 EGFR对细胞凋亡的影响 空白对照组、空载体组和EGFR-siRNA组细胞的凋亡率分别为(3.47±0.19)%、(3.56±0.21)%、(15.83±0.34)%,EGFR-siRNA组细胞的凋亡率显著低于空白对照组和空载体组(P<0.01)。
2.5 Western印迹检测凋亡相关蛋白的表达 空白对照组和空载体组细胞中Bcl-2、Bax、酶切Caspase3 3个蛋白表达均无显著差异(P>0.05),EGFR-siRNA组细胞中Bax、酶切Caspase3蛋白表达显著高于空白对照组和空载体组,Bcl-2蛋白表达显著低于空白对照组和空载体组(P<0.01)。见表2,图2。

与空白对照组比较:1)P<0.05;与空载体组比较:2)P<0.01 图1 EGFR对细胞增殖的影响
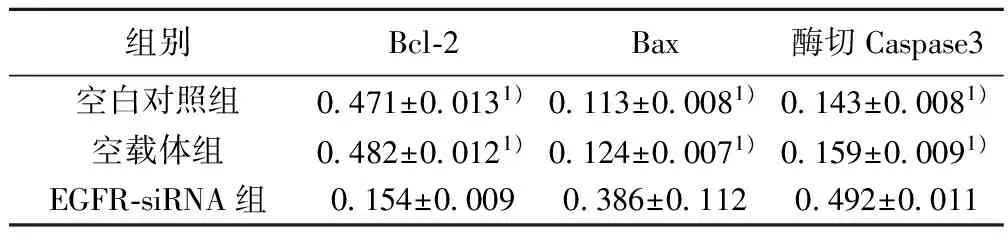
组别Bcl⁃2Bax酶切Caspase3空白对照组0471±00131)0113±00081)0143±00081)空载体组0482±00121)0124±00071)0159±00091)EGFR⁃siRNA组0154±00090386±01120492±0011
与EGFR-siRNA组比较:1)P<0.01

图2 各组细胞中凋亡相关蛋白的表达
3 讨 论
EGFR是酪氨酸激酶Ⅰ型受体家族,具有酪氨酸激酶的活性,通过与EGF或转化生长因子(TGF)α配体结合激活酪氨酸蛋白激酶途径,促进DNA的合成、癌基因的表达以及细胞的生长〔5〕。研究显示,高表达的EGFR能够促进血管生成和肿瘤细胞的侵袭、转移和增殖,并使肿瘤细胞的凋亡受到抑制〔6〕。已发现人类的肝癌、乳腺癌、结肠癌等有 EGFR的高表达,EGFR的高表达使肿瘤有较强浸润迁移能力,预后的效果不佳〔7〕。研究指出,结肠癌中EGFR的阳性表达与肿瘤分期有关,与组织分化程度无关,提示EGFR表达的上调与肿瘤的进展存在密切的关系〔8〕。本研究说明EGFR基因参与了胃癌的侵袭、迁移、增殖等过程。
正常情况下,机体细胞的增殖和凋亡维持一种动态的平衡,当机体内突变的细胞异常增多时,就会引起肿瘤的发生〔9〕。对于肿瘤的治疗,引起肿瘤细胞的凋亡是治疗疾病的一种方法,因此,许多研究者提出用诱导肿瘤细胞凋亡的方法抗肿瘤,如何诱导肿瘤细胞凋亡的途径得到研究者广泛的关注〔10〕。RNA干扰(RNAi)是一种能引起内源性靶基因沉默的机制,具有较高的特异性。RNAi作为一种沉默基因表达和抑制基因功能的机制,对研究基因的功能发挥重要作用〔11〕。本研究发现EGFR在胃癌中呈阳性表达,因此,通过RNAi沉默EGFR表达后检测对胃癌细胞增殖凋亡的影响,结果表明沉默EGFR表达能抑制胃癌细胞的增殖,促进细胞的凋亡。
Bax和Bcl-2是Bcl-2家族的促凋亡蛋白和抑凋亡蛋白,Bax和Bcl-2可以通过形成同源二聚体或异源二聚体调节细胞的凋亡。当Bcl-2蛋白表达减少,Bax表达增加,可促进细胞的凋亡,反之则抑制细胞的凋亡〔12〕。Bcl-2/Bax形成的二聚体能够作用于线粒体外膜,影响线粒体膜Caspase的释放,Caspase能够激活凋亡信号通路,使细胞发生皱缩,发生DNA片段凋亡
等现象,Caspase3处于Caspase级联反应的下游,是细胞凋亡的执行者〔13〕。本研究结果说明EGFR引起胃癌细胞株SGC-7901的凋亡可能与Bcl-2、Bax、Caspase3蛋白调控有关。
1 Berger H,Marques MS,Zietlow R,etal.Gastric cancer pathogenesis〔J〕.Helicobacter,2016;21(S1):34-8.
2 刘 坤,王海江,孙振强,等.胃癌组织HER-2和VEGF及EGFR表达临床意义研究〔J〕.中华肿瘤防治杂志,2015;22(10):781-5.
3 王士娜,王 星,王翠芳.表皮生长因子受体及 HER-2/neu 蛋白在胃癌中的表达和意义〔J〕.中国医科大学学报,2015;44(9):829-32.
4 Fuse N,Kuboki Y,Kuwata T,etal.Prognostic impact of HER2,EGFR,and c-MET status on overall survival of advanced gastric cancer patients〔J〕.Gastric Cancer,2016;19(1):183-91.
5 康 晶.过表达EGFR在人类黑色素瘤脑转移瘤细胞系H1中的影响〔D〕.济南:山东大学,2015.
6 温 哲.NLRP6对HCT116细胞增殖和迁移的影响及在大肠癌组织的表达〔D〕.衡阳:南华大学,2015.
7 隋佳琪,谢鲲鹏,谢明杰.木犀草素对表皮生长因子诱导的人乳腺癌细胞增殖的抑制作用及其机制 (英文)〔J〕.生理学报,2016;68(1):27-34.
8 崔飞博,陈南征,郑见宝,等.结直肠癌组织中EGFR,BRAF 和 K-RasK-Ras 基因的表达及其临床意义〔J〕.中国普外基础与临床杂志,2016;23(5):556-60.
9 李衡衡.MiR-1915-3p 通过DRG2及PBX2影响肺癌细胞凋亡的研究〔D〕.张家口:河北北方学院,2015.
10 Subramanian M,Thorp E,Tabas I.Identification of a non-growth factor role for GM-CSF in advanced atherosclerosis promotion of macrophage apoptosis and plaque necrosis through IL-23 signaling〔J〕.Circ Res,2015;116(2):e13-24.
11 李蕾蕾,孙丰坤,李晓一,等.白桦 BpGT14 基因表达载体及 RNA 干扰载体的构建〔J〕.中南林业科技大学学报,2015;35(7):17-21.
12 肖兴花.粒细胞集落刺激因子对实验性脑出血大鼠血肿周围组织中Bax及Bcl-2蛋白表达的影响〔J〕.中国老年学杂志,2015;35(11):2927-9.
13 肖 姮,阳仁达,田浩梅,等.针刺联合亚低温对脑缺血/再灌注损伤大鼠Bcl-2,Bax,Caspase-3 蛋白表达的影响〔J〕.湖南中医药大学学报,2016;36(2):58-61.
〔2016-07-15修回〕
(编辑 袁左鸣)
泸州医学院自然科学基金青年基金项目(No.2013ZRQN031)
马 琛(1972-),女,主管技师,主要从事病理技术研究。
彭 力(1976-),男,主治医师,主要从事消化系统肿瘤病理诊断研究。
R73
A
1005-9202(2017)09-2134-03;
10.3969/j.issn.1005-9202.2017.09.022
1 西南医科大学附属第一医院病理科
