胆管癌细胞中白细胞介素-6/Stat3通路对c-Met的调控作用
2017-05-25敬健雄冯春红张春燕夏先明代荣阳
敬健雄 冯春红 张春燕 夏先明 李 洪 代荣阳
(泸州医学院附属医院肝胆外科,四川 泸州 646000)
胆管癌细胞中白细胞介素-6/Stat3通路对c-Met的调控作用
敬健雄 冯春红 张春燕1夏先明 李 洪1代荣阳1
(泸州医学院附属医院肝胆外科,四川 泸州 646000)
目的 探讨胆管癌细胞中白细胞介素(IL)-6/Stat3和肝细胞生长因子(HGF)/c-Met通路的活化情况及其相互调控作用。方法 体外培养胆管癌细胞HCCC-9810,应用Western印迹检测IL-6/Stat3和HGF/c-Met通路的活化及其相互调控,用ELISA试剂盒检测HCCC-9810细胞IL-6和HGF的分泌,RT-PCR检测IL-6/Stat3对c-Met转录的影响。结果 胆管癌细胞HCCC-9810中Stat3和c-Met均呈高度磷酸化,HCCC-9810细胞有较高水平IL-6分泌,无HGF分泌。IL-6/Stat3通路通过增强c-Met的稳定性维持胆管癌细胞c-Met的高表达,进而导致c-Met的异常活化。结论 胆管癌细胞中IL-6/Stat3信号通路对c-Met的异常活化起重要作用,IL-6/Stat3信号通路能通过c-Met信号通路发挥促胆管癌作用。
白细胞介素(IL)-6/Stat3信号通路;c-Met信号通路;胆管癌细胞
胆道慢性炎性损伤及其诱发的胆管上皮细胞炎性增殖是胆管癌(CCA)发生的重要基础〔1~4〕。CCA恶性程度高、预后差,虽然手术切除是目前CCA治疗的有效手段,但绝大多数患者在确诊时已经错失手术时机,而根治性手术切除后患者的5年生存率也仅为20%~40%〔1~4〕。CCA细胞的高增殖能力是促成其高度恶性的两大危险因素,然而目前对其增殖的分子机制还知之甚少,因而研究调控CCA细胞增殖的信号分子和通路有望为CCA的治疗提供新的分子靶点和临床策略。白细胞介素(IL)-6参与多种生物学功能调控,主要包括炎症反应、细胞增殖调控和细胞分化调控〔5~7〕。已有较多研究表明IL-6信号的异常与多种肿瘤的发生和进展关系密切〔8~10〕。在CCA中已经发现了IL-6信号通路的异常活化,且IL-6对维持CCA细胞的恶性表型起重要作用〔11~13〕。然而,IL-6如何参与调控CCA过程的机制还很不清楚。已经明确肝细胞生长因子(HGF)的受体c-Met属于促癌基因,c-Met的异常活化和CCA的恶性增殖密切相关〔14,15〕,但是c-Met在CCA中异常活化的机制尚不明确。IL-6与c-Met在CCA中的调控关系尚未见报道,本实验研究CCA细胞中IL-6与c-Met信号通路的活化状态及其相互调控。
1 材料与方法
1.1 材料 Stat3抑制剂(Stattic),蛋白质合成抑制剂Cycloheximide(CHX)和细胞因子IL-6购自Sigma公司;c-Met抑制剂PF-2341066(PF)购自Selleck Chemicals公司;IL-6和HGF ELISA试剂盒购自北京达科为生物技术有限公司;抗β-actin一抗购自Santa Cruz公司;抗phospho-Met(Tyr1234/1235)、c-Met、phospho-Stat3(Tyr705)、Stat3和gp130一抗购自Cell Signaling公司;二抗购自Santa Cruz公司。
1.2 方法
1.2.1 细胞培养及处理 将人CCA细胞系HCCC-9810以含10%胎牛血清的RPMI1640培养基培养,置于CO2培养箱中(5%CO2、95%空气、37℃),视情况换液。培养细胞分别用Stattic(10 μmol/L)、IL-6(50 ng/ml)及PF(100 nm/L)处理,并按对应时间点收集细胞。
1.2.2 RT-PCR 6孔板细胞加1 ml TRIzol并置于DEPC水处理过的1.5 ml EP管中室温5 min。加氯仿1/5体积(0.2 ml),轻柔充分混匀,室温静置3~5 min。4℃,12 000 r/min离心,15 min。转移上层水相(约400 μl)于另一DEPC水处理过的1.5 ml EP管中,加异丙醇500 μl,混匀后室温静置10 min。4℃,12 000 r/min离心,10 min。弃上清,加75%乙醇1 ml洗沉淀。4℃,7 500 r/min离心,5 min,弃上清,空气干燥沉淀5~10 min。沉淀溶于10~20 μl DEPC水中,电泳观察,测浓度。1 μl随机引物+2 μg RNA+DEPC水(总体积为15 μl),70℃,5 min。加入1 μl dNTP,5 μl缓冲液,1.25 μl RNasin,1 μl M-MLV,1.75 μl DEPC水(总体积为25 μl),37℃,60 min。产物用于PCR检测。
1.2.3 Western印迹分析 提取细胞蛋白质,SDS-PAGE电泳分离。利用半干式电转移仪将凝胶中的蛋白转移至PVDF膜,120 min。转膜结束后将PVDF膜加入5%牛血清白蛋白进行封闭,室温1 h。封闭结束后,将印迹有目的蛋白的聚偏二氟乙烯(PVDF)膜与其抗体稀释液置于4℃孵育过夜。用1×TBST洗膜3次(5 min/次),印迹有目的蛋白的PVDF膜与二抗稀释液室温振摇孵育1 h。用1×TBST洗膜3次(5 min/次)。最后将化学发光剂浸透PVDF膜,并置于凝胶成像系统,放射自显影5 min,即得到目的蛋白的免疫印迹图谱。
1.2.4 ELISA分析 依据说明书提供的方法,检测细胞培养液中IL-6和HGF的水平。
1.3 统计学方法 采用SPSS19.0统计软件进行方差分析。
2 结 果

图1 CCA细胞中IL-6/Stat3和HGF/c-Met通路的活化
2.1 CCA细胞IL-6/Stat3和HGF/c-Met通路的活化 如图1A所示,在无IL-6刺激(对照组)时CCA细胞HCCC-9810已经有较高水平的Stat3磷酸化,而IL-6刺激能够进一步增强Stat3的磷酸化。此外,在无HGF刺激(对照组)的CCA细胞HCCC-9810中也检测到了较高水平的c-Met磷酸化,而HGF刺激也明显增强了c-Met的磷酸化(图1B)。CCA细胞HCCC-9810的培养液中可以检测到IL-6,其值为150±12.5。实验未检测到CCA细胞HCCC-9810有HGF分泌,表明CCA细胞HCCC-9810有IL-6/Stat3和HGF/c-Met信号通路的高水平活化。
2.2 CCA细胞中IL-6/Stat3通路对c-Met活化的影响 在Stat3抑制剂Stattic的作用下,CCA细胞HCCC-9810中c-Met的磷酸化水平明显下调,在作用3 h以后Stattic对c-Met磷酸化的抑制效果类似于c-Met抑制剂PF。值得注意的是,在Stat3抑制剂Stattic的作用下,CCA细胞HCCC-9810中c-Met的蛋白水平也出现了显著下调,而c-Met抑制剂PF对c-Met的蛋白水平则无影响(图2A)。在给予IL-6刺激时,我们发现在胆管癌细胞HCCC-9810中c-Met蛋白水平有明显上调(图2B),表明CCA细胞HCCC-9810中c-Met的异常高表达与活化与IL-6/Stat3通路密切相关。
2.3 IL-6/Stat3通路对CCA细胞c-Met稳定性的影响 如图3所示,CCA细胞HCCC-9810中c-Met的转录水平不受IL-6刺激和Stat3抑制剂Stattic作用的影响,对照组为1.0±0.25,Stattic组为1.16±0.06,IL-6组为1.23±0.07,提示CCA细胞HCCC-9810中IL-6/Stat3信号通路对c-Met表达的影响不在转录水平,Stat3抑制剂Stattic促进了c-Met蛋白的降解,表明CCA细胞HCCC-9810中IL-6/Stat3信号通路的异常活化导致了c-Met的异常高表达,进而导致了c-Met的异常活化。
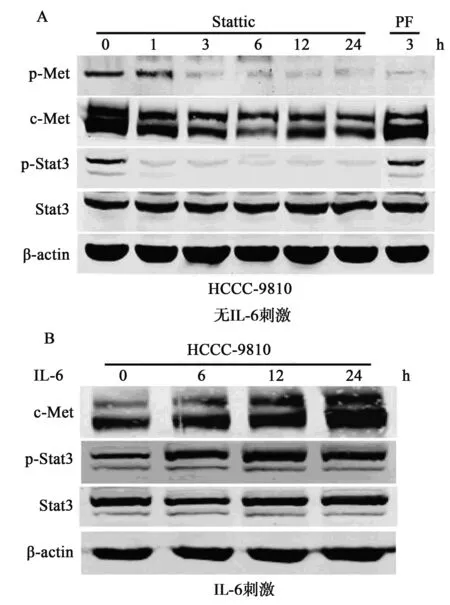
图2 CCA细胞中IL-6/Stat3信号通路对c-Met信号的调控
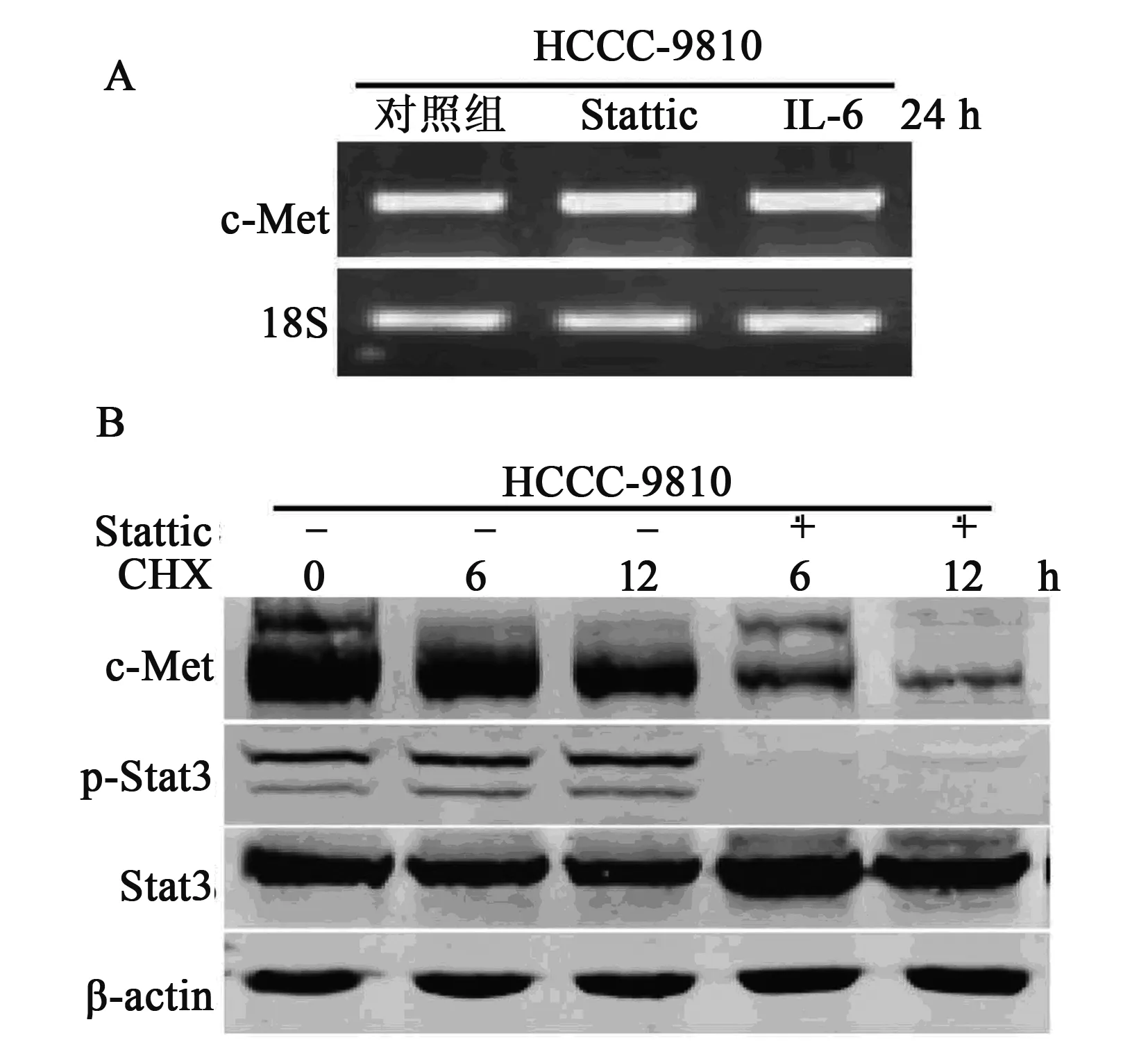
图3 IL-6/Stat3对CCA细胞c-Met蛋白水平的影响
3 讨 论
已经有较多报道指出c-Met参与了结肠癌、胃癌、肺癌、乳腺癌、前列腺癌、肝癌和CCA的过程〔14~17〕。前期结果发现阻断c-Met明显抑制了CCA细胞的增殖,我们推测c-Met能够通过促增殖作用在CCA中发挥促癌效应〔14〕。研究明确提出HGF过度表达和分泌及c-Met的过表达在c-Met的异常活化中起重要作用〔16〕,提示CCA细胞HCCC-9810中c-Met的异常活化与HGF的分泌无关,CCA中c-Met的异常活化与其过表达有关。
近年来对炎症反应与肿瘤关系的研究十分活跃。IL-6/Stat3信号通路不仅是调控炎症反应的关键通路之一,也在肿瘤过程中扮演了重要角色〔8~10〕。Stat3是IL-6的核心效应分子,此外,IL-6也通过MEK/ERK和PI3K/AKT等信号途径发挥其生物学功能〔5~10〕。本文结果表明CCA细胞中Stat3和c-Met的异常活化机制不一致,Stat3的异常活化与IL-6表达分泌有关,而c-Met的异常活化则不依赖于HGF。阻断Stat3抑制了CCA细胞中c-Met的磷酸化水平,而阻断c-Met则对Stat3的磷酸化无明显影响。由此可以推测,在CCA细胞HCCC-9810中c-Met的活化受到了IL-6/Stat3信号通路的调控。Stat3的阻断不仅抑制了c-Met的磷酸化,也下调了c-Met的蛋白水平,这提示IL-6/Stat3是通过调控c-Met的表达水平达到对c-Met磷酸化的调控。IL-6刺激可以上调c-Met的蛋白水平的实验结果进一步证实了IL-6/Stat3是通过调控c-Met的表达水平达到对c-Met磷酸化的调控。
由于基因表达调控受控于转录和蛋白两个水平,实验分析了胆管癌细胞中IL-6/Stat3对c-Met的表达调控机制。本文结果说明CCA细胞中IL-6/Stat3信号通路对c-Met的表达调控发生在蛋白水平。本文结果表明IL-6/Stat3信号通路对CCA细胞HCCC-9810中c-Met蛋白的稳定性有促进作用。上述结果均表明IL-6/Stat3信号通路通过促进c-Met蛋白的稳定性达到对c-Met信号的调控,进而促进了CCA细胞HCCC-9810中c-Met的异常活化,至于IL-6/Stat3是通过何种机制调控c-Met蛋白的稳定性需要进一步的实验探究。
综上所述,本实验发现IL-6/Stat3信号通路的活化导致了CCA细胞中c-Met蛋白稳定性增强进而导致c-Met异常高表达。由于CCA细胞中未检测到HGF分泌,因而CCA细胞中c-Met的异常活化不依赖于HGF,而是依赖于c-Met的异常高表达。鉴于c-Met信号通路在CCA中的促癌作用,可以推测IL-6/Stat3信号途径能够通过促进c-Met信号的活化而发挥促CCA作用。对IL-6/Stat3和c-Met信号通路的异常及其调控机制在CCA细胞中的促癌作用及其分子机制开展进一步实验研究有望为CCA的分子靶向治疗提供新的策略。
1 Figueras J,Valls C,Jaurrieta E.Biliary tract cancers〔J〕.N Engl J Med,2000;342(9):663-4.
2 Olnes MJ,Erlich R.A review and update on cholangiocarcinoma〔J〕.Oncology,2004;66(3):167-79.
3 Patel T.Cholangiocarcinoma〔J〕.Nat Clin Pract Gastroenterol Hepatol,2006;3(1):33-42.
4 Farazi PA,Zeisberg M,Glickman J,etal.Chronic bile duct injury associated with fibrotic matrix microenvironment provokes cholangiocarcinoma in p53-deficient mice〔J〕.Cancer Res,2006;66(13):6622-7.
5 Rose-John S.IL-6 trans-signaling via the soluble IL-6 receptor:importance for the pro-inflammatory activities of IL-6〔J〕.Int J Biol Sci,2012;8(9):1237-47.
6 Mihara M,Hashizume M,Yoshida H,etal.IL-6/IL-6 receptor system and its role in physiological and pathological conditions〔J〕.Clin Sci(Lond),2012;122(4):143-59.
7 Guk KD,Kuprash DV.Interleukin-11,an IL-6 like cytokine〔J〕.Mol Biol(Mosk),2011;45(1):44-55.
8 Nguyen DP,Li J,Tewari AK.Inflammation and prostate cancer:the role of interleukin 6(IL-6)〔J〕.BJU Int,2014;113(6):986-92.
9 Ghosh S,Ashcraft K.An IL-6 link between obesity and cancer〔J〕.Front Biosci(Elite Ed),2013;5:461-78.
10 Ataie-Kachoie P,Pourgholami MH,Morris DL.Inhibition of the IL-6 signaling pathway:a strategy to combat chronic inflammatory diseases and cancer〔J〕.Cytokine Growth Factor Rev,2013;24(2):163-73.
11 Isomoto H.Epigenetic alterations in cholangiocarcinoma-sustained IL-6/STAT3 signaling in cholangio-carcinoma due to SOCS3 epigenetic silencing〔J〕.Digestion,2009;79(Suppl 1):2-8.
12 Zhu H,Han C,Lu D,etal.miR-17-92 cluster promotes cholangiocarcinoma growth:evidence for PTEN as downstream target and IL-6/Stat3 as upstream activator〔J〕.Am J Pathol,2014;184(10):2828-39.
13 Zheng T,Hong X,Wang J,etal.Gankyrin promotes tumor growth and metastasis through activation of IL-6/STAT3 signaling in human cholangiocarcinoma〔J〕.Hepatology,2014;59(3):935-46.
14 Dai R,Li J,Fu J,etal.The tyrosine kinase c-Met contributes to the pro-tumorigenic function of the p38 kinase in human bile duct cholangiocarcinoma cells〔J〕.J Biol Chem,2012;287(47):39812-23.
15 Miyamoto M,Ojima H,Iwasaki M,etal.Prognostic significance of overexpression of c-Met oncoprotein in cholangiocarcinoma〔J〕.Br J Cancer,2011;105(1):131-8.
16 You H,Ding W,Dang H,etal.c-Met represents a potential therapeutic target for personalized treatment in hepatocellular carcinoma〔J〕.Hepatology,2011;54(3):879-89.
17 Goetsch L,Caussanel V,Corvaia N.Biological significance and targeting of c-Met tyrosine kinase receptor in cancer〔J〕.Front Biosci(Landmark Ed),2013;18:454-73.
〔2016-02-27修回〕
(编辑 苑云杰/曹梦园)
Role of IL-6/Stat3 pathway in the regulation of c-Met in cholangiocarcinoma cells
JING Jian-Xiong,FENG Chun-Hong,ZHANG Chun-Yan,etal.
Department of Hepatobiliary Surgery, the Affiliated Hospital of Luzhou Medical College, Luzhou 646000, Sichuan, China
Objective To investigate the activation of the interleukin (IL)-6/signal transducer and activator of transcription 3 (Stat3) and hepatocyte growth factor/c-Mer (HGF/c-Met) pathways in human cholangiocarcinoma cells and assess the cross-talk between the IL-6/Stat3 and HGF/c-Met pathways in human cholangiocarcinoma cells.Methods Cholangiocarcinoma cells HCCC-9810 were cultured in vitro.The activation of the IL-6/Stat3 and HGF/c-Met pathways in cholangiocarcinoma cells was measured by Western blot.The cross-talk between the IL-6/Stat3 and HGF/c-Met pathways in cholangiocarcinoma cells was measured by Western blot.The secretion in IL-6 and HGF in cholangiocarcinoma cells was measured by the enzyme-linked immunosorbent assay (ELISA).The effect of the IL-6/Stat3 pathway on c-Met mRNA levels was assessed by reverse transcription polymerase chain reaction (RT-PCR).Results HCCC-9810 cells showed strong expression of phosphated Stat3 and phosphated c-Met.The secretion in of IL-6, but not HGF, was detected in HCCC-9810 cells.The IL-6/Stat3 pathway resulted in the abnormal activation of c-Met through enhancing the stability of c-Met.Conclusions In cholangiocarcinoma cells, the IL-6/Stat3 pathway plays an important role in sustaining the abnormal activation of c-Met.Thus, c-Met is involved in the effect of IL-6/Stat3 on cholangiocarcinoma promotion.
IL-6/Stat3 pathway;c-Met pathway;Cholangiocarcinoma cells
国家自然科学基金(No.81472312);教育部新世纪优秀人才支持计划(No.NCET-11-1058);四川省优秀青年基金培育项目(No.2013JQ0045);泸州市-泸州医学院联合项目(No.2013LZLY-J06);四川省-泸州市-泸州医学院联合项目(No.14JC0082;No.14ZC0070)
代荣阳(1975-),男,博士,教授,博士生导师,主要从事肝胆肿瘤研究。
敬健雄(1989-),男,硕士,主要从事肝胆肿瘤研究。
R73
A
1005-9202(2017)09-2095-03;
10.3969/j.issn.1005-9202.2017.09.006
1 泸州医学院生物化学教研室
