不同膝关节骨性关节炎模型大鼠软骨细胞Ⅱ型胶原表达的比较
2017-05-25吴向阳柳奇奇汪宗保卢陶陶乔晓迪段文秀廖艳芳杨艳军徐亚林
吴向阳 柳奇奇 汪宗保 卢陶陶 乔晓迪 段文秀 廖艳芳 杨艳军 徐亚林
(安徽中医药大学针灸骨伤临床学院,安徽 合肥 230038)
不同膝关节骨性关节炎模型大鼠软骨细胞Ⅱ型胶原表达的比较
吴向阳 柳奇奇 汪宗保 卢陶陶 乔晓迪 段文秀1廖艳芳 杨艳军 徐亚林2
(安徽中医药大学针灸骨伤临床学院,安徽 合肥 230038)
目的 采取2%木瓜蛋白酶溶液关节腔注射和手术造成关节不稳两种方法诱导大鼠膝关节骨性关节炎(KOA)模型,比较两种造模方法在不同时间节点关节软骨Ⅱ型胶原表达的异同。方法 54只8周龄SD大鼠按体重分层后随机分为3组,每组18只。手术组手术切除大鼠右膝内侧半月板、切断内侧副韧带诱导KOA;药物组通过在大鼠右膝关节腔注射2%木瓜蛋白酶溶液诱导KOA;对照组常规饲养。于造模后第4、6、8周取右膝股骨内侧髁关节软骨,行免疫组化染色观察Ⅱ型胶原表达。结果 造模后第4、6、8周,手术组和药物组软骨细胞Ⅱ胶原表达逐渐减低,软骨表面缺损,与对照组相比有统计学差异(P<0.05)。手术组关节软骨Ⅱ型胶原表达与药物组比较无统计学差异(P>0.05)。结论 手术切除膝关节内侧半月板、切断内侧副韧带和关节腔注射木瓜蛋白酶溶液是KOA的理想造模方法,在第4、6、8周关节软骨Ⅱ型胶原表达逐渐减少,Ⅱ型胶原的表达手术组与药物组比较无统计学差异。实验可根据个体需要,做出科学地选择。
膝骨关节炎;木瓜蛋白酶;手术;Ⅱ型胶原
骨性关节炎(OA)在老年人群中极为常见,流行病学调查显示〔1~4〕,老年人、肥胖者、有膝关节创伤病史者多发。选择合适的造模方法是成功开展OA防治研究的重要前提。 研究表明,Ⅱ型胶原是一种与关节软骨退变有密切联系的细胞外基质中的胶原的主要成分(含量占总胶原量的90%~95%),在促进组织损伤后的再生和修复方面具有重要作用〔5〕,关节软骨正常生物力学的改变,常继发于细胞外基质中胶原、蛋白聚糖质和量的改变,继而生物力学的改变逐渐演变为软骨退变、关节边缘骨赘形成和软骨下骨反应性增生等病理变化〔6〕。实验证明,膝关节腔内注射2%木瓜蛋白酶和L-半胱氨酸混合溶液、手术切除大鼠膝关节内侧半月板、切断内侧副韧带是切实可行的造模方法〔7~9〕。既往也有不少对不同浓度木瓜蛋白酶造模研究的报道,但对于药物关节腔内注射和关节不稳这两种造模方法的对比研究却报道极少。本实验将药物造模和手术造模产生的膝关节OA(KOA)关节软骨Ⅱ型胶原表达的变化进行对比,旨在为实验研究选取合适的模型提供理论依据。
1 材料与方法
1.1 实验材料、药物和试剂 SD大鼠(安徽省实验动物中心)批号scxk(皖)2011-002;Ⅱ型胶原一抗(北京博奥森生物技术有限公司)批号130717w;Ⅱ型胶原二抗(北京中杉金桥生物技术有限公司)批号K142318B;木瓜蛋白酶、L-半胱氨酸(美国Sigma公司);盐酸曲马多注射液(欧洲麦道甘美大药厂)批号AM06AB;注射用青霉素钠(华北制药股份有限公司)批号F3076112。
1.2 方法
1.2.1 实验动物和分组方法 选取健康8周龄雄性SD大鼠54只,按体重分层后随机分为手术组、药物组、对照组,每组18只,常规饲养1 w后进行手术和关节腔注射。
1.2.2 实验方法
1.2.2.1 药物组 木瓜蛋白酶关节腔注射建立大鼠KOA模型。 在无菌条件下用0.9%氯化钠溶液配制2%(W/V)木瓜蛋白酶溶液和0.03 mol/L的L-半胱氨酸溶液,于4℃恒温冰箱储存,至实验前4 h取出室温放置,注射前30 min将 2% 的木瓜蛋白酶溶液和0.03 mol/L的L-半胱氨酸溶液按2∶1的比例混匀。将大鼠腹腔注射10%水合氯醛麻醉,麻醉成功后双膝关节备皮、消毒、屈曲约45°,从髌骨下缘前内侧的膝眼向髁间窝方向进针,明显有落空感后,针尖抵达股骨内侧髁再回撤2 mm,注入2%木瓜蛋白酶与L-半胱氨酸的混合溶液0.15 ml至右侧膝关节腔。左侧膝关节腔同样方法注射0.15 ml生理盐水对照。实验开始后第4、7天分别再注射1次。
1.2.2.2 手术组 以关节不稳建立大鼠KOA模型。器械灭菌,铺好无菌手术单(长40 cm、宽60 cm),将大鼠按3 ml/kg水合氯醛腹腔内注射麻醉,选取右膝关节,膝关节上下1.5 cm范围备皮、碘伏消毒、75%酒精脱碘,铺巾。在髌韧带内侧取长约0.5 cm切口,钝性分离软组织后切开关节囊,将髌骨向外侧脱位,分离并切除内侧半月板、分离并切断内侧副韧带。髌骨复位,关闭关节囊,缝合手术切口。对侧膝关节打开关节囊后不行内侧副韧带切断和内侧半月板切除,关闭关节囊,缝合手术切口。术后肌注青霉素钠1 ml预防感染、1 ml喷洒于伤口,大鼠麻醉清醒后肌注盐酸曲马多注射液镇痛。术后分笼饲养,切口愈合良好无渗出。
1.2.3 取材和标本处理 分别在第4、6、8周取材大鼠右膝关节股骨内侧髁关节软骨,4%甲醛溶液固定1 d,10%EDTA溶液对所取标本脱钙,梯度酒精脱水,二甲苯透明,浸蜡过液,石蜡包埋、切成4 μm厚的切片,免疫组化染色,中性树胶封片,观察。
1.3 观察指标
1.3.1 改良Mankin评分 光镜下观察改良Mankin评分,并根据评分对KOA标本进行病理学分期:0~1分为正常,2~5分为早期,6~9分为中期,10~14分为晚期。
1.3.2 观察Ⅱ型胶原的表达 分别在第4、6、8周观察大鼠右腿股骨内侧髁形态改变和关节表面变化,对每张切片选取4个不同的视野,放大400倍观察软骨基质中Ⅱ型胶原的表达。
1.4 统计学方法 采用 SPSS17.0 统计软件进行单因素方差分析及秩和检验。
2 结 果
2.1 光镜下观察改良Mankin评分 药物组大鼠第4周处于KOA早期,第6周处于KOA早期、中期过渡时间,第8周处于KOA中期;手术组大鼠第4周处于KOA早期,第6周处于KOA早期、中期过渡时间,第8周处于KOA中期。药物组与手术组大鼠Mankin评分相比差异无统计学意义(P>0.05),见表1。

表1 两种造模方法不同时间节点KOA大鼠改良Mankin评分
与同期对照组比较:1)P<0.05
2.2 各组膝关节软骨细胞Ⅱ型胶原的表达 正常关节软骨从关节面到软骨下骨、软骨基质都是均一和完整的。软骨基质中度、深度着色;接近关节表面的软骨细胞较小;软骨中层或深层的软骨细胞则较大。对照组Ⅱ型胶原表达正常,软骨面呈均匀的褐色,细胞周围均匀的包裹大量淡褐色区域。药物组和手术组第4周软骨细胞分布不均匀,Ⅱ型胶原表达减少,着色不均匀。第6周药物组和手术组软骨细胞周围Ⅱ型胶原着色不规则且大量减少,手术组软骨表面欠光滑。至第8周,药物组与手术组软骨表面均有缺损,Ⅱ型胶原表达极少。见图1,图2。
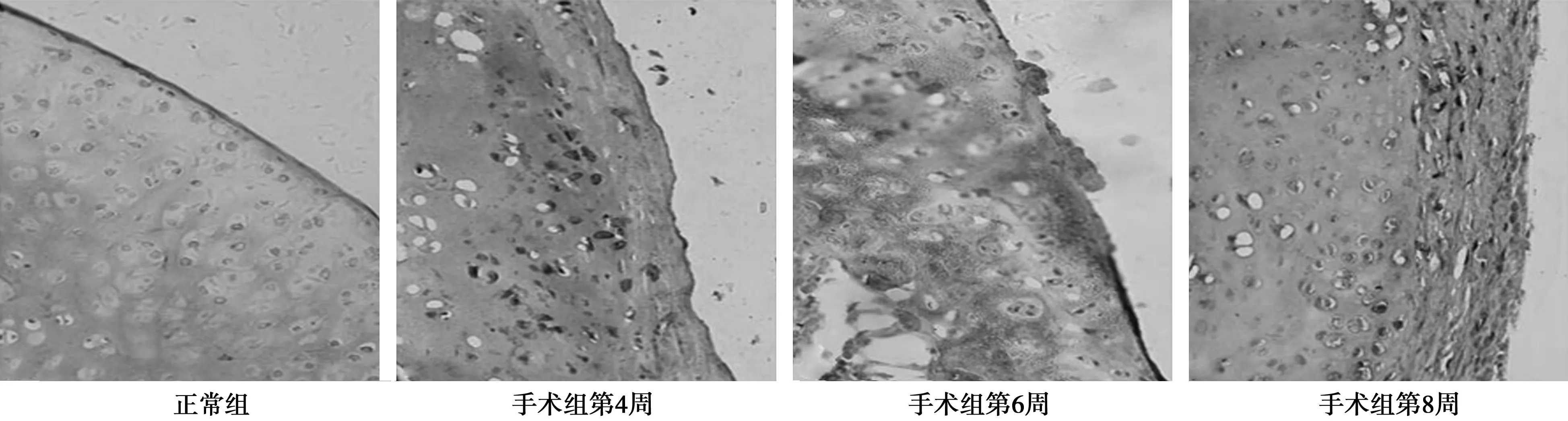
图1 手术组Ⅱ型胶原在不同时间节点的表达(DAB,×400)

图2 药物组Ⅱ型胶原在不同时间节点的表达(DAB,×400)
3 讨 论
关节软骨的细胞外基质除水外主要是胶原和蛋白聚糖。在几种遗传学上不同的胶原中,Ⅱ型胶原是关节软骨的主要成分和张力的决定性因素,Ⅱ型胶原的减少直接导致软骨的受力发生变化〔10~14〕。研究认为,人类OA软骨最早发生的显著变化之一是水分的增加和蛋白多糖的减少〔15〕。研究OA的动物模型制备方法对动物的选择很广泛,有大鼠、兔、猪、羊等〔16~20〕。而大鼠具有基因与人类类似、价廉且易饲养等优点,故被经常用于制作OA动物模型。
木瓜蛋白酶对动植物蛋白具有较强的水解能力,其诱导大鼠KOA具有成功率高、时间短、重复性好等特点。与韩冠英等〔21〕选用不同浓度木瓜蛋白酶诱导KOA的做法不同,本研究采用的木瓜蛋白酶溶液浓度相对较低,注射的是木瓜蛋白酶与L-半胱氨酸溶解成2%的木瓜蛋白酶与0.03 mol/L 的 L-半胱氨酸的混合溶液。手术法复制OA模型的重点在于破坏关节的稳定性,造成膝关节的生物力学紊乱,具有成功率高、效果切实可靠、时间短等优点。膝关节不稳后会使关节软骨产生肥厚性表现、胶原网消失。初始阶段是软骨蛋白聚糖合成增加、胶原减少,其后软骨基质循环加快,只消耗重要成分软骨基质。Hayami等〔22,23〕研究证明半月板具有吸收震荡、分布负荷和延伸关节滑液等作用。膝关节是人体最大最复杂的受力关节,在关节软组织的损伤后如果没有得到足够的修复,常发展为创伤性关节炎。Stoop等〔24〕通过手术造成关节不稳建立大鼠膝关节OA,发现早期即有关节软骨的Ⅱ型胶原裂解产物增多。基质金属蛋白酶(MMPs)在软骨基质大分子的裂解过程中起主要作用(主要是胶原酶3,即MMP-13),在OA时,各种MMPs的含量表达增高,由于Ⅱ型胶原是被胶原酶裂解变性的,Ⅱ型胶原裂解也明显增加。这种裂解最先发生于健康关节软骨浅表部位的软骨细胞周围,继之发展到整个关节软骨层。虽然OA时,Ⅱ型胶原的合成是显著增加的,但是原有的和新合成的Ⅱ型胶原都在被裂解,这种增加不足以抵消MMPs对它的裂解。
1 顾 斌,朱秀龙,张美花,等.上海市郊区老年人膝关节骨关节炎现患调查〔J〕.中国全科医学,2011;14(10):3374-6.
2 唐江龙.迪庆高原民族地区农村中老年人膝骨性关节炎的流行病学调查〔J〕.中国当代医药,2013;20(17):159-63.
3 黄洪容.我国社区中老年人膝骨关节炎的发病趋势分析〔J〕.当代医学,2012;18(12):58-60.
4 Woodhouse FG, Gardiner BS, Smith DW.Short-term consolidation of articular cartilage in the long-term context of osteoarthritis〔J〕. J Theor Biol, 2015;368(3):102-12.
5 Hering TM, Wirthlin L, Ravindran S,etal. Changes in type Ⅱ procollagen isoform expression during chondrogenesis by disruption of an alternative 5′ splice site within Col2a1 exon 2〔J〕. Matrix Biol, 2015;36(6): 51-63.
6 马春辉,蔡国平,阎作勤,等.O型胶原在骨关节炎软骨细胞中的表达〔J〕. 复旦学报(医学版),2009;36(6):734-6.
7 Lampropoulou-Adamidou K, Lelovas P, Karadimas EV,etal.Useful animal models for the research of osteoarthritis〔J〕. Eur J Orthop Surg Traumatol, 2014;24(3):263-71.
8 Ling PX, Zhang LN, Jin Y,etal.Effects of a hyaluronic acid and low molecular weight heparin injection on osteoarthritis in rabbits〔J〕. Drug Discov Ther, 2009;3(4):146-50.
9 Daans M, Luyten FP, Lories RJ. GDF5 deficiency in mice is associated with instability-driven joint damage, gait and subchondral bone changes〔J〕. Ann Rheum Dis, 2011;70(1):208-13.
10 Kim HD,Heo J,Hwang Y,etal.Extracellular-matrix-based and Arg-Gly-Asp-modified photopolymerizing hydrogels for cartilage tissue engineering〔J〕. Tissue Eng Part A, 2015;21(3-4):757-66.
11 Wilusz RE, Sanchez-Adams J, Guilak F. The structure and function of the pericellular matrix of articular cartilage〔J〕. Matrix Biol, 2014;39:25-32.
12 Speirs AD, Beaulé PE, Ferguson SJ,etal.Stress distribution and consolidation in cartilage constituents is influenced by cyclic loading and osteoarthritic degeneration〔J〕. J Biomech, 2014;47(10):2348-53.
13 Zhen G, Cao X. Targeting TGFβ signaling in subchondral bone and articular cartilage homeostasis〔J〕. Trends Pharmacol Sci, 2014;35(5):227-36.
14 Yasuda T. Activation of p38 mitogen-activated protein kinase is inhibited by hyaluronan via intercellular adhesion molecule-1 in articular chondrocytes stimulated with type Ⅱ collagen peptide〔J〕. J Pharmacol Sci, 2012;118(1):25-32.
15 杨 军,娄德全,周振东,等. 基质金属蛋白酶和胶原在创伤关节软骨组织中的表达〔J〕.中国组织工程研究与临床康复,2011;15(20):3636-40.
16 Cake MA, Read RA, Guillou B,etal.Modification of articular cartilage and subchondral bone pathology in an ovine meniscectomy model of osteoarthritis by avocado and soya unsaponifiables (ASU)〔J〕. Osteoarthritis Cartilage, 2000;8(6):404-11.
17 Alam MR, Ji JR, Kim MS,etal.Biomarkers for identifying the early phases of osteoarthritis secondary to medial patellar luxation in dogs〔J〕. J Vet Sci, 2011;12(3):273-80.
18 E XQ, Cao Y, Meng H,etal.Dendritic cells of synovium in experimental model of osteoarthritis of rabbits〔J〕. Cell Physiol Biochem, 2012;30(1):23-32.
19 Ashraf S,Mapp PI,Walsh DA.Contributions of angiogenesis to inflammation, joint damage, and pain in a rat model of osteoarthritis〔J〕. Arthritis Rheum, 2011;63(9):2700-10.
20 Al Faqeh H,Nor Hamdan BM,Chen HC,etal.The potential of intra-articular injection of chondrogenic-induced bone marrow stem cells to retard the progression of osteoarthritis in a sheep model〔J〕. Exp Gerontol, 2012;47(6):458-64.
21 韩冠英,凌沛学,王凤山,等.不同浓度木瓜蛋白酶建立兔膝骨关节炎模型的比较研究〔J〕.中国骨伤,2012;25(5):424-9.
22 Hayami T,Pickarski M,Zhuo Y,etal.Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis〔J〕. Bone, 2006;38(2):234-43.
23 Karahan S,Kincaid SA,Kammermann JR,etal.Evaluation of the rat stifle joint after transection of the cranial cruciate ligament and partial medial meniscectomy〔J〕. Comp Med, 2001;51(6):504-12.
24 Stoop R,Buma P,van der Kraan PM,etal.Type Ⅱ collagen degradation in articular cartilage fibrillation after anterior cruciate ligament transection in rats〔J〕. Osteoarthritis Cartilage, 2001;9(4):308-15.
〔2015-01-09修回〕
(编辑 苑云杰/曹梦园)
中国博士后基金项目(No.2011M501355);安徽省自然科学基金项目(No.1508085MH181);安徽中医药大学省级大学生创新创业训练项目(No.2014048)
汪宗保(1973-),男,主治医师,副教授,硕士生导师,临床医学博士后,主要从事运动医学研究。 徐亚林(1970-),男,主任医师,硕士生导师,临床医学博士后,主要从事康复医学研究。
吴向阳(1992-),男,主要从事骨关节炎的针灸、康复疗法研究。
R274
A
1005-9202(2017)09-2114-04;
10.3969/j.issn.1005-9202.2017.09.014
1 安徽中医药大学研究生部
2 广东医学院附属开平医院康复医学科
