降压宝蓝片含药血清对大鼠血管成纤维细胞增殖及表型转化的影响
2017-05-25梁瑞峰李开言王晓丽张雪侠
梁瑞峰 李开言 王晓丽 张雪侠 王 军
(河南省中医药研究院中药研究所,河南 郑州 450004)
降压宝蓝片含药血清对大鼠血管成纤维细胞增殖及表型转化的影响
梁瑞峰 李开言 王晓丽 张雪侠 王 军
(河南省中医药研究院中药研究所,河南 郑州 450004)
目的 观察降压宝蓝片含药血清对大鼠血管紧张素Ⅱ诱导的成纤维细胞增殖及转化的影响。方法 原代培养大鼠胸主动脉外膜成纤维细胞,分为空白组、模型组、降压宝蓝片含药血清低、中、高浓度组(体积分数为5%、10%、15%)。用噻唑蓝(MTT)法测定细胞增殖活性,羟脯氨酸法检测胶原含量,酶联免疫吸附(ELISA)法检测转化生长因子(TGF)-β1含量,免疫组化法检测α-平滑肌肌动蛋白(α-SMA)表达情况。结果 与模型组相比,降压宝蓝片含药血清高浓度组细胞增殖、胶原、TGF-β1分泌、α-SMA表达显著降低(P<0.05或P<0.01),中浓度组细胞增殖、TGF-β1含量显著降低(P<0.05)。结论 降压宝蓝片含药血清可抑制成纤维细胞增殖和表型转化。
含药血清;成纤维细胞;增殖;表型转化
血管重构是高血压、动脉粥样硬化等心血管疾病的共同病理生理过程,对其研究以往主要集中于内膜内皮细胞和中膜平滑肌细胞,近年来研究表明,血管重构主要是基于外膜的病理过程〔1〕,血管损伤后血管成纤维细胞(AFs)向肌成纤维细胞(MFs)的转化是这一过程的关键事件〔2〕。转化生长因子(TGF)-β1是病理性血管重构过程中重要的因子,其能够促进AFs过度增殖,诱导AFs向MFs转化,上调α-平滑肌肌动蛋白(α-SMA)及胶原的表达〔3〕。AFs的增殖及表型转化在血管重构的发生发展中扮演着重要角色,抑制AFs增殖和表型转化对改善病理性血管重构具有重要意义。降压宝蓝片主要用于肝火亢盛型高血压的治疗,临床疗效确切,动物试验表明降压宝蓝片可以改善自发性高血压大鼠的血管重构〔4〕。本实验通过观察降压宝蓝片含药血清对血管紧张素(Ang)Ⅱ诱导的AFS增殖及表型转化的影响。
1 材料与方法
1.1 动物 SPF级SD大鼠,雄性,体重180~200 g,购自河南省实验动物中心,合格证号SCXK(豫)2010-0002。
1.2 药物与试剂 降压宝蓝片,河南省中医药研究院附属医院制剂室提供,批准文号:豫药制字Z20121056,批号20130404;胎牛血清、DMEM培养基、胰蛋白酶均购自美国Hyclone公司;噻唑蓝(MTT)购自Amresco公司;AngⅡ购自Sigma公司;羟脯氨酸试剂盒购自南京建成生物公司;TGF-β1试剂盒、α-SMA单克隆抗体、SABC试剂盒均购自武汉博士德生物工程有限公司。
1.3 主要仪器 全功能酶标仪(美国Bio-Tek公司);细胞培养箱(美国Forma Scientific公司);2K15型冷冻离心机(Sigma公司);倒置相差显微镜(重庆光学仪器厂)。
1.4 方法
1.4.1 含药血清制备 20只SD大鼠随机分为空白组和降压宝蓝片组,每组10只。按体表面积法换算动物的等效剂量,降压宝蓝片组给予降压宝蓝片0.9 g·kg-1·d-1(等效剂量的5倍),空白组给予相同体积的蒸馏水,灌胃给药,每天1次,连续7 d,末次给药后2 h,麻醉腹主动脉取血,3 000 r/min离心10 min分离血清,56℃水浴灭活30 min,0.22 μm过滤除菌,-20℃保存备用〔5〕。
1.4.2 细胞培养 SD大鼠麻醉,取胸主动脉,无菌磷酸盐缓冲液(PBS)漂洗2次,眼科剪纵向剪开血管,血管内膜面朝上铺于培养皿上,用眼科弯镊轻轻刮去内膜,然后固定血管一端,用眼科弯镊剥离中膜,余下外膜,PBS漂洗1次,将外膜置于含20%胎牛血清的DMEM培养液中,剪成1 mm2组织块,平铺于25 ml培养瓶底,翻转使瓶底在上,贴壁培养4 h,添加含20%胎牛血清的DMEM培养液3 ml,小心翻转培养瓶使组织块浸于DMEM 培养基中继续培养。5~7 d后待细胞达70%融合时胰酶消化传代,第3~6代细胞用于试验。
1.4.3 实验分组 实验设空白组(体积分数为15%的空白血清)、模型组(15%空白血清+10-6mol/L AngⅡ)、降压宝蓝片低浓度组(5%降压宝蓝片血清+10%空白血清+10-6mol/L AngⅡ)、中浓度组(10%降压宝蓝片含药血清+5%空白血清+10-6mol/L AngⅡ)及高浓度组(15%降压宝蓝片含药血清+10-6mol/L AngⅡ),每组均设6个复孔。
1.4.4 MTT法检测细胞增殖活性 以1×105个/ml的AFs接种于96孔板中,另设6孔为阴性组(无细胞),培养24 h后,分组处理20 h后,每孔加入5 g/L的MTT 20 μl,继续孵育4 h,小心吸弃培养液,然后每孔加入150 μl二甲基亚砜(DMSO),避光震荡10 min,用酶标仪于570 nm处测定各孔的吸光度(OD)。
1.4.5 测定细胞胶原含量 细胞以1×105个/ml接种于48孔板培养24 h后,吸取0.5 ml上清液,按羟脯氨酸测试盒说明进行操作,测定细胞内胶原含量。
1.4.6 ELISA检测TGF-β1含量 细胞以1×105个/ml接种于接种于24孔板,药物作用24 h后吸取0.5 ml上清液,采用ELISA法检测细胞液中TGF-β1 含量。
1.4.7 免疫组化检测α-SMA表达 将细胞爬片置于6孔板中,按照每孔1×104个的密度接种细胞,24 h后,每组加入相应药物,培养24 h后,PBS冲洗3次,4%多聚甲醛固定,PBS冲洗3次, 3%过氧化氢灭活10 min,山羊血清封闭10 min,加α-SMA单抗(浓度1∶100),4℃过夜,PBS冲洗,加生物素标记的二抗,室温孵育60 min;PBS冲洗,过氧化物酶孵育60 min,PBS冲洗,DAB显色,苏木精复染,二甲苯透明,中性树胶封片,镜下观察,阳性细胞细胞质呈棕黄色,于镜下随机取6个非重叠视野,计算α-SMA阳性细胞百分率。
1.5 统计学方法 采用SPSS17.0统计软件进行单因素方差分析,两两比较用LSD检验。
2 结 果
2.1 AFs的培养及形态 组织块贴壁培养7 d后,开始有细胞从组织块边缘爬出(图1a),细胞形状不规则,多呈梭形、多角形或不规则形状。原代细胞经胰酶消化后回缩、变圆,传代后生长较均匀,传至3~8代后的细胞生长最为旺盛(图1b),5~7 d后可见细胞呈80%融合状态。

图1 AFs形态观察
2.2 降压宝蓝片含药血清对细胞活力的影响 空白组细胞活力(0.352±0.058)与模型组(0.504±0.060)相比显著增加(P<0.01);与模型组相比,降压宝蓝片含药血清中、高浓度组(0.463±0.068,0.392±0.073)细胞增殖显著降低(P<0.05或P<0.01),低浓度组(0.522±0.078)细胞增殖无明显变化(P>0.05)。
2.3 降压宝蓝片含药血清对各组细胞上清液中胶原、TGF-β1的影响 与空白组相比,模型组细胞培养上清液胶原、TGF-β1含量显著升高;与模型组相比,降压宝蓝片含药血清中浓度组(体积分数10%)上清液中TGF-β1含量降低(P<0.05),降压宝蓝片含药血清高浓度组(体积分数15%)上清液胶原、TGF-β1含量显著升高(P<0.01),见表1。

表1 降压宝蓝片含药血清对上清液中胶原、TGF-β1含量的影响
与模型组比较:1)P<0.05,2)P<0.01
2.4 免疫组化检测AFs中α-SMA蛋白的表达 空白组细胞α-SMA阳性表达为阴性,模型组阳性细胞率(18.16%)明显升高(P<0.01)。与模型组相比,降压宝蓝片含药血清低、中、高浓度组细胞阳性率(15.28%,14.02%,11.12%)显著降低(P<0.05)。见图2。
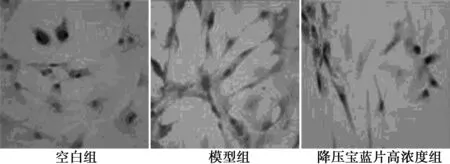
图2 AFs中α-SMA蛋白的表达(DAB,×250)
3 讨 论
血管主要由内膜的内皮细胞、中膜的平滑肌细胞、外膜的AFs以及细胞外基质组成。血管重构是高血压、动脉粥样硬化、血管内膜损伤后再狭窄等多种心血管疾病发病的共同病理基础。传统的观点认为,处于血管最外层的血管外膜只对血管起支持和营养作用,近年研究表明,外膜的AFs在高血压等刺激下表型转化为MFs,其标志性蛋白是α-SMA〔6〕,细胞进而发生增殖、迁移、分泌大量细胞外基质,参与血管新生内膜的形成〔7〕。外膜AFs是血管重构的重要部位,并成为血管重构防治的新靶点〔8〕。正常的AFs缺少TGF-β1基因的表达,血管损伤后,细胞分泌TGF-β1增加,并刺激细胞增殖〔9〕。α-SMA 是MFs的标志蛋白,其表达的增加能反映静止型组织细胞向活跃型MFs的转化,通过这种转化,细胞将获得过表达细胞外基质的能力〔10,11〕。本实验显示,AngⅡ刺激后,AFs分泌的TGF-β1和胶原增加,细胞增殖明显增强,α-SMA表达,而经过降压宝蓝片含药血清干预,AFs的增殖能力下降,TGF-β1和胶原分泌减少,α-SMA表达受到抑制。
综上所述,本研究提示降压宝蓝片含药血清可能通过抑制AFs的增殖和表型转化从而改善血管重构,在防治血管重构方面发挥积极作用,但具体的分子机制尚有待进一步研究。
1 Stenmark KR,Nozik-Grayck E,Gerasimovskaya E,etal.The adventitia:essential role in pulmonary vascular remodeling〔J〕.Comp Physiol,2011;1(1):141-61.
2 Forte A,Della Corte A,De Feo M,etal.Role of myofibroblasts in vascular remodeling:focus on restenosis and aneurysm〔J〕.Cardiovasc Res,2010;88(3):395-405.
3 沈 凯,陈 芬,林卓明,等.血管紧张素Ⅱ通过细胞外信号调节激酶1/2通路调控过氧化氢酶的表达及促进成纤维细胞表型转化〔J〕.中国病理生理杂志,2014;30(4):711-4.
4 罗继红,苗治国.降压宝蓝片治疗高血压120例〔J〕.中医研究,2010;23(4):38.
5 刘立萍,任艳玲,李 然,等.左归丸含药血清通过p38 MAPK信号通路诱导MC3T3-E1成骨细胞的分化〔J〕.中国老年学杂志,2013;33(7):1579-81.
6 Coen M,Gabbiani G,Bochaton-Piallat ML.Myofibroblast-mediated adventitial remodeling:an underestimated player in arterial pathology〔J〕.Arterioscler Thromb Vasc Biol,2011;31(11):2391-6.
7 Hinz B,Phan SH,Thannickal VJ,etal.Recent developments in myofibroblast biology:paradigms for connective tissue remodeling〔J〕.Am J Pathol,2012;180(4):1340-55.
8 王 敏,曹秉振.血管外膜成纤维细胞与血管病变的研究进展〔J〕.中华神经医学杂志,2014;13(12):1288-91.
9 林绍慧,盛 净,马绍骏, 等.CTRP3对TGF-β1诱导的血管外膜成纤维细胞增殖及α-SMA表达的影响〔J〕.上海交通大学学报(医学版),2014;34(3):274-8.
10 汪 婷,王伟华,孔祥权.松弛素对血管紧张素Ⅱ诱导的大鼠血管外膜成纤维细胞胶原水平的影响〔J〕.临床心血管病杂志,2013;29(2):155-7.
11 陈闻东,楚玉峰,刘建军,等.RhoA-Rho激酶信号转导通路参与TGF-β1诱导的血管外膜成纤维细胞表型转化为肌成纤维细胞〔J〕.生理学报,2013;65(2):113-21.
〔2015-12-10修回〕
(编辑 苑云杰/曹梦园)
国家中医药管理局重点学科建设项目(国中医药发〔2009〕30号);国家中医药管理局中医心病学重点学科基础研究课题(No.1304483)
王 军(1961-),男,博士,研究员,硕士生导师,主要从事中药心血管药理学研究。
梁瑞峰(1983-),男,硕士,助理研究员,主要从事中药药理及中药药性研究。
R285.5
A
1005-9202(2017)09-2103-03;
10.3969/j.issn.1005-9202.2017.09.009
