三七粉对四氯化碳(C Cl4)诱导的大鼠慢性肝损伤的保护作用
2017-05-25董婧婧刘艳菊陈祥胜付伟李鑫
董婧婧,刘艳菊,陈祥胜,付伟,李鑫
[湖北中医药大学药学院(湖北省中药炮制工程技术研究中心),湖北武汉430065]
三七粉对四氯化碳(C Cl4)诱导的大鼠慢性肝损伤的保护作用
董婧婧,刘艳菊,陈祥胜,付伟,李鑫
[湖北中医药大学药学院(湖北省中药炮制工程技术研究中心),湖北武汉430065]
目的探讨三七粉对四氯化碳(CCl4)诱导的慢性肝脏损伤和肝纤维化的保护作用。方法采用SD大鼠皮下注射10%CCl4花生油溶液,建立慢性肝损伤和肝纤维化模型,分别对给药后模型大鼠血清中的丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、炎症因子(IL-1、IL-6及IL-8)和肿瘤坏死因子(TNF-α),以及肝匀浆中的丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Px)和肝药酶(Cyt.P450、Cyt.b5)等生化指标进行测定,并通过苏木精-伊红染色法(HE)染色后,显微观察三七粉对模型大鼠肝脏病理变化的影响。结果三七粉降低CCl4模型大鼠ALT和AST水平,促进Cyt.P450和Cyt.b5酶的活力,增强肝脏SOD和GSH-Px水平,降低肝脏MDA的水平,并且对IL-1、IL-6、IL-8和TNF-α水平具有抑制作用。结论三七粉具有抗CCl4诱导的肝损伤和肝纤维化作用。
三七粉;四氯化碳;肝纤维化;肝损伤;保护作用
三七为五加科植物三七[panax notoginseng(Burkill)F.H.Chen ex C.H]的干燥根和根茎。药性甘、微苦、温、归肝经和胃经,主要功效为止血化瘀、消肿定痛。在《中国药典》(2015年版)中收载有三七粉饮片[1],也是在中医临床中常用的组方药物。近代研究发现,三七还有抗肿瘤、降血糖等作用[2-9]。本文通过皮下注射四氯化碳溶液建立大鼠肝损伤和肝纤维化模型,评价三七粉整体对慢性肝损伤和肝纤维化的保护作用,为拓展三七粉的临床应用范围提供理论基础。
1 材料与方法
1.1 试验动物
SD大鼠,雄性,体重180~200g,清洁级[由安徽医科大学实验动物中心提供,许可证号:SCXK(皖)2011-002;温度19~23℃,湿度45%~55%,空调控制]。
1.2 试验药物
联苯双酯片(上海信谊天平药业有限公司),三七粉[购于云南省文山州(20头、3年生),三七原料经粉碎、过筛后制备得三七粉]。
1.3 试验试剂
细胞色素P450(cytochrome P450,Cyt.P450)(上海源叶生物技术有限公司,批号:E30118),细胞色素b5(cytochrome b5,Cyt.b5)(上海源叶生物技术有限公司,批号:E20089),谷胱甘肽(Glutathione,GSH)(上海源叶生物技术有限公司,批号:E31034),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)(上海源叶生物技术有限公司,批号:E31036),丙氨酸氨基转移酶(alanine aminotransferase,ALT)测定试剂盒、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)测定试剂盒、丙二醛(malondiadehyde,MDA)试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(均购于江苏省南京建成生物工程研究所)。
1.4 试验仪器
RT-6000酶标仪(美国雷杜公司),JW3021HR离心机(安徽省合肥嘉文仪器装备有限公司),GL-88B漩涡混合器(江苏省海门其林贝尔仪器制造公司),移液器(德国eppendorf公司),DNP-9052BS-Ⅲ电热恒温箱(上海三发科学仪器有限公司),灌胃针头,注射器,天平。
1.5 方法
1.5.1 动物分组及给药将SD雄性大鼠,随机分成6组,每组10只,正常对照组和损伤对照组灌胃生理盐水5mg/kg,阳性对照组联苯双酯灌胃100mg/kg;受试样品分高、中、低3个剂量组,分别给予受试药按以相当2倍临床常用量、临床常用量、0.5倍临床常用量。设立高、中、低三组;每日1次,灌胃给药。另外除正常对照组外,其他各组每周2次皮下注射10%四氯化碳(carbon tetrachloride,CCl4)花生油溶液5 mg/kg,以诱导慢性肝损伤和肝纤维化,给予正常饮食。连续给予CCl4和三七粉以及联苯双酯12周。
1.5.2 对肝药酶诱导的影响取部分肝组织匀浆后,按试剂盒说明书测定Cyt.P450和Cyt.b5的含量。
1.5.3 抗氧化作用肝脏匀浆后,按试剂盒说明书测定肝组织中SOD、MDA、GSH和GSH-Px的含量。
1.5.4 对肝功能的影响末次给药后,麻醉,腹主动脉取血,按试剂盒说明书测定AST和ALT的水平。
1.5.5 对炎症因子的影响末次给药后,麻醉,腹主动脉取血,用ELISA试剂盒检测大鼠血清中白细胞介素(interleukin-1,IL-1)、白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-8,IL-8)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的含量。
1.5.6 对肝脏组织的病理学观察切取SD大鼠肝脏右叶0.5 cm×0.5 cm×1.0 cm的组织块,进行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,并置于显微镜下观察结果。
1.6 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用one-way-AVOVA进行方差分析,方差不齐,采用Dunnettt检验;采用LSD-t检验,组间两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 三七粉灌胃后C C l4模型大鼠肝药酶水平
大鼠连续灌胃12周后,三七粉对CCl4模型大鼠肝药酶的影响水平测试结果见表1。各实验组对大鼠肝脏Cyt.b5水平的比较,经方差分析,差异有统计学意义(F=15.375,P=0.003),两两比较经LSD-t检验,模型组大鼠肝脏Cyt.b5水平低于正常组(t= 6.675,P=0.000),阳性对照组大鼠肝脏Cyt.b5水平高于模型组(t=4.354,P=0.001),三七粉中剂量组大鼠肝脏Cyt.b5水平高于模型组(t=3.200,P=0.005)。各实验组对大鼠肝脏Cyt.P450水平的比较,经方差分析,差异有统计学意义(F=12.438,P=0.004),两两比较经LSD-t检验,模型组大鼠肝脏Cyt.P450水平低于正常组(t=7.363,P=0.000),阳性对照组大鼠肝脏Cyt.P450水平高于模型组(t=2.106,P=0.032),三七粉高、中、低剂量组大鼠肝脏Cyt.P450水平高于模型组(t三七粉高剂量组=4.184,P=0.001;t三七粉中剂量组= 5.491,P=0.000;t三七粉低剂量组=3.110,P=0.006)。
2.2 三七粉灌胃后C C l4模型大鼠肝功能状况
三七对CCl4模型大鼠肝功能的影响结果见表2,各实验组对大鼠肝脏丙氨酸转氨酶含量的比较,经方差分析,差异有统计学意义(F=11.530,P=0.004),两两比较经LSD-t检验,模型组大鼠丙氨酸转氨酶含量高于正常组(t=8.628,P=0.000),阳性对照组大鼠丙氨酸转氨酶含量低于模型组(t=5.873,P=0.002),三七粉高剂量组大鼠丙氨酸转氨酶含量低于模型组(t=7.965,P=0.000)。各实验组对大鼠肝脏丙氨酸转氨酶含量的比较,经方差分析,差异有统计学意义(F= 9.532,P=0.006),两两比较经LSD-t检验,模型组大鼠天冬氨酸转氨酶含量高于正常组(t=7.831,P= 0.000),阳性对照组大鼠天冬氨酸转氨酶含量低于模型组(t=4.846,P=0.005),三七粉中、高剂量组大鼠天冬氨酸转氨酶含量低于模型组(t三七粉中剂量组= 2.712,P=0.014;t三七粉高剂量组=4.211,P=0.001)。
2.3 三七粉灌胃后大鼠肝脏氧化酶水平
三七粉对大鼠肝脏谷胱甘肽和谷胱甘肽过氧化物酶的影响水平结果见表3,各实验组对大鼠肝脏谷胱甘肽水平的比较,经方差分析,差异有统计学意义(F=11.800,P=0.004),两两比较经LSD-t检验,模型组大鼠肝脏谷胱甘肽的水平低于正常组(t=9.832,P= 0.000),阳性对照组大鼠肝脏谷胱甘肽的水平高于模型组(t=6.547,P=0.001),三七粉中、高剂量组大鼠肝脏谷胱甘肽的水平均高于模型组(t三七粉中剂量组= 4.432,P=0.000;t三七粉高剂量组=13.408,P=0.000),各实验组对大鼠肝脏谷胱甘肽过氧化物酶水平的比较,经方差分析,差异有统计学意义(F=18.406,P=0.002),两两比较经LSD-t检验,模型组大鼠肝脏谷胱甘肽过氧化物酶的水平低于正常组(t=8.566,P=0.000),阳性对照组大鼠肝脏谷胱甘肽过氧化物酶的水平高于模型组(t=5.837,P=0.002),三七粉高、中、低剂量组大鼠肝脏谷胱甘肽过氧化物酶的水平均高于模型组(t三七粉高剂量组=3.378,P=0.003;t三七粉中剂量组=4.699,P= 0.000;t三七粉低剂量组=6.637,P=0.000)。
三七粉对大鼠血浆MDA和SOD的含量检测如表4所示,各实验组对大鼠血浆MDA含量的比较,经方差分析,差异有统计学意义(F=24.640,P=0.000),两两比较经LSD-t检验,模型组大鼠血浆MDA含量高于正常组(t=15.865,P=0.001),阳性对照组大鼠血浆MDA含量低于模型组(t=23.910,P=0.000),三七粉高、中、低剂量组大鼠血浆MDA含量均低于模型组(t三七粉高剂量组=13.534,P=0.000;t三七粉中剂量组=8.724,P=0.000;t三七粉低剂量组=4.023,P=0.001)。各实验组对大鼠血浆SOD含量的比较,经方差分析,差异有统计学意义(F=25.540,P=0.000),两两比较经LSD-t检验,模型组大鼠SOD含量低于正常组(t=29.454,P=0.000),阳性对照组大鼠SOD含量高于正常组(t= 7.618,P=0.021),三七粉高、中、低剂量组大鼠血浆SOD含量高于模型组(t三七粉高剂量组=27.356,P=0.000;t三七粉中剂量组=11.832,P=0.000;t三七粉低剂量组=8.189,P= 0.000)。
表1 各组大鼠肝脏C yt.b5和C yt.P450水平(n=6±s)

表1 各组大鼠肝脏C yt.b5和C yt.P450水平(n=6±s)
注:1)与正常组比较,P<0.05;2)与模型组比较,P<0.05
C y t . p 4 5 0 /(n g / L)正常组4 1 9 . 9 4 ± 4 9 . 3 2模型组2 8 4 . 5 5 ± 3 1 . 4 21)三七粉低剂量4 0 4 . 5 3 ± 1 1 8 . 2 61)2)三七粉中剂量4 4 6 . 8 7 ± 8 8 . 8 11)2)三七粉高剂量3 5 2 . 5 3 ± 4 1 . 9 81)2)联苯双酯3 9 7 . 4 7 ± 5 5 . 3 62)F值1 2 . 4 3 8P值0 . 0 0 4组别剂量/(g / k g)C y t . b 5 /(n g / L)1 2 7 . 7 9 ± 1 3 . 0 78 6 . 2 7 ± 1 4 . 2 61)0 . 2 7 1 0 0 . 3 5 ± 1 2 . 5 51)0 . 5 4 1 1 6 . 9 0 ± 1 9 . 9 22)1 . 0 8 9 7 . 7 9 ± 9 . 7 91)0 . 1 0 1 0 5 . 9 1 ± 1 1 . 3 81)2)-1 5 . 3 7 5 -0 . 0 0 3
表2 各组大鼠肝脏谷丙转氨酶和谷草转氨酶含量测定(n=6,±s)

表2 各组大鼠肝脏谷丙转氨酶和谷草转氨酶含量测定(n=6,±s)
注:1)与空白对照组比较,P<0.05;2)与模型组比较,P<0.05
?
表3 各组大鼠肝脏谷胱甘肽和谷胱甘肽过氧化物酶的水平(n=6±s)
表3 各组大鼠肝脏谷胱甘肽和谷胱甘肽过氧化物酶的水平(n=6±s)
注:1)与空白对照组比较,P<0.05;2)与模型组比较,P<0.05
谷胱甘肽过氧化物酶/(n g / L)正常组3 4 . 9 9 ± 2 . 3 9模型组2 3 . 0 7 ± 1 . 4 91)三七粉低剂量3 2 . 3 6 ± 4 . 2 02)三七粉中剂量3 1 . 4 2 ± 5 . 1 72)三七粉高剂量2 5 . 3 8 ± 1 . 1 21)2)联苯双酯2 9 . 6 5 ± 4 . 1 22)F值1 8 . 4 0 6P值0 . 0 0 2组别剂量/(g / k g)谷胱甘肽/(n g / L)7 0 9 . 0 3 ± 7 3 . 2 6 3 6 3 . 7 7 ± 8 4 . 4 11)0 . 2 7 5 2 0 . 8 9 ± 1 7 9 . 3 51)0 . 5 4 5 6 6 . 5 6 ± 1 1 8 . 7 21)2)1 . 0 8 4 4 9 . 4 7 ± 2 4 . 4 11)2)0 . 1 0 6 7 7 . 6 0 ± 1 2 3 . 6 92)-1 1 . 8 0 0 -0 . 0 0 4
2.4 三七粉灌胃后C C l4模型大鼠炎症相关因子水平
由表5、6可知,各实验组对大鼠血浆IL-1含量的比较,经方差分析,差异有统计学意义(F=19.843,P=0.002),两两比较经LSD-t检验,模型组IL-1含量高于正常组(t=25.089,P=0.000),阳性对照组IL-1含量低于模型组(t=18.762,P=0.000),三七粉高、中、低剂量组IL-1含量低于模型组(t三七粉高剂量组=16.209,P=0.000;t三七粉中剂量组=10.485,P=0.000;t三七粉低剂量组= 7.047,P=0.001)。各实验组对大鼠血浆IL-6含量的比较,经方差分析,差异有统计学意义(F=16.809,P= 0.003),两两比较经LSD-t检验,模型组IL-6含量高于正常组(t=16.667,P=0.000),阳性对照组IL-6含量低于模型组(t=9.786,P=0.000),三七粉高、中、低剂量组IL-6含量低于模型组(t三七粉高剂量组=16.812,P=0.000;t三七粉中剂量组=10.304,P=0.000;t三七粉低剂量组=3.982,P=0.001)。各实验组对大鼠血浆IL-8含量的比较,经方差分析,差异有统计学意义(F=22.500,P=0.000),两两比较经LSD-t检验,模型组IL-8含量高于正常组(t=47.173,P=0.000),阳性对照组IL-8含量低于模型组(t=20.331,P=0.000),三七粉高、中、低剂量组IL-8含量低于模型组(t三七粉高剂量组=35.531,P=0.000;t三七粉中剂量组=32.527,P=0.000;t三七粉低剂量组= 16.404,P=0.000)。各实验组对大鼠血浆TNF-α含量的比较,经方差分析,差异有统计学意义(F=13.432,P=0.004),两两比较经LSD-t检验,模型组TNF-α含量高于正常组(t=17.454,P=0.000),阳性对照组TNF-α含量低于模型组(t=18.587,P=0.000),三七粉高、中、低剂量组TNF-α含量均低于模型组(t三七粉高剂量组=6.526,P=0.000;t三七粉中剂量组=12.663,P=0.000;t三七粉低剂量组=8.533,P=0.001)。
表4 各组大鼠血浆M D A和SO D的含量检测(n=6±s)

表4 各组大鼠血浆M D A和SO D的含量检测(n=6±s)
注:1)与空白对照组比较,P<0.05;2)与模型组比较,P<0.05
S O D /(u / L)正常组1 4 7 . 3 0 ± 5 . 4 2模型组7 6 . 1 7 ± 5 . 3 61)三七粉低剂量9 3 . 2 9 ± 3 . 7 92)三七粉中剂量1 1 6 . 5 0 ± 9 . 2 52)三七粉高剂量1 3 2 . 0 0 ± 3 . 6 32)联苯双酯1 0 6 . 4 3 ± 1 1 . 2 42)F值2 5 . 5 4 0P值0 . 0 0 0组别剂量/(g / k g)M D A /(n m o l / L)1 . 6 6 ± 0 . 1 1 3 . 3 2 ± 0 . 1 91)0 . 2 7 3 . 0 7 ± 0 . 0 51)2)0 . 5 4 2 . 7 4 ± 0 . 0 91)2)1 . 0 8 2 . 1 7 ± 0 . 1 91)2)0 . 1 0 1 . 8 3 ± 0 . 1 02)-2 4 . 6 4 0 -0 . 0 0 0
2.5 三七粉灌胃后C C l4模型大鼠肝组织病理学改变
肝脏病理学检测结果(见附图)。正常组大鼠肝小叶结构正常,肝细胞无变性、坏死;而CCl4模型大鼠肝小叶结构破坏,肝细胞明显肿胀,胞浆内可见弥漫性、大小不等的脂肪空泡,可见点状、灶状坏死,大量炎性细胞浸润,大量纤维组织增生。联苯双酯阳性对照组及三七粉治疗组以上病理改变较模型组均有改善,尤以三七粉高剂量组、中剂量组改变最明显。
表5 各组大鼠血浆I L-1和I L-6含量(n=6±s)

表5 各组大鼠血浆I L-1和I L-6含量(n=6±s)
注:1)与空白对照组比较,P<0.05;2)与模型组比较,P<0.05
I L -6 /(n g / L)正常组5 2 . 0 0 ± 9 . 1 8模型组1 0 2 . 8 0 ± 3 . 1 11)三七粉低剂量9 4 . 5 6 ± 5 . 6 71)2)三七粉中剂量8 3 . 0 2 ± 5 . 0 61)2)三七粉高剂量7 0 . 9 1 ± 5 . 3 41)2)联苯双酯6 6 . 4 3 ± 1 1 . 2 42)F值1 6 . 8 0 9P值0 . 0 0 3组别剂量/(g / k g)I L -1 /(n g / L)1 5 . 6 7 ± 1 . 9 8 4 0 . 9 4 ± 2 . 5 31)0 . 2 7 3 5 . 1 5 ± 0 . 9 81)2)0 . 5 4 3 1 . 5 7 ± 1 . 4 01)2)1 . 0 8 2 7 . 3 2 ± 1 . 0 81)2)0 . 1 0 2 4 . 4 2 ± 1 . 4 22)-1 9 . 8 4 3 -0 . 0 0 2
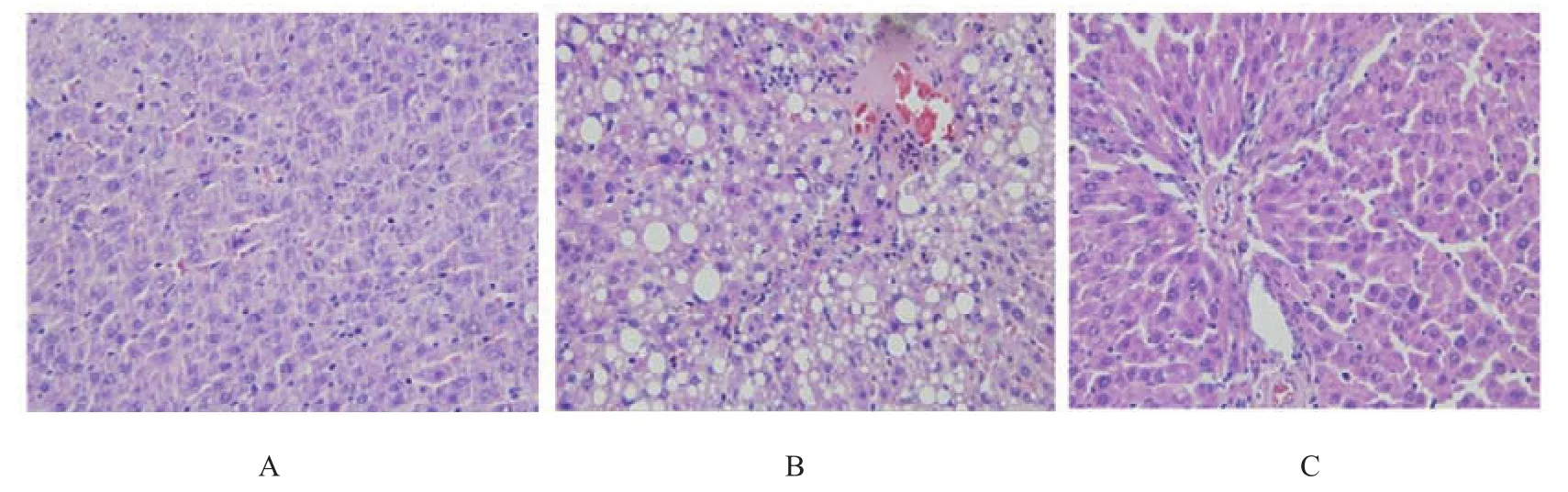

附图各组大鼠肝脏病理学变化(HE染色×200)
表6 各组大鼠血浆I L-8和TN F-α含量(n=6±s)

表6 各组大鼠血浆I L-8和TN F-α含量(n=6±s)
注:1)与空白对照组比较,P<0.05;2)与模型组比较,P<0.05
T N F -α /(n g / L)正常组1 0 9 . 6 0 ± 9 . 6 0模型组1 8 6 . 4 0 ± 7 . 7 41)三七粉低剂量1 5 5 . 4 0 ± 5 . 1 81)2)三七粉中剂量1 2 6 . 2 0 ± 1 0 . 3 91)2)三七粉高剂量1 2 2 . 0 0 ± 2 7 . 2 02)联苯双酯1 1 0 . 7 ± 8 . 9 42)F值1 3 . 4 3 2P值0 . 0 0 4组别剂量/(g / k g)I L -8 /(n g / L)2 6 9 . 5 0 ± 1 5 . 3 55 1 0 . 2 0 ± 6 . 2 61)0 . 2 7 4 4 5 . 1 7 ± 1 1 . 31)2)0 . 5 4 3 7 2 . 6 4 ± 1 1 . 7 41)2)1 . 0 8 3 1 8 . 8 0 ± 1 6 . 1 91)2)0 . 1 0 3 0 7 . 6 6 ± 3 1 . 9 32)-2 2 . 5 0 0 -0 . 0 0 0
3 讨论
CCl4造成肝损伤是因其进入肝细胞后,由于脂质过氧化使肝细胞膜脂质溶解,致使肝细胞变性坏死,肝细胞膜在受损伤的同时可产生大量新的活性氧基团,促发脂质过氧化的链式反应,由此产生的脂质过氧化物可以损伤肝脏中的各种细胞,因此肝细胞膜的脂质过氧化是肝细胞损伤时的主要作用机制之一,也是在中药肝损伤的保护作用研究中得到较为广泛认可的因素之一[10-13]。SOD作为细胞内主要的防御性抗氧化酶,能够清除自由基和抑制其脂质过氧化反应,由GSH-Px转变为水而清楚自由基,达到保护细胞免受损伤的作用;MDA作为一种脂质过氧化物,导致肝细胞破坏,其含量的高低可间接反映机体细胞受自由基攻击的严重程度[14-17]。因而本研究通过测定MDA的含量评价三七粉对CCl4大鼠体内脂质过氧化的程度的影响,检测GSH、GSH-Px和SOD的水平来衡量三七对CCl4大鼠的抗氧化水平。结果表明,三七粉能提高四氯化碳模型大鼠肝脏还原型谷胱甘肽的含量,诱导谷胱甘肽还原酶活性,能增强解毒功能。并降低四氯化碳模型大鼠体内的过氧化脂质水平而起到抗氧化损伤作用。
肝细胞的平滑内质网脂质中的微粒体酶是药物代谢最重要的酶系统,称为肝药酶,肝药酶是动物体内一种重要的代谢酶,进入血液循环的药物基本上是经肝药酶代谢的,所以对肝药酶有影响的药物,也会影响到药物(毒物)的代谢[18-20]。因而,本研究还检测了细胞色素b5和细胞色素P450酶的活力,结果表明三七粉能诱导细胞色素b5和细胞色素P450酶活性的增强,进而加速机体内毒物在肝脏的代谢速度。
细胞因子IL-1、IL-6、IL-8和TNF-α是炎症反应性介质,当肝组织存在活动性炎症时,可促进细胞分泌IL-1、IL-6、IL-8和TNF-α,从而加强细胞毒性作用,可以间接反映肝损伤的严重程度[21-23]。因此,本研究进一步检测IL-1、IL-6、IL-8和TNF-α的水平,结果表明三七粉具有一定抑制肝脏疾病细胞因子表达的作用。
综上所述,三七粉可通过改善谷丙转氨酶和谷草转氨酶水平,促进细胞色素b5和细胞色素P-450酶的活力,增强肝脏SOD和GSH-PX水平,降低肝脏MDA的水平,并对IL-1、IL-6、IL-8等多种炎症因子和肿瘤坏死因子TNF-α产生抑制作用,进而对CCl4诱导的大鼠慢性肝损伤起到保护作用。
[1]国家药典委员会.《中华人民共和国药典》(2015年版)[M].北京:中国医药科技出版社,2015.
[2]武双,崔秀明,郭从亮,等.三七“生打熟补”物质基础及药理作用研究进展[J].安徽农业科学,2015,43(8):50-53.
[3]CHAN P,THOMAS G N,TOMLINSON B.Protective effects of trilinolein extracted from panax notoginseng against cardiovascular disease[J].Acta Pharmacologica Sinica,2002,23(12):1157-1162.
[4]LIU L,ZHU L,ZOU Y,et al.Panax notoginseng saponins promotes stroke recovery by influencing expression of Nogo-A,NgR and p75NGF,in vitro and in vivo.Biol[J].Biological&Pharmaceutical Bulletin,2014,37(4):560-568.
[5]UZAYISENGA R,AYEKA PA,WANG Y.Anti-diabetic potential of panax notoginseng saponins(PNS):a review[J].Phytotherapy Research,2014,28(4):510-516.
[6]YUAN H F,PAN J F,LI S,et al.Protective effects of total saponinsofpanaxnotoginsengonsteroid-inducedavascular necrosis of the femoral head in vivo and in vitro[J].Evid Based-Complement Alternat Med,2015,2015(12):65679.
[7]DEFOUR A,DESSALLE K,CASTRO P A,et al.Sirtuin 1 regulates SREBP-1c expression in a LXR dependent manner in skeletal muscle[J].PLOs One,2012,7(9):e43490.
[8]WANG P,CUI J,DU X,et al.Panax notoginseng saponins (PNS)inhibits breast cancer metastasis[J].Ethnopharmacol,2014, 154(3):663-671.
[9]DING R B,TIAN K,CAO Y W,et al.Protective effect of panax notoginseng saponins on acute ethanol-induced liver injury is associated with ameliorating hepatic lipid accumulation and reducing ethanol-mediated oxidative stress[J].Journal of Agricultural& Food Chemistry,2015,63(9):2413-2422.
[10]AKIHARA R,HOMMA T,LEE J,et al.Ablation of aldehyde reductase aggravates carbon tetrachloride-induced acute hepatic injuryinvolvingoxidativestressandendoplasmicreticulum stress[J].Biochemical&Biophysical Research Communications, 2016,16(3):1277-1283.
[11]罗文基,张坤水,陈逸生,等.左旋虾青素对四氯化碳致大鼠慢性肝损伤保护作用的研究[J].时珍国医国药,2012,23(8):2057.
[12]覃洪含,夏星,王勤,等.三叶香茶菜对大鼠慢性肝损伤的保护作用[J].时珍国医国药,2013,24(6):1372-1373.
[13]罗亦灵,石磊,王颖钰,等.复方龙葵颗粒对四氯化碳致大鼠慢性肝损伤的保护作用[J].中药药理与临床,2014,30(1):105-108.
[14]沈洪,薛洁,朱路佳,等.生姜油不同部位对肝损伤模型大鼠肝细胞保护作用的比较[J].时珍国医国药,2009,20(1):90.
[15]尚新涛,张琳,祖元刚,等.京尼平苷对CCl4诱导的大鼠慢性肝损伤保护作用研究[J].中药药理与临床,2012,28(4):29-31.
[16]马加庆,云宇,后文俊,等.三七总皂苷对药物性肝损伤小鼠的保护作用[J].中国实验方剂学杂志,2013,19(23):246-248.
[17]张萌.醋制南五味子降酶保肝作用机理研究[D].咸阳:陕西中医学院,2013.
[18]孙长海,王瑜,徐明亮,等.中药莪术对四氯化碳所致急性肝损伤的保护作用[J].时珍国医国药,2010,21(10):2460.
[19]胡颖,苏健.穿心莲内酯对小鼠肝细胞色素P450的影响[J].大众科技,2015(5):96-98.
[20]黄苗,刘欣,董蕾,等.太白楤木对CCl4诱导肝纤维化大鼠的干预作用[J].中国中药杂志,2015,40(21):4251-4255.
[21]李刚,陈金春,付荣权,等.前列腺,素E1治疗肝硬化对IL-1β、IL-6、IL-8、TNF-α的影响[J].海峡药学,2012,24(6):74.
[22]尹连红,于浩,彭金咏.四氯化碳诱导肝损伤的分子机制及中药干预的研究进展[J].中国现代应用药学,2015,32(9):1147-1155.
[23]冯晓亮.三氯乙烯致敏豚鼠肝组织中细胞因子TNF-α、IL-1、IL-6、IL-8水平研究[D].合肥:安徽医科大学,2010.
Protective effect ofpanax notoginsengpowder on CCl4-induced chronic liver injury in rats*
Jing-jing Dong,Yan-ju Liu,Xiang-sheng Chen,Wei Fu,Xin Li
[Pharmacy School(Hubei Research Center of Chinese Materia Medica Processing Engineering and Technology),Hubei University of Chinese Medicine,Wuhan,Hubei 430065,China]
ObjectiveTo investigate the protective effects ofpanax notoginsengpowder on chronic liver injury and liver fibrosis induced by CCl4.MethodsThe model of CCl4-induced chronic liver injury and fibrosis in SD rats was established by hypodermic injection of 10%CCl4in peanut oil.Biochemical criteria were measured respectively,including ALT,AST,IL-1,IL-6,IL-8 and TNF-α in serum,and MDA,SOD,GSH, GSH-PX,Cyt.P450 and Cyt.b5 in liver homogenate.And HE dyeing,histopathological changes in liver were observed on the effects ofpanax notoginsengpowder through the microscope.ResultsThe levers of ALT,AST were decreased,and the activity of Cyt.P450 and Cyt.b5 enzyme was promoted.The levels of SOD,GSH and GSH-Px were enhanced,and the level of MDA were reduced,and the activity of IL-1,IL-6,IL-8 and TNF-α was inhibited observably in liver.ConclusionsPanax notoginsengpowder has been proved to possess significant effects on the liver fibrosis and injury induced by CCl4.
panax notoginsengpowder;CCl4;liver fibrosis;liver injury;protective effect
R282.71;R575
A
10.3969/j.issn.1005-8982.2017.08.007
1005-8982(2017)08-0032-06
2016-11-01
国家中医药管理局2015年中医药部门公共卫生专项资金(中药科技类)
刘艳菊,E-mail:1416@hbtcm.edu.cn,Tel:027-68890231
