阿司匹林诱生型脂氧素A4对小鼠脊髓撞击损伤后神经病理性疼痛的影响及机制探讨
2017-05-25郭云翮李祥米卫东
郭云翮,李祥,米卫东
(山西大同大学医学院外科教研室,山西大同037009)
阿司匹林诱生型脂氧素A4对小鼠脊髓撞击损伤后神经病理性疼痛的影响及机制探讨
郭云翮,李祥,米卫东
(山西大同大学医学院外科教研室,山西大同037009)
目的评估阿司匹林诱生型脂氧素A4(ATL)对小鼠脊髓损伤(SCI)模型中神经炎症和神经病理痛的影响。方法成年FVB小鼠T10节段脊髓进行改良Allen'脊髓撞击损伤。小鼠随机分成ATL组和Vehicle组,分别在SCI手术后4和24 h鞘内注射ATL(300 pmol)或vehicle。采用von Frey方法评估两组小鼠后脚机械刺激的敏感性;采用PCR方法检测两组小鼠脊髓小胶质细胞标记物和细胞因子信使核糖核酸(mRNA)表达;此外,通过小鼠大脑皮层组织小胶质细胞培养来评估ATL对小胶质细胞的激活和肿瘤坏死因子-α(TNF-α)释放的直接影响。结果与Vehicle组小鼠比较,ATL处理导致SCI诱导的小鼠机械痛敏降低;脊髓小胶质细胞标记物和促炎性细胞因子mRNA水平也下降。而且,ATL处理对小胶质细胞标记物IBA-1和促炎性因子TNF-α表达影响。此外,原代皮层小胶质细胞表达ATL相应受体ALX,ATL通过ALX发挥抗炎作用。结论ATL通过ALX受体调节小胶质细胞激活和TNF-α释放,最终降低小鼠SCI后神经病理性疼痛。
阿司匹林诱生型脂氧素A4;脊髓损伤;神经病理性疼痛;小鼠
脊髓损伤(Spinalcordinjury,SCI)是一种常见的损伤,全球范围内患病率约为40/10 000~80/10 000[1]。大约40%~50%SCI患者在损伤1年内产生神经病理性疼痛[2]。目前,临床上对神经病理性疼痛治疗主要通过调节神经元上钠和钙通道,以及N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)和γ-氨基丁酸(γ-aminobutyric acid,GABA)受体,但治疗效果有限[3]。近年来研究表明,神经病理性疼痛产生不仅涉及神经元,也与免疫系统和神经胶质细胞,如星形胶质细胞和小胶质细胞有关[4]。SCI后激活的小胶质细胞和星形胶质细胞,均可释放趋化因子和细胞因子,导致脊髓炎症反应。越来越多证据表明,抑制脊髓炎症反应可缓解SCI诱导的神经病理性疼痛[5]。
阿司匹林诱生型脂氧素A4(aspirin-triggered lipoxin A4,ATL)是二十烷类家族中一类氨基酸代谢产物,具有典型的三羟基、四共轭双键结构。ATL是机体内产生的抗炎脂类介质,参与抑制机体内各种炎症[6]。有研究表明,大鼠鞘内注射ATL,主要通过与星形胶质细胞上ALX受体结合,抑制炎症细胞因子表达,从而缓解慢性坐骨神经压迫损伤(chronic constriction injury,CCI)诱导的神经病理性疼痛[7]。然而,ATL在小鼠SCI模型中的作用仍未见相关报道。因而,本研究目的是探讨ATL在小鼠脊髓撞击损伤后的抗炎镇痛作用。
1 材料与方法
1.1 实验动物及分组
雄性FVB小鼠(25~30 g)购于山西医科大学实验动物中心。室温下自由饮食和饮水。将FVB小鼠随机分成:Sham组、(SCI+ATL)组和(SCI+Vehicle)组,每组6只。
1.2 实验仪器和试剂
ATL(美国Sigma公司),γ-干扰素(interferon-γ,IFN-γ)(美国Sigma公司),酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、兔抗P-p38MAPK多克隆抗体(美国Sigma公司),DMEM/F12培养基(湖北省武汉博士德生物工程有限公司),脑立体定位仪(香港友诚生物科技有限公司),ALX siRNA及聚合酶链式反应引物(上海生工生物工程有限公司和上海英骏公司合成)。
1.3 方法
1.3.1 小鼠SCI模型复制首先将脑立体定位仪持物杆取下,以10 g砝码的重物打击杆代替,将砝码用线相连并将线上标明长度,来控制打击高度和重量。小鼠麻醉,剔除背部正中毛发,分离脊椎旁肌肉组织,暴露T9、T10和T11椎体,然后置于打击模型下,对脊髓进行打击,以损伤小鼠痉挛性摆尾及双下肢及躯体回缩扑动为造模成功的标志。最后伤口消毒,缝合伤口,每天腹腔注射2 u青霉素。Sham组只进行前期手术操作,不对其脊髓进行打击。
1.3.2 小鼠鞘内插管及给药1%戊巴比妥钠腹腔注射麻醉小鼠,颈后部剪毛、消毒,在两耳连线中央做纵向切口,暴露枕骨寰枕膜,然而从此处插入PE-10管,插入约6~7 cm,最终达到蛛网膜下池,然后固定PE-10管。(SCI+ATL)组和(SCI+Vehicle)组在SCI手术后4和24h鞘内分别注射10μl ATL(300pmol)或等量Vehicle(0.9%NaCl)。5μl ALX siRNA(2g/L)或scramble siRNA于SCI手术前24 h鞘内注射。
1.3.3 行为学观察SCI模型复制前及复制后1、2、3、4和5周对小鼠进行缩足阈值测定。主要采用von Frey细丝法,von Frey细丝(1.0~15 g)垂直刺激大鼠后足中央处,持续5~10 s,出现明显缩足、舔足及抬足行为为阳性反应。
1.3.4 实时荧光定量聚合酶链式反应(polymerase chain reaction,qRT-PCR)通过RNA提取试剂盒提取不同组小鼠脊髓总RNA,然后进行逆转录反应,使用基因特异性引物进行qRT-PCR扩增,引物序列如表所示。通过软件分析计算基因Ct,其中GAPDH作为内参;按照文献方法计算相对基因表达=2-△Ct sample-△Ctcontrol[8]。见表1。
1.3.5 小胶质细胞培养1~2 d的新生FVB乳鼠处死后,取出脑组织,放入DMEM/F12培养基中剪碎,0.25%的胰酶消化消化,后离心5 min,用完全培养基培养细胞培养至第7~9天时可见胶质细胞分层,上层为小胶质细胞,然后分离纯化小胶质细胞。采用不同浓度IFN-γ或ATL刺激小胶质细胞。
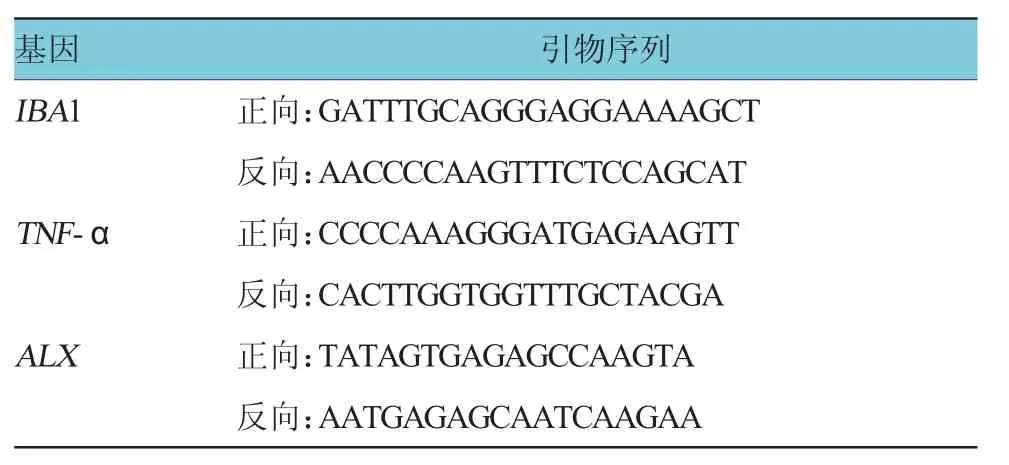
表1 相关基因引物序列
1.3.6 Western blot提取原代培养的小胶质细胞蛋白,取30 g进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE),然后转至聚偏氟乙稀(polyvinylidene fluoride,PVDF)膜上。经5%牛奶孵育1 h后,并用磷酸盐缓冲液-T(phosphate buffered saline,PBS-T)洗膜3次,每次10 min。用兔抗P-p38 MAPK多克隆抗体(1∶2 000)和鼠抗β-actin多克隆抗体(1∶2 000)4℃孵育3 h,PBS-T洗3次,每次10 min。用PBS-T稀释山羊抗兔和山羊抗鼠的二抗(1∶25 000),室温孵育1 h。PBS-T洗3次,每次5 min。利用化学发光扫描系统检测相关蛋白表达并摄片,采用Quantity one图像分析软件对吸光度积值进行分析。
1.3.7 ELISA培养的小胶质细胞进行不同的处理后,对细胞进行裂解,通过ELISA试剂盒规定的步骤检测不是处理后小胶质细胞肿瘤坏死因子-α(tumor necrosis factor,TNF-α)浓度。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,多组间均值比较用重复测量设计的方差分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ATL对小鼠SC I的镇痛作用
小鼠SCI损伤后可导致两侧后脚持续的机械性痛觉增敏。与Sham小鼠比较,小鼠SCI后同侧(2~5周)(F=12.42,P=0.004)和对侧(1~5周)(F=13.83,P=0.003)后脚缩足反应阈值(paw with drawal threshold,PWT)降低,而鞘内注射ATL后可改善机械性痛觉增敏(见表2和图1)。
表2 各组小鼠SC I后不同时间同侧及对侧后脚PW T比较(n=6,±s)
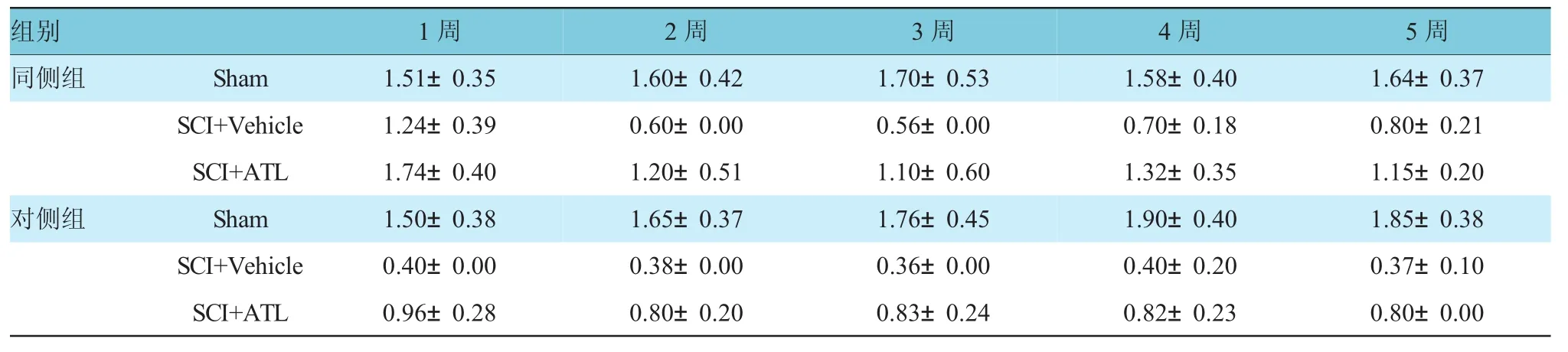
表2 各组小鼠SC I后不同时间同侧及对侧后脚PW T比较(n=6,±s)
组别1周2周3周4周5周同侧组对侧组S h a m S C I + V e h i c l e S C I + A T L S h a m S C I + V e h i c l e S C I + A T L1 . 5 1 ± 0 . 3 51 . 6 4 ± 0 . 3 7 1 . 2 4 ± 0 . 3 9 0 . 6 0 ± 0 . 0 0 0 . 5 6 ± 0 . 0 0 0 . 7 0 ± 0 . 1 8 0 . 8 0 ± 0 . 2 1 1 . 7 4 ± 0 . 4 0 1 . 2 0 ± 0 . 5 1 1 . 1 0 ± 0 . 6 0 1 . 3 2 ± 0 . 3 5 1 . 1 5 ± 0 . 2 01 . 6 0 ± 0 . 4 21 . 7 0 ± 0 . 5 31 . 5 8 ± 0 . 4 01 . 5 0 ± 0 . 3 81 . 8 5 ± 0 . 3 8 0 . 4 0 ± 0 . 0 0 0 . 3 8 ± 0 . 0 0 0 . 3 6 ± 0 . 0 0 0 . 4 0 ± 0 . 2 0 0 . 3 7 ± 0 . 1 0 0 . 9 6 ± 0 . 2 8 0 . 8 0 ± 0 . 2 0 0 . 8 3 ± 0 . 2 4 0 . 8 2 ± 0 . 2 3 0 . 8 0 ± 0 . 0 01 . 6 5 ± 0 . 3 71 . 7 6 ± 0 . 4 51 . 9 0 ± 0 . 4 0
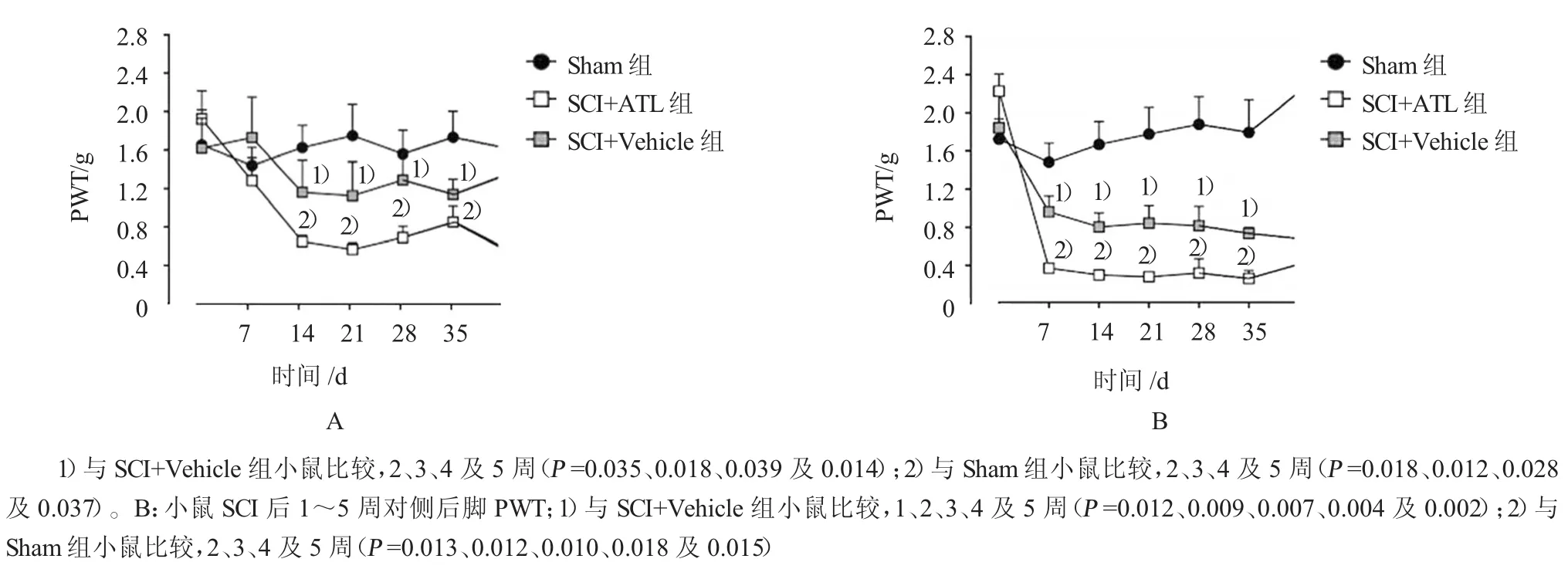
图1 ATL缓解小鼠SC I后机械痛觉增敏
2.2 ATL通过ALX受体对镇痛作用的影响
与scramble siRNA比较,ALX siRNA降低SCI后7 d脊髓中ALX mRNA水平。鞘内注射ALX siRNA不改变小鼠SCI后7 d同侧后脚的机械敏感性(F=2.745,P=0.159),但是降低小鼠SCI后7 d对侧后脚的PWT(F=10.872,P=0.009),这与图1中鞘内注射ATL在SCI后7 d的镇痛作用一致。见图2。
2.3 ATL对SC I诱导小胶质细胞标志物和促炎症因子表达的影响
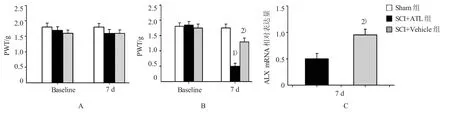
图2 干扰ALX受体影响ATL的镇痛作用
SCI小鼠鞘内注射ATL或Vehicle后,脊髓中ALX mRNA水平表达相似(见图3A)。各组间IBA-1mRNA水平差异有统计学意义(F=14.737,P=0.002),与Sham小鼠比较,SCI小鼠IBA-1mRNA水平增高(P=0.009);而鞘内注射ATL可降低IBA-1mRNA表达(P=0.013)(见图3B)。但是ATL对星形胶质细胞标志物GFAP影响差异无统计学意义。同时各组间TNF-α mRNA水平差异有统计学意义(F=12.157,P=0.006),与Sham小鼠比较,SCI小鼠TNF-α mRNA水平增高(P= 0.006);而鞘内注射ATL可降低TNF-α mRNA表达(P=0.007)(见图3C)。
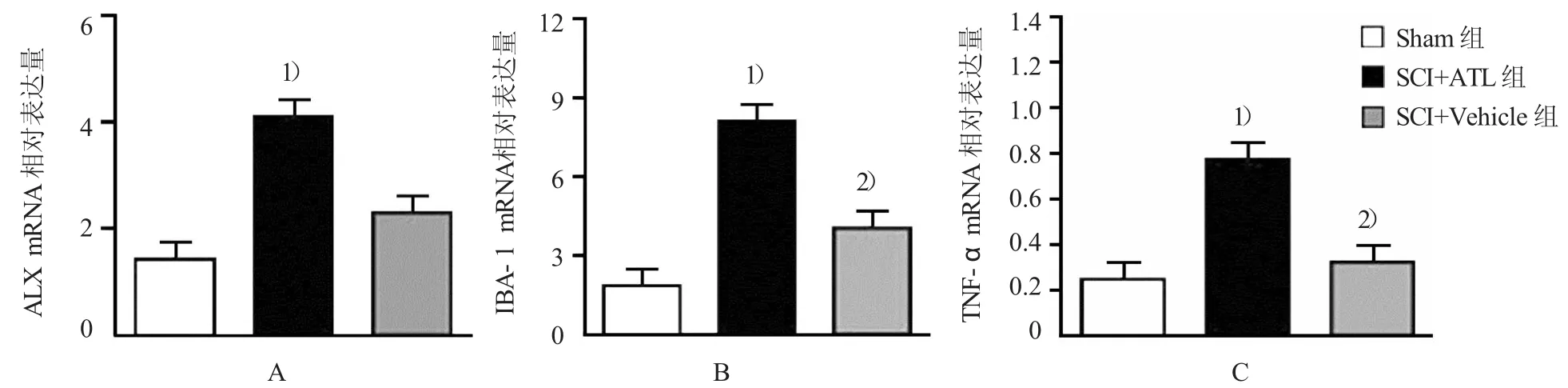
图3 ATL降低SC I 7 d后小胶质细胞标志物和促炎症因子表达
2.4 ATL抑制原代小胶质细胞TN F-α释放
各组间P-p38MAPK表达差异有统计学意义(F=15.745,P=0.001),小胶质细胞受到IFN-γ刺激后,P-p38MAPK表达增加(P=0.032);而ALT可降低P-p38MAPK表达(P=0.015)(见图4A)。与此同时,不同组间TNF-α释放差异有统计学意义(F=16.062,P=0.001),IFN-γ可诱导小胶质细胞释放TNF-α(P=0.001);而ALT可降低TNF-α释放(P=0.003)(见图4B)。

图4 ATL抑制原代小胶质细胞激活
3 讨论
SCI可引起炎症和慢性疼痛。因而控制SCI诱导的炎症反应可以改善神经损伤和神经病理性疼痛。然而,很少有药物被证明能够安全、有效治疗神经炎症和疼痛。本研究中,笔者评估ATL对小鼠SCI中神经炎症和神经病理痛的影响。研究表明,ATL能有效抑制SCI后小胶质细胞激活及神经病理性疼痛。
目前对SCI引起的疼痛,主要采用抗惊厥药和抗抑郁药治疗,但效果不佳,同时伴有严重的副作用[9]。本研究表明,SCI前鞘内注射ATL能够缓解SCI引起的神经病理性疼痛。ATL是机体内产生的抗炎脂类介质,主要来源于脂肪酸代谢,在各种炎症及神经病理性疼痛动物模型中具有较强的镇痛效果[10]。ATL主要作用于G蛋白偶联的ALX受体,但也可以结合其他受体,包括芳基烃受体、白三烯受体和CB1大麻素受体等[11]。本研究发现,通过特定siRNA干扰ALX受体ATL是机体内产生的抗炎脂类介质后可抑制ATL的镇痛作用,表明ALX受体是ATL是机体内产生的抗炎脂类介质SCI动物中脂质介质的作用靶点。笔者的研究结果还表明,ATL也可减少SCI引起小胶质细胞激活及促炎症细胞因子TNF-α释放。而TNF-α在疼痛中发挥关键作用,所以ATL镇痛作用可能与抗炎作用有关[12]。TNF-α也是一个关键促炎疼痛介质,因为它可以影响涉及疼痛传导的多个机制。同时TNF-α也能减少对脊髓突触传递的抑制,刺激释放其他的促炎症细胞因子,并诱导免疫和神经胶质细胞增殖,从而增强神经炎症和疼痛传导[13]。笔者也观察到,ATL可降低SCI诱导小鼠脊髓小胶质细胞标记物IBA-1表达;同时也抑制原代小胶质细胞受到IFN-γ刺激后p38的磷酸化及TNF-α释放。在出血动物模型中已经证实,外源性ATL可抑制小胶质细胞p38的磷酸化[14]。以往研究表明,脊髓中注射米诺环素,一种广泛使用的小胶质细胞抑制剂,可抑制SCI后脊髓背角神经元和疼痛敏感性[15],这与本研究中另一种小胶质细胞抑制剂ATL的作用是相似的。
总之,ATL可以改变小鼠SCI后脊髓小胶质细胞促炎症反应,更重要的是,可以有效持久缓解机械性痛觉增敏。为下一步观察ATL在SCI后神经炎症和神经病理性疼痛中的作用打下基础。
[1]BIERINGSØRENSEN F,BICKENBACH J E,MASRY W S E,et al.International perspectives of spinal cord injury(IPSCI)report[J]. Spinal Cord,2011,49(6):679-683.
[2]KRUSZEWSKI S P,SHANNE J A.Pregabalin in central neuropathic pain associated with spinal cord injury:a placebo-controlled trial[J].Neurology,2007,68(68):2159-2160.
[3]DWORKIN R H,O'CONNOR A B,AUDETTE J,et al.Recommendations for the pharmacological management of neuropathic pain:An overview and literature update[J].Mayo Clinic Proceedings Mayo Clinic,2010,85(3 Suppl):S3-S14.
[4]JI R R,XU Z Z,GAO Y J.Emerging targets in neuroinflammation-drivenchronicpain[J].NatureReviewsDrug Discovery, 2014,13(7):533-548.
[5]JIANG B C,CAO D L,ZHANG X,et al.CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5[J].Journal of Clinical Investigation,2016,126(2):745-761.
[6]胡珊,王志福,田瑜,等.脂氧素的抗炎镇痛与神经保护作用研究进展[J].中国细胞生物学学报,2014(12):1601-1608.
[7]WANG Z F,LI Q,LIU S B,et al.Aspirin-triggered Lipoxin A4 attenuatesmechanicalallodyniainassociationwithinhibiting spinalJAK2/STAT3signaling inneuropathic paininrats[J]. Neuroscience,2014,273:65-78.
[8]ROGAEV E I.Small RNAs in human brain development and disorders[J].Biochemistry(Mosc),2005,70(12):1404-1407.
[9]MEHTA S,MCINTYRE A,JANZEN S,et al.A systematic review of pharmacological treatments of pain after spinal cord injury:An update[J].Archives of Physical Medicine&Rehabilitation,2010,91(5):816-831.
[10]XU Z Z,LIU X J,BERTA T,et al.Neuroprotectin/protectin D1 protects against neuropathic pain in mice after nerve trauma[J]. Annals of Neurology,2013,74(3):490-495.
[11]NAN C,ARITA M,SERHAN C N.Anti-inflammatory circuitry:lipoxin,aspirin-triggered lipoxins and their receptor ALX[J]. Prostaglandins Leukotrienes&Essential Fatty Acids,2005,73(3/4):163-177.
[12]ERAN G,GILLY W,YEHUDA S,et al.Chronic blockade of interleukin-1(IL-1)prevents and attenuates neuropathic pain behaviorandspontaneousectopicneuronalactivity following nerve injury[J].European Journal of Pain,2011,15(3):242-248.
[13]GRUBERSCHOFFNEGGER D,DRDLASCHUTTING R,HÖNIGS PERGERC,etal.Inductionofthermalhyperalgesiaand synaptic long-term potentiation in the spinal cord lamina I by TNF-α and IL-1β is mediated by glial cells[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,2013,33(15):6540-6551.
[14]GUO Z,HU Q,XU L,et al.Lipoxin A4 reduces inflammation through formyl peptide receptor 2/p38 MAPK signaling pathway in subarachnoid hemorrhage rats[J].Stroke,2016,47(2):490-497.
[15]HAINS B C,WAXMAN S G.Activated microglia contribute to the maintenance of chronic pain after spinal cord injury[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience,2006,26(16):4308-4317.
Effect of ALT on neuropathic pain after spinal cord injury in mice
Yun-he Guo,Xiang Li,Wei-dong Mi
(Department of surgery,School of Medicine,Shanxi Datong University, Datong,Shanxi 037009,China)
ObjectiveTo evaluate the effects of aspirin-triggered lipoxin A4(ATL)on spinal neuroinflammation and neuropathic pain in mice model of spinal cord injury(SCI).MethodsModified Allen'hit model at T10was carried out in adult FVB mice.To test if ATL can reduce neuroinflammation and neuropathic pain, each mouse received two intrathecal injections of ATL(300 pmol)or vehicle at 4 and 24 h after SCI.Sensitivity to mechanical stimulation of the hind paws was evaluated by von Frey monofilaments,and the neuroinflammation was tested by measuring the mRNA expression levels of microglial markers and cytokines in the spinal cord samples after SCI.Also,microglia cultures prepared from mice cortical tissue were used to assess the direct effects of ATL on microglial activation and release of pro-inflammatory TNF-α.ResultsATL treatment caused significant reductions in the intensity of mechanical pain hypersensitivity and spinal expression levels of microglial markers and pro-inflammatory cytokines induced by SCI,when compared to the control group.Notably,the increased expressions of the microglial marker IBA-1 and pro-inflammatory cytokine TNF-α were affected by the ATL treatment mostly.ConclusionsOur results suggest that ATL can effectively modulate microglial activation and TNF-α release through ALX receptors,ultimately reduce neuropathic pain in mice after SCI.
aspirin-triggered lipoxin A4;spinal cord injury;neuropathic pain;mice
R441.1
A
10.3969/j.issn.1005-8982.2017.08.006
1005-8982(2017)08-0027-05
2016-12-12
