立足化学史,突破“酸、碱、盐在水溶液中的电离”教学难点
2017-05-24张蕊张宁许燕红
张蕊+张宁+许燕红
摘要:通过解读电离理论的发展史,挖掘“酸、碱、盐在水溶液中的电离”教学中的难点,探寻教学迷思,认为解决好酸、碱、盐在水溶液中电离的自发性问题和酸、碱、盐发生电离时能量的来源问题是突破本节课教学难点的关键。并在此基础上进行了教学设计。
关键词:电离理论;化学史;电解质;教学难点
文章编号:1005–6629(2017)4–0039–06 中图分类号:G633.8 文献标识码:B
普通高中化学课程标准指出,化学课程应结合探索物质及其变化的历史与化学科学发展的趋势,引导学生进一步学习化学的基本原理和基本方法,形成科学的世界观[1]。也就是说,立足化学史构建的化学课堂,重现了科学家探索科学奥秘的思维历程,有助于学生理解化学知识,掌握科学方法,提升学科素养。
1 追溯化学史,探寻教学迷思
1.1 电离理论的历史变革
19世纪中叶,道尔顿和阿伏伽德罗的原子——分子论打开了微观化学之门,使越来越多的化学家渴望探寻化学反应的本质,电离理论也呼之欲出。
电离理论的建立与电化学的发展息息相关。早在19世纪初期,尼科尔森和卡里斯尔已经成功完成了水的电解实验,法拉第等许多科学家也已经通过实验认识到酸、碱、盐溶液的导电作用。但当时的科学界普遍认为,电解质只有在电流的作用下才能够解离。正是由于科学家们无法正确区别原子和离子,也不能合理分析溶液导电的原理,使得电离理论在很长一段时间内无法被科学界所接受。
1882至1887年间,阿伦尼乌斯致力于研究电离理论。基于对酸、碱、盐稀溶液在渗透压、沸点、蒸气压方面出现偏差情况的分析和对这些溶液电导率的测定,阿伦尼乌斯创造性地提出了溶液的电离理论。他认为,酸、碱、盐在溶于水的过程中,自动地离解成为带有不同电荷的离子,电离与电流的作用无关。这一理论的出现,虽然遭受了各国科学家的反对,但也解释了很多当时无法解释的问题。随着阿伦尼乌斯电离理论的问世,不仅使希托夫的电解溶液导电时的离子迁移数和科尔劳施的离子导电的加合性得到了解释,而且也很好地解释了范霍夫观测到的渗透异常现象。因此,阿伦尼乌斯的电离理论得到了奥斯特瓦尔德和范霍夫的认可,在这两位科学家的推广下,1890年,电离理论终于得到科学界广泛认可。
1.2 电离理论的教学迷思
通过分析电离理论的争论,不难看出困扰科学家的问题有二:一是无法正确区分原子与离子,从而无法正确认识酸碱盐在水溶液中导电的原因;二是无法正确判断使电解质在水溶液中自发电离的能量的来源。
科学家们对于电离理论的争论与探索不仅体现了科学历史的发展规律,也揭示了中学化学课堂学生学习新理论的思维发展过程。
“酸、碱、盐在水溶液中的电离”主题出自高中化学必修1第二章“化学物质及其变化”第二节,笔者试图着眼于电离理论发展史,联系教学实际,从三个方面分析教学难点。
人教版化学教材对电解质进行了如下定义:在水溶液里或熔融状态下能够导电的化合物叫做电解质[2]。此定义只从导电性角度规定了电解质的属性,属于表层概念。在此概念中,没有指明电解质的本质,即自发电离出可以自由移动的离子。追溯化学史,法拉第等化学家即是通过电解质溶液的导电性直接得出“电离是电流作用的结果”这一错误结论的。在教学中,若教师未从本质上解释电解质溶液导电的原因,将会对学生正确获取电解质概念产生强大阻力。因此,使学生学会从微观角度理解电解质的本质属性是知识与技能维度的教学难点。
对比许多教案和教学实录,对于电解质概念的教学有两种策略。其一,通过例举盐酸、NaOH溶液、NaCl固体、石墨、蔗糖溶液、酒精溶液、K2SO4溶液、Cu等不同种类的物质,让学生判断其能否导电,从而从导电性角度引出电解质的表层概念;另一种方法则是先给出电解质的定义,强调定义中的关键词,再给出以上物质,让学生自主判断哪几种物质是电解质。这两种教学策略均未能较好地引导学生形成学习概念本质的一般方法。因此,使学生掌握形成概念的分析方法是过程与方法维度的教学难点。
学习“酸、碱、盐在水溶液中的电离”这一内容,就是透过电解质溶液可以导电的表层现象来认识电解质在水溶液中自动离解的实质。纵观历史,从格罗图斯到阿伦尼乌斯,科学家们的主要区别就在于是否能够透过现象看到物质的本质属性。因此,使学生树立透过现象看本质的唯物主义世界观是情感态度与价值观维度的教学难点。
纵观上述分析,学生无法理解电解质的本质属性,是因为没有正确理解电离的自发性以及电离过程中能量的来源。也正如此,学生无法获得通过分析核心问题形成概念的基本方法,無法树立透过现象看本质的唯物主义世界观。所以,解决好酸、碱、盐在水溶液中电离的自发性问题和酸、碱、盐发生电离时能量的来源问题是突破本节课教学难点的关键。
2 立足化学史,突破教学难点
任何科学理论的发展都是曲折向前的。从对电解质溶液导电的偏颇认识,到电离理论的初步提出,再到利用电离理论解释科学现象,然后通过他人的不断修正、补充,最后才得到完善的理论。也就是说,理论的建立其实是科学家反复实验、突破思维障碍的过程。在化学教学中,学生学习新概念也经过类似的历程。首先,在实验现象中获得感性认识;而后,通过理性分析修正感性认识中的错误,探究概念本质属性;再次,尝试迁移应用新概念,最终完成新概念的学习。
在“酸、碱、盐在水溶液中的电离”一节中,学生需要突破的思维障碍,即教师突破教学难点需要解决的问题有以下两个。一是酸、碱、盐在水溶液中电离的自发性。二是酸、碱、盐发生电离时能量的来源。
2.1 探究电离的自发性——理解电离概念的本质
在九年级化学下册第十单元“酸和碱”中,学生已经知道酸溶液中都含有氢离子,碱溶液中都含有氢氧根离子。“酸、碱、盐在水溶液中的电离”这节课是在学生已有经验基础上展开的。在以往的教学中,教师是通过电解质溶液导电性实验来引入电解质的概念,而对于电解质概念本质的解读,却缺乏事实佐证,因此学生常常在书写电离方程式时加上“通电”条件。
在本节教学中,教师可以借用初中的实验(稀强酸与活泼金属反应)加深学生的感性认识。再由“不同的酸溶液都含有氢离子,所以,酸有一些相似的性质[3]”为切入点进行提问:稀强酸溶液中的氢离子来自哪里?学生思考并猜测:可能来自酸,也可能来自水。此时,我们引入化学史中关于溶液中离子来源的内容:在英国化学家尼科尔森和卡里斯尔完成电解水实验后,科学家们推测水溶液中是存在离子的。格罗特斯和法拉第将水溶液中离子的来源归结于电流的作用。而拉乌尔由“盐溶液的凝固点下降值比相同摩尔浓度的非电解质溶液高”这一实验事实提出“盐分子解离不需要电流作用”,但这并未撼动法拉第的权威。真正向旧观念提出挑战的是阿伦尼乌斯,他在完成了大量的实验后,写了“电解质的导电性研究”一文,提出电解质在水溶液中自发解离为正负离子,并用电离理论很好地解释了沸点升高和凝固点下降的实验现象。在奥斯特瓦尔德和范霍夫的支持和帮助下,阿伦尼乌斯终于结束了电离理论的争端,并在1903年因提出电离学说而荣获诺贝尔化学奖,成为全世界第三位获得诺贝尔奖的化学家。
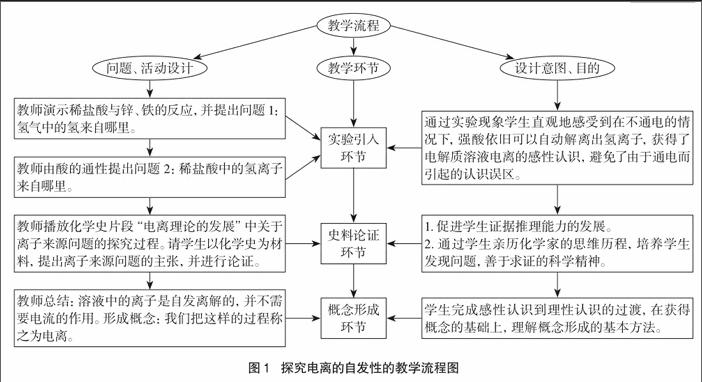
本环节教学流程如图1所示。
在此过程中,通过实验现象学生直观地感受到在不通电的情况下,强酸依旧可以自动解离出氢离子,获得了电解质溶液电离的感性认识,避免了由于通电而引起的认识误区。同时也可以类推出,碱、盐在水溶液中也可以自发电离出自由移动的离子。然后通过解读化学史,经过理性分析修正感性认识中的错误,获得概念本质属性。在此基础上引导学生思考:使酸或水解离出氢离子的能量来自哪里,进入第二个障碍点的学习。
2.2 探究电离的能量来源——理解电解质的两重属性,形成概念的分析方法
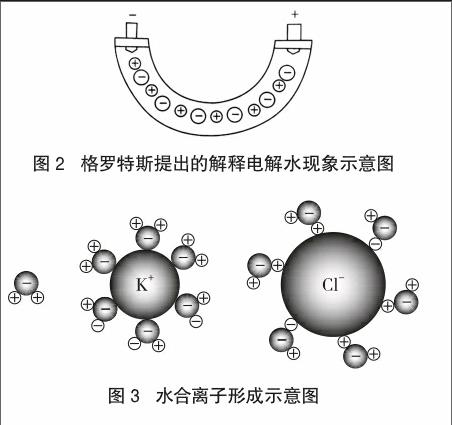
认识酸、碱、盐在水溶液中电离时能量的来源是解读电解质概念本质的关键。在学生猜测酸溶液中的氢离子来自酸分子或水分子时,教师可以先展示科学家们在创建电离学说时所构建的电离理论相关图示(图2 [4]、图3 [5]、图4 [6]),让学生在脑海中形成初步印象,再通过教师构建的HCl分子电离的微观示意图(图5)和NaCl在水中的电离示意图(图6 [7]),分析不同物质在水溶液中电离的能量来源。


1个氯化氢分子是由1个氢原子和1个氯原子构成的。将氯化氢气体通入水中,水分子与氢原子、氯原子之间的作用力比氢原子与氯原子之间作用力更强,使得氢原子与氯原子分离,氯原子夺走了氢原子最外层的一个电子,形成能够自由移动的水合氯离子与水合氢离子。氯化氢在水中发生了电离。氯化氢在水溶液中存在可以自由移动的离子,这也是氯化氢水溶液可以导电的根本原因。
氯化氢水溶液中有很小一部分氢离子来源于水。在水中,也存在水分子对氢原子和氢氧原子团的作用,形成自由移动的水合氢离子和氢氧根离子,所以水也发生了电离,但电离的程度很小。
类似氯化钠那样的物质,又是什么能量使它在水溶液中电离的呢?如图6所示,在溶于水前,氯离子与钠离子在静电引力的作用下有序地紧密排列,将氯化钠固体加入水中,水分子强烈吸引着氯离子和钠离子,克服了氯离子和钠离子之间存在的静电引力,形成自由移动的水合氯离子和水合钠离子。氯化钠在水中发生了电离。氯化钠溶液导电的根本原因即存在有自由移动的离子。
那么,在熔融的氯化钠中,又是什么能量使之电离的呢?在加热至熔融状态过程中,加热所提供的能量使钠离子和氯离子克服了相互的静电作用,变成了可以自由移动的钠离子和氯离子,熔融状态下的氯化钠发生了电离。
本环节教学流程如图7所示。
通过以上对酸碱盐在水溶液中电离能量来源的分析,使学生掌握电解质在水溶液或熔融状态下能导电的原因,落实了对电解质概念本质的认识;再以课上练习与课后习题作为工具,使学生应用概念解决问题,完成概念的迁移应用。
这样一来,在电解质概念的教学过程中,不仅突破了知识维度的教学难点,还突破了方法维度的教学难点,使学生掌握了形成概念的方法:观察现象,形成表象概念;理性分析,获得概念本质;迁移应用,掌握概念内涵。
2.3 回顾化学发展历程——提升学生学科素养
对于学生而言,化学不仅仅是精彩纷呈的实验现象、高深奧妙的科学原理,还有发人深省的科学献身精神。因此,将化学史素材引入课堂,是提升学生学科素养的不二法宝。
在电离理论的发展过程中,阿伦尼乌斯敢于直面著名科学家们的质疑与挑战,捍卫真理的精神令人动容;奥斯特瓦尔德、范霍夫为传播真理创办《物理化学杂志》的精神也令人敬佩。在中学化学课堂中,教师应培养学生发现问题,敢于求真,善于求证,不随波逐流,盲目跟从的科学精神。而科学精神的养成比知识技能的获得更需要智慧和耐心,化学史的引入恰是当下化学课堂的良好补给。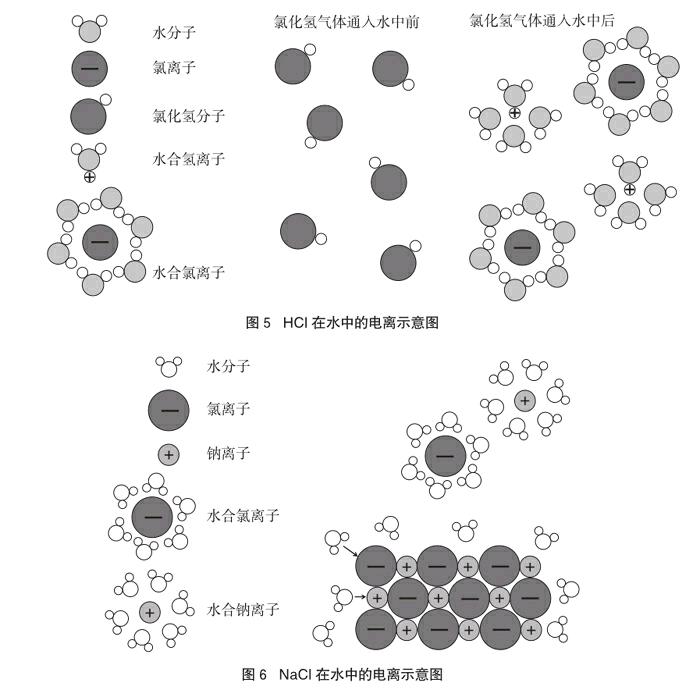
除了培养科学精神,化学史还有助于引导学生用发展的眼光看待事物和人,辩证地看待化学理论发展的阶段性和相对性。因为任何知识都是在特定时期、特定情境下才成立的,没有绝对的正确与错误。人类信服科学理论,是因为实践证实了这些理论的正确性。但是科学理论的发展具有一定的阶段性,它还需要后人的修正与补充。例如,在电离理论形成以前,科学家们将“只有外加电解电压时电解质才会分解成正负离子[7]”当做真理,电离理论则被视为无稽之谈。在电离理论被实践所检验后,许多科学家也还在不断研究电离理论,并对其进行修正和补充。可见,即使教科书中的知识经过了重重检验,但仍有需要探索的空间,学生不应成为教科书的奴隶,而应成为教科书的主人。
