Aurora-B靶向抑制剂AZD1152抑制宫颈癌Hela细胞增殖和诱导细胞凋亡的研究
2017-05-24
Aurora-B靶向抑制剂AZD1152抑制宫颈癌Hela细胞增殖和诱导细胞凋亡的研究
胡梦川
目的探讨Aurora-B靶向抑制剂AZD1152抑制宫颈癌Hela细胞增殖和并诱导细胞凋亡的作用。方法将细胞按照AZD1152浓度分为6组,分别为:正常对照组,20μmmol/L组,50 μmmol/L组,100 μmmol/L组,200 μmmol/L组,500 μmmol/L组。采用MTT法检测各组细胞增殖,酶联免疫分析仪检测各组OD值;采用TUNEL法检测各组细胞凋亡,倒置显微镜观察细胞凋亡,并计算凋亡率。结果MTT法检测细胞增殖,实验组和对照组比较,相同培养时间不同抑制剂浓度,OD值随着AZD1152浓度增加而降低,与对照组比较,差异有统计学意义(P<0.05);相同抑制剂浓度,不同培养时间,OD值随着培养时间延长而降低,与对照组比较,差异有统计学意义(P<0.05)。TUNEL法检测细胞凋亡,实验组和对照组比较,相同培养时间不同抑制剂浓度,随着AZD1152浓度增加,细胞凋亡率增加,与对照组比较,差异有统计学意义(P<0.05);相同抑制剂浓度,不同培养时间,随着培养时间延长,细胞凋亡率增加,与对照组比较,差异有统计学意义(P<0.05)。结论Aurora-B靶向性抑制剂AZD1152可以显著抑制宫颈癌Hela细胞增殖,同时显著促进宫颈癌Hela细胞凋亡。
Aurora激酶;AZD1152;宫颈癌;增殖;细胞凋亡
[Keywods]Aurora kinase; AZD1152; cervical cancer; proliferation; apoptosis
宫颈癌是女性常见疾病,是严重影响女性健康的恶性肿瘤之一[1]。对于晚期宫颈癌患者使用单一姑息手术治疗存在一定局限性,目前均采用药物化疗联合放疗的办法,尤其是分子靶向治疗越来越受到重视,所以寻找并选择适合、敏感的药物治疗靶点成为近年该领域的研究热点[2]。近年的研究发现,Aurora激酶与人类肿瘤关系密切,其中Aurora-B参与染色体调节、分离,在纺细胞增殖方面发挥重要作用,其在细胞增殖和分裂中起到了重要作用[3]。本研究分析了Aurora-B靶向抑制剂AZD1152抑制宫颈癌Hela细胞增殖并诱导细胞凋亡的作用,以探讨Aurora激酶与宫颈癌Hela细胞增殖和凋亡的关系。
1 材料和方法
1.1 材料
Hela细胞株由中国科学院上海细胞库提供。RPMI1640培养液(美国Gibco公司);小牛血清(美国Gibco公司);胰蛋白酶细胞消化液(武汉百浩天公司),细胞培养用青霉素,链霉素(江苏碧云天公司);MTT试剂盒(美国sigma公司);ELx800酶联免疫分析仪(美国biotek公司);TUNEL细胞凋亡试剂盒(瑞士罗氏公司)。AZD1152(美国Sigma公司);5% CO2饱和湿度细胞培养箱(日本三洋公司)。
1.2 方法
1.2.1 细胞培养和试剂配置 Hela细胞常规培养于RMPI1640培养液中,内含小牛血清100 ml/L,青霉素、链霉素105U/L,置于37 ℃,饱和湿度细胞培养箱中,每2天换液、传代,取对数生长期的细胞进行实验。AZD1152使用二甲基亚砜溶解,稀释成10 mmol/L的储存液备用。
1.2.2 MTT法检测细胞增殖 将培养细胞调整计数为3×107/L,接种于96孔无菌细胞培养板中,每孔量为100 μl,每组设6个孔,边缘孔用无菌PBS液填充,于细胞培养箱中孵育12小时备用。根据预实验的结果,将储存液稀释成为6组,20 μmmol/L组、50 μmmol/L组、100 μmmol/L组、200 μmmol/L组、500 μmmol/L组和正常对照组,加入培养板中,培养时间分别为24 h、48 h、72 h。待各组孵育后,倒置显微镜下观察细胞培养情况。加入100 μl MTT染色液,继续培养4 h。弃去上清,加入150 μl二甲基亚砜,水平震荡10 min,待溶液中的紫色结晶全部溶解后,置于酶联免疫分析仪上检测,使用570 nm滤光片检测,记录每组OD值进行比较,OD值越大表明细胞增殖越显著。
1.2.3 TUNEL法检测细胞凋亡 各组细胞完成培养后,胰蛋白酶消化,吹打成细胞悬液,离心,用无菌PBS洗涤2次后,将细胞均匀的涂于载玻片上,干燥后使用多聚甲醛固定,使用TUNEL原位检测试剂盒检测细胞凋亡,按照试剂盒说明书操作。使用DAB染色,苏木素复染,在倒置显微镜下观察,每个玻片观察5个视野,每个视野分别计数凋亡细胞数和细胞总数,计算细胞凋亡率。凋亡率=凋亡细胞数/细胞总数×100%。
1.3 统计学方法
采用SPSS 13.0统计软件进行统计分析,计数资料采用率或者百分比表示,采用χ2检验;计量资料以(均数±标准差)表示,组间数据采用one-way ANOVA进行统计学分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 MTT法检测Hela细胞增殖
倒置显微镜下观察,Hela细胞贴壁生长,大部分呈短梭形,部分呈不规则形。各组细胞经过OD值检测,实验组和对照组比较,相同培养时间不同抑制剂浓度,OD值随着AZD1152浓度增加而降低,与对照组比较,差异有统计学意义(P<0.05);相同抑制剂浓度,不同培养时间,OD值随着培养时间延长而降低,与对照组比较,差异有统计学意义(P< 0.05)。见表1。
2.2 TUNEL法检测细胞凋亡
细胞核染成深褐色为阳性凋亡细胞,阴性细胞核染成淡蓝色,各组细胞凋亡阳性率,见表2。
3 讨论
宫颈癌是妇科最常见的恶性肿瘤,好发年龄在30 ~ 50岁。目前治疗多综合考虑制定个性化治疗方案,一般采用手术结合放疗、化疗的综合治疗方案。全身情况不适合手术患者或者不愿接受手术治疗的患者,采用放疗方案[4]。而对于晚期或者复发的患者,近年来多采用静脉或动脉灌注化疗,以缩小肿瘤病灶及控制亚临床转移,也用于放疗增敏[5-6]。目前的化疗多采用BVP方案(博来霉素、长春新碱与顺铂),BP方案(博来霉素、顺铂)等[7],对于晚期肿瘤患者,副作用较大,有时难以耐受。所以,寻找新的药物作用靶点,开发副作用较少的药物是这一领域的新方向。
Aurora激酶是一组调控细胞有丝分裂的丝/苏氨酸激酶,在中心体复制、两极纺锤体的形成、染色体的重排和染色体检查点的监测等重要的有丝分裂事件中发挥重要作用。目前已经发现Aurora激酶有3个成员,Aurora-A、Aurora-B和Aurora-C,其中Aurora-B在有丝分裂早期位于染色体的着丝粒区域,分裂后期则从着丝粒移动到微管。近年研究发现,Aurora-B在许多肿瘤组织中高表达,如:乳腺癌、胰腺癌、卵巢癌等,其与抑制肿瘤细胞的凋亡密切相关[8-9]。Aurora-B已经作为目前潜在的肿瘤治疗靶点,并且已经成为研究者们的研究热点。
本研究选用宫颈癌细胞株Hela细胞为研究对象,使用Aurora-B特异性抑制剂AZD1152与细胞共培养,观察各实验组Hela细胞增殖和细胞凋亡的变化,并与对照组进行统计学分析,从而探讨Aurora激酶在宫颈癌Hela细胞增殖和凋亡过程中的作用。我们采用MTT法检测细胞增殖,实验组和对照组比较,相同培养时间不同抑制剂浓度,OD值随着AZD1152浓度增加而降低,与对照组比较,差异有统计学意义(P<0.05);相同抑制剂浓度,不同培养时间,OD值随着培养时间延长而降低,与对照组比较,差异有统计学意义(P<0.05)。采用TUNEL法检测细胞凋亡,实验组和对照组比较,相同培养时间不同抑制剂浓度,随着AZD1152浓度增加,细胞凋亡抑制率增加,与对照组比较,差异有统计学意义(P<0.05);相同抑制剂浓度,不同培养时间,随着培养时间延长,细胞凋亡抑制率增加,与对照组比较,差异有统计学意义(P<0.05)。
本实验结果提示:Aurora-B特异性抑制剂AZD1152可以显著抑制宫颈癌Hela细胞增殖,同时显著促进宫颈癌Hela细胞凋亡。进一步证实Aurora激酶家族中Aurora-B在宫颈癌细胞Hela细胞的增殖和凋亡中起到了重要作用。
表1 各组Hela细胞不同培养时间增殖力检测 ()
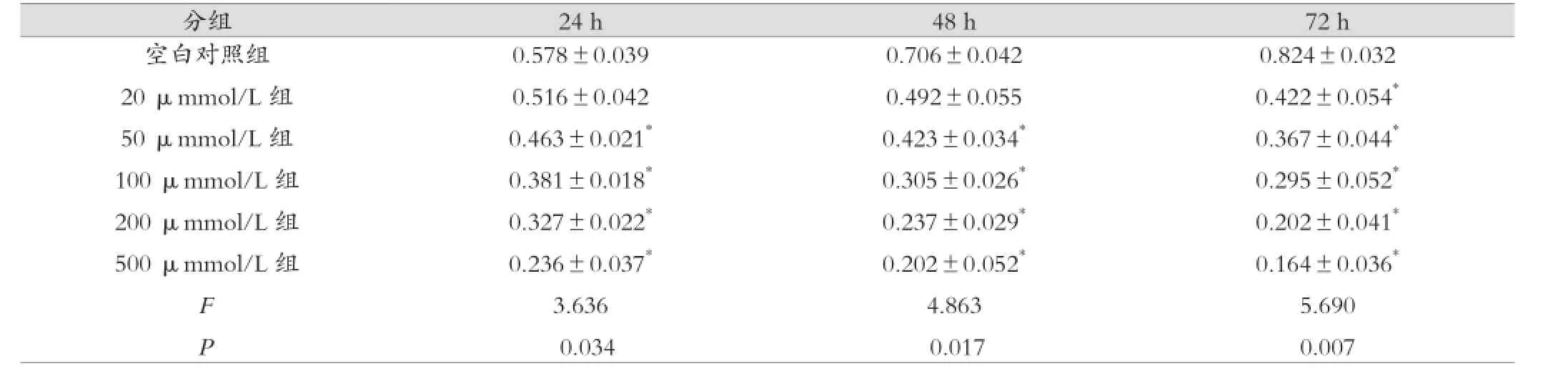
表1 各组Hela细胞不同培养时间增殖力检测 ()
注:采用one-way ANOVA检验,与对照组比较,*P<0.05
分组 24 h 48 h 72 h空白对照组20 μmmol/L组50 μmmol/L组100 μmmol/L组200 μmmol/L组500 μmmol/L组0.578±0.039 0.516±0.042 0.463±0.021*0.381±0.018*0.327±0.022*0.236±0.037*3.636 0.034F P0.706±0.042 0.492±0.055 0.423±0.034*0.305±0.026*0.237±0.029*0.202±0.052*4.863 0.017 0.824±0.032 0.422±0.054*0.367±0.044*0.295±0.052*0.202±0.041*0.164±0.036*5.690 0.007

表2 各组Hela细胞不同培养时间细胞凋亡百分比检测(%)
参考文献
[1] Kamangar F,Dores GM,Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world[J]. J Clin Oncol,2006,24(14):2137-2150.
[2] del Campo JM,Prat A,Antonio Gil-Moreno A,et al. Update on novel therapeutic agents for cervical cancer[J]. Gynecologic oncology,2008,110(3 Suppl 2):S72-S76.
[3] Ruchaud S,Carmena M,Earnshaw WC. Chromosomal passengers: conducting cell division[J]. Nat Rev Mol Cell Biol,2007,8(10):798-812.
[4] Cihoric N,Tsikkinis A,Tapia C,et al. Dose escalated intensity modulated radiotherapyin the treatment of cervical cancer[J]. Radiat Oncol,2015,10(1):240.
[5] Lapresa M,Parma G,Portuesi R,et al. Neoadjuvant chemotherapy in cervical cancer: an update[J]. Expert Rev Anticancer Ther,2015, 15(10):1171-1181.
[6] Morkhov KY,Nechushkina VM,Kuznetsov VV. Induction chemotherapy for locally advanced cervical cancer[J]. Vopr Onkol,2015,61(2):208-213.
[7] Tzioras S,Pavlidis N,Paraskevaidis E,et al. Effects of different chemotherapy regimens on survival for advanced cervical cancer: systematic review and meta-analysis[J]. Cancer Treat Rev,2007,33(1):24-38.
[8] Sadaie M,Dillon C,Narita M,et al. Cell-based screen for altered nuclear phenotypes reveals senescence progression in polyploid cells after Aurora kinase B inhibition[J]. Mol Biol Cell,2015,26(17):2971-2985.
[9] Shandilya J,Senapati P,Dhanasekaran K,et al. Phosphorylation of multifunctional nucleolar protein nucleophosmin (NPM1) by aurora kinase B is critical for mitotic progression[J]. FEBS Lett,2014,588(14):2198-2205.
Inhibition of Proliferation and Apoptosis of Cervical Cancer Hela Cells by Aurora-B Targeting Inhibitor AZD1152
HU Mengchuan Department of Obstetrics and Gynecology, Xili People's Hospital at Nanshan District, Shenzhen Guangdong 518055, China
ObjectiveTo explore the anti-proliferative and apoptosis induction effects of AZD1152, specific inhibitor of Aurora-B, on Hela cells.MethodsHela cells were divided into six groups through preliminary experiment based on the concentration of AZD1152, normal control group, 20 μmmol/L group, 50 μmmol/L group, 100 μmmol/L group, 200 μmmol/L group and 500 μmmol/L group. Proliferation of Hela cells was detected by 3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide (MTT). The optical density difference (OD) was detected by enzymelinked immunosorbent assay. The apoptosis of Hela cells was detected by TdT-mediated dUTP Nick-End Labeling (TUNEL), and calculating the percentage of apoptosis.ResultsProliferation of Hela cells was inhibited by AZD1152 (P< 0.05). And the effect of inhibition was enhanced with the concentration of AZD1152 and days of cell culture. There was signi fi cant difference between experimental group and control group (P< 0.05). Apoptosis of Hela cells was enhanced by AZD1152 (P< 0.05). And the effect of potentialization was changed with the concentration of AZD1152 and days of cell culture. There was significant difference between experimental group and control group (P< 0.05).ConclusionAZD1152, the speci fi c inhibitor of Aurora-B, can inhibit the cervical cancer Hela cells proliferation.
R738.1
A
1674-9316(2017)09-0121-04
10.3969/j.issn.1674-9316.2017.09.070
广东省深圳市南山区资助科技计划区属事业单位研发项目(2015055)
广东省深圳市南山区西丽人民医院妇产科,广东 深圳518055
