不同氮添加对入侵植物瘤突苍耳和本地近缘植物苍耳及两者杂交种的生长影响
2017-05-23荀挚峰白龙曲波许玉凤李光海詹忠浪石九曜
荀挚峰,白龙,曲波,许玉凤,李光海,詹忠浪,石九曜
(1.沈阳农业大学生物科学技术学院,辽宁 沈阳 110866;2.沈阳农业大学园艺学院,辽宁 沈阳 110866;3.辽宁省全球变化与生物入侵重点实验室,辽宁 沈阳 110866;4.辽宁双台河口湿地生态系统国家定位观测研究站,辽宁 盘锦 124000)
不同氮添加对入侵植物瘤突苍耳和本地近缘植物苍耳及两者杂交种的生长影响
荀挚峰1,2,3,白龙2,曲波1,3,4*,许玉凤1,3,李光海1,詹忠浪1,石九曜1
(1.沈阳农业大学生物科学技术学院,辽宁 沈阳 110866;2.沈阳农业大学园艺学院,辽宁 沈阳 110866;3.辽宁省全球变化与生物入侵重点实验室,辽宁 沈阳 110866;4.辽宁双台河口湿地生态系统国家定位观测研究站,辽宁 盘锦 124000)
土壤养分对外来植物入侵过程的影响是入侵生物学研究的一个热点,但土壤养分对入侵植物和本地植物杂交后代植株特性的影响鲜有报道。本研究采用盆栽实验,通过添加不同浓度的N,改变土壤养分,比较入侵植物瘤突苍耳和本地近缘植物苍耳及两者的杂交种(杂交瘤突苍耳和杂交苍耳)在植物形态、生物量及分配、植株生长和叶片光合特性等方面的差异,探讨这些差异与入侵性的关系。结果表明,氮添加显著提高了瘤突苍耳、苍耳和杂交种的茎粗、总叶面积、总生物量、根生物量、茎生物量、根生物量比和根冠比,显著降低了4种植株的叶根比;瘤突苍耳各指标随氮含量增加而变化明显,苍耳和杂交苍耳的茎生物量比和叶生物量比下降显著;瘤突苍耳的净同化速率在不同氮处理下均显著高于苍耳,但叶面积比均显著低于苍耳;杂交后代植株的相对生长速率、净同化速率和平均叶面积比在各氮处理间均高于各母本的后代植株,同时杂交瘤突苍耳植株的各生物量指标和生长指标均显著高于杂交苍耳植株。由此可见,1)当养分是限制条件时,入侵植物瘤突苍耳相对于本地植物苍耳将较多生物量分配到根系,这种分配策略反映入侵植物对低养分环境有较高的适应性;2)以瘤突苍耳为母本的杂交后代植株较以苍耳为母本的杂交后代植株具有较强生长能力和繁殖能力,可以进一步加强其入侵。
瘤突苍耳;氮处理;杂交;入侵
随着世界贸易的加快以及人类活动的频繁,外来物种入侵事件日益增多,并已成为全球性关注的焦点问题之一[1-5]。外来物种入侵不仅能影响被入侵地生态系统的结构和功能,还能引发严重的社会、经济和生态问题[6-7]。但外来物种并不一定都能成为恶性入侵物种,由于外来物种转化成为入侵物种需要经历引入、定居、建群、扩散和爆发等一系列复杂过程,最终发展成为恶性入侵物种的概率仅为0.1%[8-11]。外来物种转化为入侵物种主要取决于两个因素,一是物种的生物学特性,决定该物种是否具有入侵性;二是环境的可入侵性,决定该物种是否能入侵[12-14]。所以对外来物种自身的生物学特性和有利于其入侵的外界因素探究,已成为研究入侵种成功入侵机理的热点问题之一。
随着全球气候变暖和氮沉降升高,生态环境中的养分含量越来越高[15-16]。一些国内外学者通过比较入侵植物与同属土著种的生长状态和生活史特征发现,在高养分条件下,入侵植物比本地植物具有较高的相对生长速率、最大净光合速率、叶面积比、比叶面积、叶生物量比、生物量等,认为在较高的养分条件下有利于外来植物的入侵[17-21]。同时还有研究指出在富养条件下,外来植物有较高的繁殖能力,群落中处于优势地位,导致本地植物的多样性下降[22-23]。因此,探讨生境养分水平对外来入侵植物的影响,对揭示外来入侵植物的成功入侵有重要意义。
瘤突苍耳(Xanthiumstrumarium),别名意大利苍耳,一年生菊科植物,原产于北美洲,随进口农副产品或包装物携带传入我国,其果实产量高,对环境的适应能力强,尤其是在湿润地带能快速形成优势种群,在我国东北地区已成为危害较重的入侵植物之一,给农作物和生态环境带来严重危害,是一种重要的危险性植物,已被我国列入《中华人民共和国进境植物检疫性有害生物名录》[24-25]。本研究组通过3年野外观察和研究,在辽宁地区的河滩裸地、废弃耕地和耕作地附近,发现瘤突苍耳与本地同属近缘种植物苍耳(Xanthiumsibiricum)生境重叠,并可以进行互交且能繁殖后代。由于不同的环境因素和人为因素导致土壤中的养分产生较大差异,人为耕作地附近养分最高,水流冲刷的河滩裸地养分较低。本研究以3个生境中土壤实际有效氮含量为参照值,设置不同养分梯度进行盆栽试验比较瘤突苍耳和苍耳及互交后代在不同养分资源环境中的形态特征、生长特征、光合特征、生物量积累及生物量分配格局的变化差异,探讨瘤突苍耳及互交种对不同养分水平的生态适应策略,为进一步研究瘤突苍耳的入侵过程与防治提供参考。
1 材料与方法
1.1 研究地概况
实验地位于沈阳农业大学教学科研基地(N 41°50′, E 123°34′)内。该地区海拔59 m,气候属北温带大陆性季风气候,四季分明,雨热同季,年均气温8.1 ℃,年均降水量721.9 mm,年均蒸发量1600 mm,年无霜期150~170 d。整块实验地为长方形,面积约为360 m2,平坦、开阔,从而保证了盆栽实验环境条件的一致。
1.2 研究材料
瘤突苍耳和苍耳果实分别于2012年11月采自于辽宁省沈阳市东陵公园(E 123°35′,N 41°49′)附近废弃耕地、锦州市义县(E 121°22′,N 41°55′)耕地附近以及凌海市右卫满族镇小黄村(E 121°34′,N 41°04′)大凌河河岸沙地的自然成熟植株。果实采集后,置于通风避光处晾干,室温保存备用。
2013—2014年在沈阳农业大学教学科研基地进行自交种与杂交种试验获得自交果实与互交果实。自交组合2组:瘤突苍耳和苍耳自交。杂交组合2组:瘤突苍耳×苍耳(杂交瘤突苍耳)和苍耳×瘤突苍耳(杂交苍耳)。共4个处理,每处理80个花序。授粉花序分别严格套袋隔离。待花期过后去除杂交袋,分别采集果实,置通风避光处晾干,室温保存备用。
1.3 研究方法
根据瘤突苍耳和苍耳的3个重叠分布区实际土壤有效氮含量(河滩地10.85 mg/kg、废弃耕地52.43 mg/kg、耕作地84.36 mg/kg)设置3个氮梯度,分别为10 mg/kg 土(N0处理)、50 mg/kg 土(N50处理)、90 mg/kg 土(N90处理),进行盆栽试验,每组10 盆。为保证试验不受其他因素影响,统一栽培基质,施肥前的基质养分含量为:pH=7.60,有机质含量1.48 g/kg,全氮含量0.85 g/kg, 全磷含量0.23 g/kg,全钾含量11.8 g/kg,有效氮含量10.34 mg/kg,有效磷含量4.74 mg/kg,有效钾含量52.24 mg/kg,土壤养分水平较低。为确保成活率,每盆放3粒种子,肥料添加与瘤突苍耳和苍耳重叠分布区的常用化肥一致,化肥为掺混肥料(N∶P2O5∶K2O,28∶15∶12)。每个花盆下放一个接水的托盘,并定期把托盘中的水分倒回花盆中,以防止过量浇水时淋溶出土样养分,影响养分处理效果。植物生长期间定期浇水,保证其正常生长(采用滴管给水,保证各处理土壤含水量无显著差异)。
为确保成活率和出苗期一致,每盆种植3粒种子,各物种选取长势一致的进行定植。各物种呈正方形小区摆放,同一处理下入侵植物和本地植物及互交种相邻摆放,方便观察比较。花盆间距为50 cm,保证相邻行植株长大后互不遮挡并且通风良好。在7月现蕾期和8月开花期分别测定植物的形态、生物量积累和生物量分配、生长参数及光合参数。每次测定选取不同处理下的4种植株各10株。
1.4 指标测定
1.4.1 植株光合指标的测定 于2015年8月7日测定植株成熟叶片的最大净光合速率(maximum net photosynthetic rate,Pmax)和光合色素含量。使用Li-6400型便携式光合仪(Li-Cor, Lincoln, NE, USA)测定植物开花期时叶片饱和光下的最大光合速率,叶室光强设为1500 μmol/(m2·s)(预实验饱和光强的结果),参比室CO2浓度为380 μmol/mol,叶温控制在27 ℃,相对湿度为55%。测量前植物在饱和光下进行充分诱导30 min,数据稳定后再读数。叶片尽量选择向阳的、近期成熟的健康叶片,能反映植物的最大光合能力(植物开花期时植物叶片的光合能力较为稳定,能反映植物真实的光合能力)。用Lichtenthaler等[26]的方法测定植株开花期的叶绿素总含量、叶绿素a和叶绿素b含量。选取与测定光合作用相同位置或相同发育阶段的叶片。
1.4.2 植株形态指标、生物量指标和生长指标的测定 分别于2015年7月11日和2015年8月15日测定了植株的形态、生物量分配和生长参数。先用直尺(精确度1 mm)和卡尺(精确度1 mm)测定植株的株高和茎粗,然后收获植株,分成根、茎、叶三部分,用Li-3000C(Li-Cor, Lincoln, NE, USA)叶面积仪测定总叶面积后,再将称重部分在80 ℃烘48 h后称重。测定生理参数用掉的叶片也计算在叶面积、叶生物量和总生物量内。计算如下指标:总生物量(total biomass, 各部分器官重量之和);根生物量比(root mass fraction, RMF, 根干重/植株总重);叶生物量比(leaf mass fraction, LMF, 叶干重/植株总重);茎生物量比(stalk mass fraction, SMF, 茎干重/植株总干重);总叶面积(total leaf area, TLA, 叶面积之和);叶根比(leaf area to root mass ratio, LARMR, 总叶面积/总根重);根冠比(root mass/crown mass, R/C, 根生物量/地上部分生物量);叶面积比(leaf area ratio, LAR, 总叶面积/植株总重);叶面积指数(leaf area index, LAI, 总叶面积/冠面积);比叶面积(specific leaf area, SLA, 总叶面积/总叶干重);相对生长速率(relative growth rate, RGR);净同化速率(net assimilation rate, NAR);平均叶面积比(mean leaf area ratio, LARm)。

图1 不同氮处理下植株的形态特征比较Fig.1 Comparison of the morphological traits of plants grown under different nitrogen treatments 不同小写字母表示差异显著(P<0.05),下同。The different lowercase letters indicate significant differences (P<0.05), the same below.

1.5 统计分析方法
用单因素方差分析检验物种、养分处理及其互交作用对各性状本身的影响。不同养分水平之间,入侵植物和本地植物间的差异与相同养分水平下,入侵种和本地种性状本身的差异用Duncan法分析。采用SPSS13.0(SPSSInc.,Chicago,IL,USA)进行统计分析,用Excel进行绘图。
2 结果与分析
2.1 不同氮处理下瘤突苍耳和苍耳及互交杂交植株的形态特征比较
在各处理下,苍耳和杂交苍耳的株高与比叶面积显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05);杂交瘤突苍耳的株高在N50和N90处理下均显著高于瘤突苍耳(P<0.05);杂交瘤突苍耳和杂交苍耳的比叶面积随氮含量增加有上升趋势,而瘤突苍耳和苍耳有下降趋势。瘤突苍耳和杂交瘤突苍耳的茎粗与总叶面积在各处理下均显著高于苍耳和杂交苍耳(P<0.05);杂交瘤突苍耳的茎粗只在N0处理显著高于瘤突苍耳(P<0.05),苍耳的总叶面积高于杂交苍耳,但在各处理间均不显著(P>0.05);杂交苍耳的茎粗高于苍耳而总叶面积低于苍耳,二者差异不显著。4种植株的叶面积指数随氮含量的增加而差异不明显(P>0.05),仅在N0处理下有差异,表现为杂交苍耳的叶面积指数显著大于瘤突苍耳和杂交瘤突苍耳(P<0.05),苍耳、瘤突苍耳和杂交瘤突苍耳三者之间差异不显著(P>0.05)(图1)。
2.2 不同氮处理下瘤突苍耳和苍耳及杂交植株的生物量积累比较
在各处理下,瘤突苍耳和杂交瘤突苍耳的根生物量、茎生物量、叶生物量和总生物量均显著高于苍耳和杂交苍耳(P<0.05)。瘤突苍耳的各生物量在各处理下均高于杂交瘤突苍耳,在N50处理下差异显著(P<0.05)。而苍耳和杂交苍耳在各处理下的生物量差异不明显(P>0.05),仅在N50处理下,苍耳的叶生物量显著高于杂交苍耳(P<0.05)(图2)。
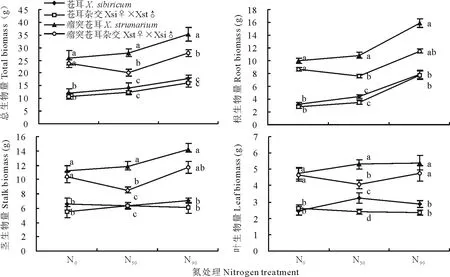
图2 不同氮处理下植株的生物量积累特征比较Fig.2 Comparison of traits of different nitrogen treatments plants on biomass accumulation
2.3 不同氮处理下瘤突苍耳和苍耳及杂交植株的生物量分配比较
瘤突苍耳和杂交瘤突苍耳的根生物量比、根冠比、叶根比和叶面积比在N0处理下与苍耳和杂交苍耳差异显著(P<0.05);苍耳和杂交苍耳的茎生物量比在N0处理下都高于瘤突苍耳和杂交瘤突苍耳;杂交苍耳的叶生物量比在N0处理下显著高于苍耳、瘤突苍耳和杂交瘤突苍耳(P<0.05),后3种植物无显著差异(P>0.05)。4种植株根生物量比的N50处理与N0处理的结果一致;杂交苍耳的茎生物量比在N50处理下显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05);苍耳的叶生物量比在N50处理下显著高于杂交苍耳、瘤突苍耳和杂交瘤突苍耳(P<0.05);瘤突苍耳的根冠比在N50处理下显著高于苍耳和杂交苍耳(P<0.05),与杂交瘤突苍耳差异不显著(P>0.05);苍耳的叶根比在N50处理下显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),与杂交苍耳差异不显著(P>0.05);苍耳与杂交苍耳的叶面积比在N50处理下显著高于瘤突苍耳(P<0.05);杂交瘤突苍耳与其他3种植株都无显著差异(P>0.05)。苍耳、杂交苍耳、瘤突苍耳和杂交瘤突苍耳的根生物量比、茎生物量比、叶生物量比及根冠比在N90处理下都无显著差异(P>0.05);苍耳的叶根比在N90处理下显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),杂交苍耳与杂交瘤突苍耳之间无显著差异(P>0.05),二者显著高于瘤突苍耳(P<0.05);苍耳的叶面积比在N90处理下显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),与杂交苍耳无显著差异(P>0.05);杂交苍耳显著高于瘤突苍耳(P<0.05),与杂交瘤突苍耳无显著差异(P>0.05);瘤突苍耳与杂交瘤突苍耳之间无显著差异(P>0.05)(图3)。
2.4 不同氮处理下瘤突苍耳和苍耳及杂交植株的生长特征比较
杂交瘤突苍耳与杂交苍耳的相对生长速率在N0和N90处理下均高于瘤突苍耳和苍耳,而在N50处理下4种植株无显著差异(P>0.05)。在净同化速率上,杂交瘤突苍耳与瘤突苍耳在N0处理下差异不显著(P>0.05),但杂交瘤突苍耳显著高于杂交苍耳和苍耳(P<0.05),而瘤突苍耳仅显著高于苍耳(P<0.05),与杂交苍耳之间没有显著差异(P>0.05),苍耳与杂交苍耳之间也无显著差异(P>0.05);在N90处理下,杂交瘤突苍耳的净同化速率显著高于苍耳(P<0.05);杂交苍耳与瘤突苍耳之间无显著差异(P>0.05),且二者与杂交瘤突苍耳、苍耳也无显著差异(P>0.05)。在各处理下平均叶面积比差异显著,在N0处理下,杂交苍耳的平均叶面积比显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),瘤突苍耳与杂交瘤突苍耳之间差异不显著(P>0.05),苍耳与其他3种植株比较也都不显著(P>0.05);在N50处理下,苍耳平均叶面积比显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),与杂交苍耳差异不明显(P>0.05);杂交苍耳也显著高于瘤突苍耳(P<0.05);杂交瘤突苍耳与杂交苍耳、瘤突苍耳差异都不显著(P>0.05);在N90处理下,杂交苍耳、瘤突苍耳和杂交瘤突苍耳的平均叶面积比差异显著(P<0.05),由高到低依次是杂交苍耳、杂交瘤突苍耳、瘤突苍耳;苍耳与杂交苍耳、杂交瘤突苍耳的差异不显著(P>0.05),显著高于瘤突苍耳(P<0.05)(图4)。

图3 不同氮处理下植株的生物量分配特征比较Fig.3 Comparison of traits of different nitrogen treatments plants on biomass allocation
2.5 不同氮处理下瘤突苍耳和苍耳及杂交植株的光合特征比较
瘤突苍耳和杂交瘤突苍耳的最大净光合速率在N0处理下均显著高于杂交苍耳(P<0.05),而在N50和N90处理下4种植株无明显差异(P>0.05)。杂交苍耳的叶绿素a在N0处理下显著高于杂交瘤突苍耳和苍耳(P<0.05),而4种植株的总叶绿素含量无明显差异(P>0.05);在N50处理下,苍耳和杂交苍耳的叶绿素a含量和叶绿素总含量显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),苍耳与杂交苍耳、瘤突苍耳与杂交瘤突苍耳两两之间无明显差异(P>0.05);在N90处理下,在叶绿素a、叶绿素b和叶绿素总含量上,苍耳显著高于其他3种植株(P<0.05),杂交瘤突苍耳和杂交苍耳之间无显著差异(P>0.05),且二者都显著高于瘤突苍耳(P<0.05)。苍耳、杂交苍耳和杂交瘤突苍耳的叶绿素b和叶绿素a/b在N0处理下都显著高于瘤突苍耳(P<0.05);杂交苍耳的叶绿素a/b在N50处理下显著高于瘤突苍耳和杂交瘤突苍耳(P<0.05),与苍耳无显著差异(P>0.05),而4种植株的叶绿素b在N50处理下无明显差异(P>0.05);在N90处理下,4种植株的叶绿素a/b也无显著差异(P>0.05)(图5)。

图4 不同氮处理下植株的生长特征比较Fig.4 Comparison of growth traits of plants under different nitrogen treatments

图5 不同氮处理下植株的光合特征比较Fig.5 Comparison of photosynthetic traits of plants grown under different nitrogen treatments
3 讨论
外来植物能否在新的环境中成功入侵,一是取决于植物本身的特性,如种子萌发率、生长能力、繁殖能力和传播能力等;二是取决于新环境中的特征,如养分、水分、光照、温度和海拔等[27-32]。外来植物必须通过自身特性来适应新的环境特征,保持并提高与其他本地物种竞争力,从而实现入侵。养分是植物生长发育过程中不可缺少的重要限制因子,它是决定生境可入侵的一个重要因素[33-35]。高养分可以促进外来植物调整生长节律,使其能更快适应新环境,形成新的生活策略,而低养分使植物不能正常生长,是其生长的限制因子[36]。从本研究可以看出,养分水平对入侵植物瘤突苍耳和本地近缘植物苍耳及互交种的植株形态特征影响显著。随着氮含量的增加,瘤突苍耳、苍耳和互交种的茎粗和总叶面积不断增加,且在各处理下瘤突苍耳和杂交瘤突苍耳均高于苍耳和杂交苍耳。在株高相同条件时,植株的基茎越宽,其植株个体所占的空间就越大[34]。在接收同等光合辐射条件时,植株的总叶面积越大,植株接收到的光能就越多,所产生光合产物就越多,对植株的形态建成与生物量积累就越有利,同时在植株下形成较大的郁闭空间,由此入侵植物通过遮阴方式来抑制土著种的生长[20-21]。本实验证明入侵植物瘤突苍耳和杂交瘤突苍耳的形态特征较本地植物苍耳和杂交苍耳适应范围更广;在氮丰富的生境中,瘤突苍耳与杂交瘤突苍耳的基茎增粗和总叶面积的增加将加快植株的生长发育,有助于其充分利用资源,进而增强其自身的入侵性和竞争力。不同氮含量对瘤突苍耳和苍耳的株高影响并无太大影响,这与全国明等[21]对飞机草(Chromolaena odorata)的研究和唐赛春等[37]对银胶菊(Parthenium hysterophorus)研究的结果相同。这可能是因为在资源丰富的生境中,增加植株冠幅比、增加株高更有利于瘤突苍耳占有更大的空间,从而提高其入侵能力。
在不同的环境条件下,植物在生长和繁殖等功能之间需要进行合理的资源分配,以使各器官功能的分配达到最佳状态。植株的生物量积累和分配格局能反映出植物在生长发育过程中对环境的适应策略和资源分配策略[38-39]。随着氮含量的上升,瘤突苍耳、苍耳和互交种的植株总生物量和根生物量显著增加。瘤突苍耳和杂交瘤突苍耳除了叶片各器官在各处理间差异显著,叶生物量的积累不随养分水平的变化而改变。苍耳和杂交苍耳的茎生物量和叶生物量积累不随氮含量增加而变化。Burns[40]研究鸭跖草科外来种饭包草(Commelina bengalensis)和本地种白花紫露草(Tradescantia fluminensis)表明,高养分水平下外来种的生物量显著高于本地种,但在低养分水平下,两者没有明显差别。本研究中,瘤突苍耳和杂交瘤突苍耳的生物量在各处理下都显著高于本地苍耳和杂交苍耳,这可能是由于瘤突苍耳和杂交瘤突苍耳占据了更多的资源和空间,使其生物量积累较多,导致物种间竞争不平衡;随着氮含量的增加,导致瘤突苍耳和杂交瘤突苍耳的生长优势越来越明显。此外,由于本地种长期生长在低养分水平生境中,生长较慢,养分对本地种生长的促进效果没有对外来入侵种的效果明显。本研究结果与王晋萍等[23]对入侵种豚草(Ambrosia artemisiifolia)在不同氮素水平下与本地种黄花蒿(Artemisia annua)、蒙古蒿(Artemisia mongolica)的竞争关系以及王坤等[41]研究在不同土壤养分条件下入侵种喜旱莲子草(Alternanthera philoxeroides)与其同属的外来弱入侵种刺花莲子草(Alternanthera pungens)以及土著种莲子草(Alternanthera sessilis)生长状况的研究结果一致。本研究中还发现,杂交瘤突苍耳在各处理间的各生物量都显著高于杂交苍耳,表明杂交瘤突苍耳较杂交苍耳更有竞争力。
另外,一些研究也发现外来入侵植物的地上生物量比例随着养分水平的升高而显著增加,如植株的茎生物量比和叶生物量比都随着养分的增加而显著上升。而地下生物量比例不受养分水平上升的影响,甚至显著下降,如根生物量比和根冠比随着养分的提高显著下降[19]。在高养分条件下,植物分配更多的生物量给地上生长部分,因为此时养分不再是植株生长的限制条件,更多的生物量被分配到碳同化器官中,形成更多的叶片数和总叶面积,增强植物的光合作用,进而提高植物的竞争力。但本研究中发现瘤突苍耳与杂交瘤突苍耳的根生物量比和根冠比都随着氮含量的增加而增加,而其茎生物量比和叶生物量比反而都随着氮含量的增加而降低。这与上述结果不太一致,可能是由于土壤中养分没有达到瘤突苍耳和杂交瘤突苍耳吸收氮的临界值,此时氮对瘤突苍耳和杂交瘤突苍耳的生长来说仍是一个重要限制条件,所以植株把更多的生物量分配给了地下根部,使其能更多更快地吸收土壤中的有效氮,保证自身更好更健康的生长。说明养分条件仍是植物生长的限制条件时,瘤突苍耳和杂交瘤突苍耳通过适当增加吸收器官的生物量,从而满足植株生长发育过程中对各种养分的需求,尽快适应新的生长环境。而苍耳和杂交苍耳的生物量分配与瘤突苍耳大致相同,但苍耳各生物量比变化明显都低于瘤突苍耳,说明苍耳长期生长在固定环境中,对环境中的养分变化反应较慢,没有入侵植物瘤突苍耳反应灵敏。这也间接证明在高养分的环境中,更有利于促进外来种的入侵。而杂交瘤突苍耳的各生物量变化高于杂交苍耳,表明杂交瘤突苍耳对环境中养分变化的适应能力强于杂交苍耳。
研究表明外来入侵物种比本地种具有较高的相对生长速率、净同化速率、比叶面积和叶面积比[42-43]。而在本研究中,各处理下,瘤突苍耳总生物量和相对生长速率均显著大于苍耳。高的生物量和相对生长速率不仅代表高的生长能力,还可能意味着高的繁殖能力[44],Herron等[45]和vanKleunen等[46]分析结果表明,入侵植物比非入侵植物具有更高的总生物量和相对生长速率。而相对生长速率取决于净同化速率和叶面积比,净同化速率与光合能力有关,叶面积比与叶生物量分数和比叶面积有关[47-48]。瘤突苍耳的净同化速率在各养分水平下均显著高于苍耳,而叶面积比均显著低于苍耳。因此,可能是高的净同化速率使瘤突苍耳获得了高的相对生长速率和总生物量。Shipley[49]和Feng等[50]的研究也表明,相比而言,净同化速率与相对生长速率的相关性更强。其中光合能力又与净同化速率呈正相关关系,但瘤突苍耳和苍耳的最大光合速率在各养分水平下均无显著差异。在N0处理,瘤突苍耳的叶绿素含量高于苍耳,而在N90处理,瘤突苍耳的叶绿素含量低于苍耳。植物在正常生长的过程中,通常会遇到早晚低光、低温的情况,所以植物利用弱光的能力对于生物量的积累也很重要[51]。本研究中测得最大光合速率,属于光饱和光合速率,因此不能排除瘤突苍耳是通过弱光进行光合作用来增加干物质的积累。同时一些研究发现,植物的非叶器官也能进行光合作用[52],而且非叶器官叶绿体的光合效率高于叶片叶绿体[53],入侵植物支持器官的光合效率高于本地植物[54]。瘤突苍耳的茎秆为绿色,且其茎生物量在各养分水平下均显著高于苍耳,所以瘤突苍耳高的净同化能力很有可能是其茎秆光合造成的。柴伟玲等[55]对外来入侵植物飞机草的研究也证实了这点。杂交后代的相对生长速率、净同化速率和平均叶面积比均高于母本后代,并且杂交瘤突苍耳的生长指标均高于杂交苍耳,说明杂交瘤突苍耳可能具有较高生长能力和繁殖能力,进一步加快其入侵的步伐。
4 结论
瘤突苍耳的总生物量以及根生物量随着氮含量的上升显著增加。随着氮的添加,瘤突苍耳的根生物量比和根冠比显著上升,而茎生物量比和叶生物量比有下降趋势。可能是因为当氮还是植物生长的限制条件时,瘤突苍耳将更多的生物量分配给根部吸收器官,为吸取更多养分。这种分配策略反映入侵植物对低养分环境有较高的适应性。
瘤突苍耳和苍耳的杂交后代的相对生长速率、净同化速率和平均叶面积比在不同氮处理下均高于各母本后代,同时杂交瘤突苍耳的各生物量指标和生长指标均高于杂交苍耳。表明瘤突苍耳的杂交后代比亲本后代与苍耳杂交后代具有较高生长能力和繁殖能力,可以进一步加强其入侵。
References:
[1] Mack R N, Simberloff D, Lonsdale W M,etal. Biotic invasions: causes, epidemiology, global consequences, and control. Ecological Applications, 2000, 10(3): 689-710.
[2] Bradley B A, Blumenthal D M, Wilcove D S,etal. Predicting plant invasions in an era of global change. Trends in Ecology & Evolution, 2010, 25(5): 310-318.
[3] Wan F H, Guo J Y, Wang D H. Alien invasive species in China: their damages and management strategies. Biodiversity Science, 2002, 10(1): 119-125. 万方浩, 郭建英, 王德辉. 中国外来入侵生物的危害与管理对策. 生物多样性, 2002, 10(1): 119-125.
[4] Ju R T, Li H, Shi Z R,etal. Progress of biological invasions research in China over the last decade. Biodiversity Science, 2012, 20(5): 581-611. 鞠瑞亭, 李慧, 石正人, 等. 近十年中国生物入侵研究进展. 生物多样性, 2012, 20(5): 581-611.
[5] Liu J, Chen H, Kowarik I. Plant invasions in China: an emerging hot topic in invasion science. Neobiota, 2012, 15: 27-51.
[6] Pimentel D, Lach L, Zuniga R. Environmental and economic costs of nonindigenous species in United States. Biology Science, 2007, 50(50): 53-65.
[7] Xiang Y C, Peng S L, Zhou H C,etal. Biological invasion and it’s impacts. Ecologic Science, 2001, 20(4): 68-72. 向言词, 彭少麟, 周厚诚, 等. 生物入侵及其影响. 生态科学, 2001, 20(4): 68-72.
[8] Williamson M. Invaders, weeds and the risk from genetically modified organisms. Experientia, 1993, 49(3): 219-224.
[9] Williamson M, Fitter A. The varying success of invader. Ecology, 1996, 77(6): 1661-1666.
[10] Kolar C S, Lodge D M. Progress in invasion biology: predicting invaders. Trends in Ecology & Evolution, 2001, 16(4): 199-204.
[11] Li B, Xu B S, Chen J K. Perspectives on general trends of plant invasions with special reference to alien weed flora of Shanghai. Biodiversity Science, 2001, 9(4): 446-457. 李博, 徐炳声, 陈家宽. 从上海外来杂草区系剖析植物入侵的一般特征. 生物多样性, 2001, 9(4): 446-457.
[12] Shi G R, Ma C C. Biological characteristics of alien plants successful invasion. Chinese Journal of Applied Ecology, 2006, 17(4): 727-732. 史刚荣, 马成仓. 外来植物成功入侵的生物学特征. 应用生态学报, 2006, 17(4): 727-732.
[13] Alpert P, Bone E, Holzapfel C. Invasiveness, invisibility, and the role of environmental stress in preventing the spread of non-native plants. Perspectives in Plant Ecology, Evolution and Systematics, 2000, 3(1): 52-66.
[14] Parastoo B D, Komal P D, Constantine A A,etal. Correlation between the proportion of breast volume involved by locally advanced tumors and invasion of the skin and posterior structures. World Journal of Clinical Oncology, 2012, (3): 43-47.
[15] Holland E A, Dentener F J, Braswell B H. Contemporary and preindustrial global reactive nitrogen budgets. Biogeochemistry, 1999, 46(1): 7-43.
[16] Zhang Y, Liu X J, Zhang F S,etal. Spatial and temporal variation of atmospheric nitrogen deposition in North China Plain. Acta Ecologica Sinica, 2006, 26(6): 1633-1639. 张颖, 刘学军, 张福锁, 等. 华北平原大气氮素沉降的时空变异. 生态学报, 2006, 26(6): 1633-1639.
[17] Williams D G, Mack R N, Black R A. Ecophysiology and growth of introducedPennisetumsetaceumon Hawaii: the role of phenotypic plasticity. Ecology, 1995, 76(5): 1569-1580.
[18] Durand L Z, Goldstein G. Photosynthesis, photoinhibition, and nitrogen use efficiency in native and invasive tree ferns in Hawaii. Oecologia, 2001, 126(3): 345-354.
[19] Wang M L, Feng Y L. Effects of soil nitrogen levels on morphology, biomass allocation and photosynthesis inAgeratinaadenophoraandChromoleanaodorata. Acta Phytoecologica Sinica, 2005, 29(5): 697-705. 王满莲, 冯玉龙. 紫茎泽兰和飞机草的形态、生物量分配和光合特性对氮营养的响应. 植物生态学报, 2005, 29(5): 697-705.
[20] Sorell B K, Brix H, Fitridge I. Gas exchange and growth response to nutrient enrichment in invasiveGlyceriamaximaand native New ZealandCarexspecies. Aquatic Botany, 2012, 103(5): 27-37.
[21] Quan G M, Mao D J, Zhang J E,etal. Effects of nutrient level on plant growth and biomass allocation of invasiveChromolaenaodorata. Ecological Science, 2015, 34(2): 27-33. 全国明, 毛丹鹃, 章家恩, 等. 不同养分水平对飞机草生长与生物量分配的影响. 生态科学, 2015, 34(2): 27-33.
[22] Lake J C, Leishman M R. Invasion success of exotic plants in natural ecosystems: the role of disturbance, plant attributes and freedom from herbivores. Biological Conservation, 2004, 117(2): 215-216.
[23] Wang J P, Dong L J, Sang W G. Effects of different nitrogen regimes on competition betweenAmbrosiaartemisiifolia, an invasive species, and two native species,ArtemisiaannuaandArtemisiamongolica. Biodiversity Science, 2012, 20(1): 3-11. 王晋萍, 董丽佳, 桑卫国. 不同氮素水平下入侵种豚草与本地种黄花蒿、蒙古蒿的竞争关系. 生物多样性, 2012, 20(1): 3-11.
[24] Li N, Zhu L N, Zhai Q,etal. A new alien invasive plant-XanthiumitalicumMoretti. in Liaoning Province. Plant Quarantine, 2010, 24(5): 49-52. 李楠, 朱丽娜, 翟强, 等. 一种新入侵辽宁省的外来有害植物——意大利苍耳. 植物检疫, 2010, 24(5): 49-52.
[25] Qu B, Xun Z F, Xu Y F. The seeds ecological mechanism ofXanthiumstrumariuminvasion. Pratacultural Science, 2015, 32(11): 1801-1807. 曲波, 荀挚峰, 许玉凤. 瘤突苍耳入侵的种子生态学机制. 草业科学, 2015, 32(11): 1801-1807.
[26] Lichtenthaler H K, Wellburn A R. Determination of total carotenoids and chlorophyll a and b of leaf extracts in different solvents. Biochemical Society Transactions, 1982, 11: 591-592.
[27] Rejmanek M, Richardson D M. What attributes make some plant species more invasive. Ecology, 1996, 77(77): 1655-1661.
[28] Prinzing A, Durka W, Klotz S,etal. Which species become aliens. Evolutionary Ecology Research, 2005, 4(3): 385-405.
[29] Davis M A, Grime J P, Thompson K. Fluctuating resources in plant communities: a general theory of invasibility. Journal of Ecology, 2000, 88: 528-534.
[30] Gerlach J D, Rice K J. Testing life history correlates of invasiveness using congenetic plant species. Ecological Applications, 2008, 13(1): 167-179.
[31] Funk J L, Vitousek P M. Resource-use efficiency and plant invasion in low-resource systems. Nature, 2007, 446: 1079-1081.
[32] Leicht-Young S A, Silander J A, Latimer A M. Comparative performance of invasive and nativeCelastrusspecies across environmental gradients. Oecologia, 2007, 154(2): 273-282.
[33] Scott A K, Buckney R T. Invasion of exotic plants in nutrient enriched urban bushland. Austral Ecology, 2002, 27(27): 573-583.
[34] Elberse I A, Damme J M, Tienderen P H. Plasticity of growth characteristics in wild barley in response to nutrient limitation. Journal of Ecology, 2003, 91(3): 371-382.
[35] Wang M L, Feng Y L, Li X. Effects of soil phosphorus level on morphological and photosynthetic characteristics ofAgeratinaadenophoraandChromolaenaodorata. Acta Phytoecologica Sinica, 2006, 17(4): 602-606. 王满莲, 冯玉龙, 李新. 紫茎泽兰和飞机草的形态和光合特性对磷营养的响应. 应用生态学报, 2006, 17(4): 602-606.
[36] Leishman M R, Thomson V P. Experimental evidence for the effects of additional water, nutrients and physical disturbance on invasive plants in low fertility Hawkesbury Sandstone soils, Sydney, Australia. Journal of Ecology, 2004, 93(1): 38-49.
[37] Tang S C, Wei C Q, Pan Y M,etal. Reproductive adaptability of the invasive weedPartheniumhysterophorusL. under different nitrogen and phosphorus levels. Journal of Wuhan Botanical Research, 2010, 28(2): 213-217. 唐赛春, 韦春强, 潘玉梅, 等. 入侵植物银胶菊对不同氮、磷水平的繁殖适应性. 武汉植物学研究, 2010, 28(2): 213-217.
[38] Mealor B A, Hild A L. Post-invasion evolution of native plant populations: a test of biological resilience. Oikos, 2007, 116(9): 1493-1500.
[39] Lei Y B, Xiao H F, Feng Y L. Impacts of alien plant invasions on biodiversity and evolutionary responses of native species. Biodiversity Science, 2010, 18(6): 622-630. 类延宝, 肖海峰, 冯玉龙. 外来植物入侵对生物多样性的影响及本地生物的进化响应. 生物多样性, 2010, 18(6): 622-630.
[40] Burns J H. A comparison of invasive and non-invasive day flowers (Commelinaceae) across experimental nutrient and water gradients. Diversity and Distributions, 2004, 10: 387-397.
[41] Wang K, Yang J, Chen J K. Comparison of morphological traits between alligator weed and two congeners under different water and nutrient conditions. Biodiversity Science, 2010, 18(6): 615-621. 王坤, 杨继, 陈家宽. 不同土壤水分和养分条件下喜旱莲子草与同属种生长状况的比较研究. 生物多样性, 2010, 18(6): 615-621.
[42] Pysek P, Krivanek P M, Jarosik V. Planting intensity, residence time, and species traits determine invasion success of alien woody species. Ecology, 2010, 90(10): 2734-2744.
[43] Liu M C, Wei C Q, Tang S C,etal. Bionomics of two invasive weeds,BidensalbaandB.pilosa, and their native congeners grown under different nutrient levels. Journal of Biosafety, 2012, 21(1): 32-40. 刘明超, 韦春强, 唐赛春, 等. 不同土壤养分水平下2种外来鬼针草和近缘本地种的比较研究. 生物安全学报, 2012, 21(1): 32-40.
[44] Shipley B. Net assimilation rate, specific leaf area and leaf mass ratio: which is most closely correlated with relative growth rate? A meta-analysis. Functional Ecology, 2006, 20(4): 565-574.
[45] Herron P M, Martine C T, Latimer A M,etal. Invasive plants and their ecological strategies: prediction and explanation of woody plant invasion in New England. Diversity and Distributions, 2007, 13(5): 633-644.
[46] van Kleunen M, Weber E, Fischer M. A meta-analysis of trait differences between invasive and non-invasive plant species. Ecology Letters, 2010, 13(2): 235-245.
[47] Feng Y L. Photosynthesis, nitrogen allocation and specific leaf area in invasiveEupatoriumadenophorumand nativeEupatoriumjaponicumgrown at different irradiances. Physiologia Plantarum, 2008, 133(2): 318-326.
[48] Wang K, Yang J, Chen J K. The applications of congeneric comparisons in plant invasion ecology. Biodiversity Science, 2009, 17(4): 353-361. 王坤, 杨继, 陈家宽. 近缘种比较研究在植物入侵生态学中的应用. 生物多样性, 2009, 17(4): 353-361.
[49] Shipley B. Trade-offs between net assimilation rate and specific leaf area in determining relative growth rate: relationship with daily irradiance. Functional Ecology, 2002, 16(5): 682-689.
[50] Feng Y L, Auge H, Ebeling S K. InvasiveBuddlejadavidiiallocates more nitrogen to its photosynthetic machinery than five native woody species. Oecologia, 2007, 153(3): 501-510.
[51] Wang Y. Comparative studies on light utilization characteristics and shade tolerance of 14 ground cover plants. Journal of Zhejiang Forestry College, 2005, 22(1): 6-11. 王雁. 种地被植物光能利用特性及耐阴性比较. 浙江林学院学报, 2005, 22(1): 6-11.
[52] Aschan G, Pfanz H. Non-foliar photosynthesis-a strategy of additional carbon acquisition. Flora-Morphology, Distribution, Functional Ecology of Plants, 2003, 198(2): 81-97.
[53] Zu Y G, Zhang Z H, Wang W J,etal. Different characteristics of photosynthesis in stems and leaves ofMikaniamicranth. Journal of Plant Ecology, 2006, 30(6): 998-1004.
[54] Nowak R S, Caldwell M M. A test of compensatory photosynthesis in the field: implications for herbivory tolerance. Oecologia, 1984, 61(3): 311-318.
[55] Chai W L, Lei Y B, Li Y P,etal. Responses of invasiveChromolaenaodorataand nativeEupatoriumheterophyllumto atmospheric CO2enrichment. Acta Ecologica Sinica, 2014, 34(13): 3744-3751. 柴伟玲, 类延宝, 李扬苹, 等. 外来入侵植物飞机草和本地植物异叶泽兰对大气CO2浓度升高的响应. 生态学报, 2014, 34(13): 3744-3751.
Effect of nitrogen treatments on growth of the invasive plantXanthiumstrumarium, the native plantXanthiumsibiricum, and their reciprocal crosses
XUN Zhi-Feng1,2,3, BAI Long2, QU Bo1,3,4*, XU Yu-Feng1,3, LI Guang-Hai1, ZHAN Zhong-Lang1, SHI Jiu-Yao1
1.BioscienceandTechnologyCollege,ShenyangAgriculturalUniversity,Shenyang110866,China; 2.HorticultureCollege,ShenyangAgriculturalUniversity,Shenyang110866,China; 3.KeyLabofGlobalChangesandBiologicalInvasions,LiaoningProvince,Shenyang110866,China; 4.LiaoningShuangtaiEstuaryWetlandEcosystemResearchStation,Panjin124000,China
The effect of soil nutrients on the invasion of alien plants is a hot topic in invasion biology research, but few studies have focused on the effects of soil nutrients on the characteristics of reciprocally crossing plants. In this study, we analyzed the differences in biomass accumulation and distribution, growth characteristics, and photosynthetic characteristics of the invasive plantXanthiumstrumarium, the native plantXanthiumsibiricum, and their reciprocal crosses (Xst♀×Xsi♂ and Xsi♀×Xst♂) under different nitrogen treatments, to explore the relationship between invasion and soil nutrient status. The stem diameter, total leaf area, total biomass, root biomass, root biomass ratio, and root mass/crown mass ratio ofX.strumarium,X.sibiricum, and their reciprocal crosses (Xst♀×Xsi♂) increased significantly (P<0.05) and the leaf area to root mass ratio decreased significantly (P<0.05) with increasing nitrogen levels in the soil. The net assimilation rate ofX.strumariumwas significantly higher than that ofX.sibiricum(P<0.05), but its specific leaf area was significantly lower than that ofX.sibiricum(P<0.05). The relative growth rate, net assimilation rate, and mean leaf area ratio were higher in the male progeny than in the female progeny (P<0.05), and the biomass index and growth index were higher in Xst♀×Xsi♂ plants than in Xsi♀ × Xst♂ plants. We concluded that: 1) when nutrients are limited,X.strumariumdistributes more biomass to the root, possibly as an ecological strategy to adapt to nutrient-heterogenous environments during invasion. 2) Compared with the hybrid progenies ofX.sibiricum, those ofX.strumariumshow stronger growth and increased reproductive ability, which are properties that will further strengthen their invasiveness.
Xanthiumstrumarium; nitrogen treatments; hybridization; invasion
10.11686/cyxb2016217
http://cyxb.lzu.edu.cn
2016-05-23;改回日期:2016-06-08
辽宁省农业攻关及成果产业化项目(201421400)资助。
荀挚峰(1990-),男,满族,辽宁本溪人,在读硕士。E-mail:xungreat@163.com*通信作者Corresponding author. E-mail:syau_qb@163.com
荀挚峰, 白龙, 曲波, 许玉凤, 李光海, 詹忠浪, 石九曜. 不同氮添加对入侵植物瘤突苍耳和本地近缘植物苍耳及两者杂交种的生长影响.草业学报, 2017, 26(5): 51-61.
XUN Zhi-Feng, BAI Long, QU Bo, XU Yu-Feng, LI Guang-Hai, ZHAN Zhong-Lang, SHI Jiu-Yao. Effect of nitrogen treatments on growth of the invasive plantXanthiumstrumarium, the native plantXanthiumsibiricum, and their reciprocal crosses. Acta Prataculturae Sinica, 2017, 26(5): 51-61.
