铜尾矿库白羊草内生真菌的分布及rDNA-ITS系统发育
2017-05-23曹苗文贾彤景炬辉柴宝峰
曹苗文,贾彤*,景炬辉,柴宝峰
(1.山西大学黄土高原研究所,山西 太原030006;2.山西大学生物技术研究所,山西 太原030006)
铜尾矿库白羊草内生真菌的分布及rDNA-ITS系统发育
曹苗文1,贾彤1*,景炬辉2,柴宝峰1
(1.山西大学黄土高原研究所,山西 太原030006;2.山西大学生物技术研究所,山西 太原030006)
对北方铜业铜矿峪矿十八河尾矿库的优势植被白羊草内生真菌染菌率进行调查,采集活体植株进行叶鞘内生真菌分离,并对白羊草内生真菌的形态特征及孢子形态进行描述,同时,选取其中16株进行5.8S-ITS扩增、测序和系统发育分析。结果表明,从生长在4个不同恢复年限子坝的白羊草中分离出形态不同的内生真菌,其中以白色菌落居多,生长速度位于5.515~12.548 mm/d之间。孢子形态以球型和椭圆型为主,大小介于2.085~7.072 μm之间。分子鉴定结果显示16种内生真菌属于3个属,为赤霉属(Gibberella)、镰刀菌属(Fusarium)、青霉属(Penicillium),恢复30年与5年的子坝白羊草内生真菌遗传距离最小,亲缘关系最近,恢复45年与15年的子坝白羊草内生真菌亲缘关系最远。铜矿库不同恢复年限的土壤环境可能导致白羊草感染内生真菌的多样性,这为进一步丰富铜尾矿库内生真菌资源,揭示生活在铜尾矿的白羊草内生真菌的生态功能提供理论依据。
铜尾矿库;重金属;白羊草;内生真菌
十八河尾矿库位于山西运城垣曲县,其坝体为人工堆积,将库区近坝体尾矿推至坝前,通过碾压处理将其压实,上覆黄土,形成坝体[1]。自1969年建坝以来,随着植被修复的进行,逐渐形成不同演替阶段的植物群落,其中,白羊草(Bothriochloaischaemum)是其优势种之一。白羊草是禾本科孔颖草属多年生丛生禾草,属于暖季型草本;短根状茎,疏丛型,株高在25~80 cm之间;品质好,适口性强,耐旱及再生能力强,对土壤酸碱度要求不高,是黄土高原地区的主要牧草。通常作为优势种生长于斜坡、路边、田边和干旱多石等区域,在山西主要分布在晋城、晋中、运城、临汾[2-4]。
内生真菌(endophyte)在1866年由De Bary首次提出[5],后定义为生活在植物组织中,但不会让植物产生可见症状的真菌。内生真菌种类众多,分布在各种植物体内,从苔藓,藻类,蕨类到种子植物,从寒带植物到热带植物,从农作物到热带雨林植物都有发现[6]。从红树林、马齿苋(Portulacaoleracea)中分离出的镰刀菌属(Fusarium)[7-8],胡杨(Populusdiversifolia)中的青霉属(Penicillium)、木霉属(Trichoderma)[9],食用菌中分离出的丛赤壳菌(Nectriaceae)[10],甘草(Glycyrrhizauralensis)中分离出的赤霉菌属(Gibberella)[11],从马齿苋中还分离出附球菌属(Epicoccum)[8]以及从披碱草(Elymusdahuricus)、羽茅(Achnatherumsibiricum)、羊草(Leymuschinensis)中分离出的Epichloё属内生真菌。比如,天然禾草羊草中存在的Epichloёbromicola,羽茅中的Epichloёsibirica,Epichloёgansuensis[12-17]。但是对天然禾草白羊草中内生真菌的研究还未见报道。
本研究所在样地存在严重的镉、铅、铜污染问题,但是白羊草依然能够在此处正常生长,成为优势种,其原因鲜有报道。有研究指出,在高羊茅(Festucaarundinacea)中接种内生真菌能够促进植物在镉胁迫环境中生长[18]。深色有隔内生真菌通过提高植物光合作用,改变植物根际微生物,促进植物矿质元素的吸收和有机养分的吸收来提高植物耐重金属的能力[19]。那么,白羊草是否因感染内生真菌使其能够很好地适应重金属污染环境呢?因此,在铜尾矿库开展白羊草内生真菌多样性的研究具有重要意义。本实验通过形态学描述和分子鉴定的方法,结合铜尾矿库土壤理化性质,对重金属污染环境中的白羊草是否感染内生真菌及内生真菌特征进行初步研究。旨在探究重金属污染背景下的植物中内生真菌的多样性,为后续研究白羊草内生真菌在铜尾矿库恢复中的作用奠定基础。
1 材料与方法
1.1 研究区概况及土壤理化性质测定
选取山西省运城市垣曲县北方铜业铜矿峪矿十八河尾矿库为研究地点,该地年均气温13.5 ℃,年均降水量631 mm。从1972年4月使用至今现已筑12级子坝[1]。各个子坝的植被恢复年限不同,从高到低恢复年限逐渐增加。各子坝常见植被有:白茅(Imperatacylindrica)、白羊草、白莲蒿(Artemisiasacrorum)、冷蒿(Artemisiafrigida)、狼尾草(Pennisetumalopecuroides)等。于2015年7月进行采样,自上而下共设置了4个不同恢复年限(45、30、15、5年)的样地,采集白羊草和土壤。回到实验室后对各样地的土壤进行了理化性质测定。pH值(土∶液=1∶2.5)用酸度计(HI3221 pH/ORP/ISE meter, HANNA, Italy)测定[20]。粒度用粒度仪(Mastersizer 3000, Malvern, UK)测定。总氮(TN),总碳(TC),总硫(TS)的测定,首先用球磨仪将其磨成粉末状,然后用元素分析仪(Vario MACRO, Elementar, Germany)测定。重金属含量的测定首先用强氧化物对土壤进行消解,再将消解产物用等离子体发射光谱仪(iCAP 6000, Thermo Fisher, UK)测定[21]。
1.2 白羊草染菌情况调查
在每个样地采集不少于30株白羊草地上部分,对叶鞘内表皮进行撕片染色,染色剂用苯胺蓝(10 g苯酚,10 g乳酸,20 g甘油,0.025 g苯胺蓝,100 mL蒸馏水)[12],染色大约5 min,盖上盖玻片,放在显微镜下观察,并计算染菌率(染菌率=染菌植株数/检菌植株总数)。
1.3 内生真菌分离及孢子观察
将白羊草叶鞘剪成约1 cm的小段,首先进行植物表面灭菌。放入70%的酒精中5 s,再用5%的次氯酸钠浸泡7 min,在浸泡过程中不断摇晃,倒掉次氯酸钠加入无菌水,用无菌水清洗至少3次,每次30 s。将表面灭菌后的茎段横放或插入配制好的马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA,不含抗生素)中(以上过程均在超净台操作),置于25 ℃培养。待真菌从培养基上长出来后,选择形态不一的菌落分别进行纯化,纯化4代后,菌落形态保持世代不变后进行孢子形态观察。将苯胺蓝染色液稀释10倍,滴在载玻片上,挑取菌丝置于染色液上,染色5 min,盖上盖玻片用数码成像显微系统(Moticam Pro 205A,Motic,Germany)观察。染菌情况调查和内生真菌分离在采集回来后及时进行了实验。
1.4 内生真菌的分子鉴定
内生真菌DNA提取[12]。提出来的DNA用多功能酶标仪(Infinite M200Pro NanoQuant, TECAN, Austria)测定其浓度和纯度,并用1%的琼脂糖凝胶电泳观察提取结果。PCR反应:将提出来的DNA稀释至10 ng/μL,选用ITS5~ITS4作为引物(ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)[5]。反应体系50 μL,含有:Template 10 μL,ITS4、ITS5 0.75 μL(10 μmol/L)(上海生工),10×EasyTaqBuffer 5 μL,2.5 mmol/L dNTPs 4 μL,EasyTaqDNA Polymerase 0.5 μL,ddH2O 29 μL。反应条件:95 ℃,3 min;95 ℃,40 s;52 ℃,50 s;72 ℃,60 s;72 ℃,10 min,共35个循环。将PCR产物经琼脂糖凝胶电泳确定PCR结果,选择最佳的PCR产物送至华大基因有限公司测序。
1.5 序列数据分析
首先把测序结果前端和后端的杂峰序列去除,然后在National Center for Biotechnology Information(NCBI)数据库进行BLAST,选择相似性高的序列与测出来的序列进行比对并进行系统发育分析。比对时,先使用MEGA6校准,然后去除比对序列两端多余的部分,使序列等长。然后运用最大似然法(Maximum-Likelihood法)进行系统发育分析,制作系统进化树,同时计算遗传距离。
2 结果与分析
2.1 土壤理化性质及白羊草染菌率调查
根据土壤环境质量三级标准(GB15618-1995),本地区的土壤中镉(1 mg/kg)、铅(500 mg/kg)严重超标,而30年子坝的铜(400 mg/kg)严重超标。pH值位于7.5~8.8之间,为碱性土壤。土壤平均粒径位于0.05~0.25 mm之间,属于细砂粒。由总氮可以看出,该地土壤养分低,并且4个梯度间土壤理化性质明显不同(表1)。
2.2 内生真菌菌落及孢子形态
从4层子坝白羊草中共分离纯化出16种内生真菌,菌落颜色大多为白色,圆形,棉状,少数呈褐色或淡黑,淡紫。另外,菌落边缘有的较为整齐,有的比较不规则,而且其生长速度不一且孢子形态不同。白羊草内生真菌生长速度位于5.515~12.548 mm/d之间,孢子大小位于2.085~7.072 μm之间,孢子形态有柱型、椭圆、球型(图1,表2)。根据菌落形态及孢子特征初步得出:这16种菌有可能属于镰刀菌属、木霉属、赤霉属、青霉属、丛赤壳属[22-24]。

表1 土壤理化性质及染菌率情况Table 1 Soil properties and contamination rate
表中数据为平均值±标准误,同行数据不同字母表示差异显著(P<0.05)。
Data in the Table are as mean±SE, different letters in the same row indicate significant difference atP<0.05 level.
2.3 PCR结果及其测序结果的系统进化分析
在对内生真菌提取DNA后,对DNA的5.8S-ITS(internal transcribed spacer)进行扩增并测序,将测序结果在NCBI数据库进行了BLAST比对,挑选出与分离菌株相似的序列,用于系统发育分析。PCR产物进行1%琼脂糖凝胶电泳检测,显示PCR产物特异,没有其他杂核苷酸产生,片段长度约为600 bp,确定为目的条带(图2)。测序结果发现2~14及16号菌5.8S-ITS序列相似率达99%以上,所以用1,2,15号菌的序列进行BLAST比对,结合形态学比对结果得出的与实验菌相似程度达97%以上的为赤霉属、镰刀菌属、青霉属。镰刀菌属在无性时期属于半知菌亚门,瘤座菌目(Tuberculariales),有性时期为子囊菌亚门(Deuteromycotina),赤霉属。青霉属属于子囊菌(Ascomycotina)。
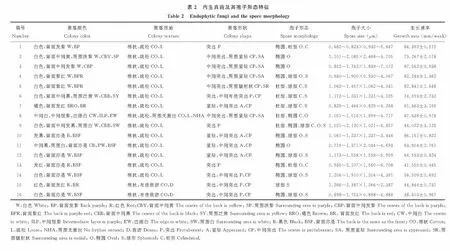

图2 白羊草内生真菌基因组PCR结果Fig.2 PCR products of 5.8S-ITS from endophytes associated with B. ischaemum 1~16代表图1的16个菌落。1-16 represents 16 colonies in Figure 1.
实验菌序列与相似序列进行系统进化分析,发现2号与15号菌进化关系较近,而1号菌相对较远 (图3)。研究发现真菌中的鲁氏毛霉菌(Mucorrouxii),少根根霉菌(Rhizopusarrhizus)和白腐真菌(Trametesversicolor)对重金属镉有生物吸附能力,其中白腐真菌的吸附能力达到了 165.2 mg/g[25];另外绿色木霉(Trichodermaviride)[26], 小球壳孢菌(Microsphaeropsissp.),稻根曲霉(Rhizopusoryzae),琉球曲霉(Aspergillusluchuensis),塔宾曲霉菌(Aspergillustubingensis),秀丽单顶孢(Monacrosporiumelegans),棒孢拟盘多毛孢(Pestalotiopsisclavispora)[27], 毛霉属CBRF59(Mucorsp. CBRF59),少根根霉菌[28]等内生真菌也已经证明对重金属有吸附能力。把分离出的实验菌与已知的吸附重金属的内生真菌进行系统进化分析发现,I1与绿色木霉有比较近的亲缘关系,其他实验菌与这些吸附重金属的菌关系较远(图4)。从表3可以看出,30年子坝与5年子坝的白羊草内生真菌遗传距离最小,亲缘关系最近。45年子坝与15年子坝遗传距离最大,亲缘关系最远。

图3 对rDNA-ITS测序结果进行系统进化分析(Maximum-Likelihood法)Fig.3 The phylogenetic analysis of rDNA-ITS sequencing results(ML method) I1、I2、I15对应图1的1、2、15;分支上的数字代表大于或等于50%的bootstrap。下同。I1, I2, I15 corresponds to 1, 2, 15 in Fig.1, the number on the branch is greater than or equal to 50% of the bootstrap. The same below.

样地Samples45年子坝45yearssub-dam30年子坝30yearssub-dam15年子坝15yearssub-dam30年子坝30yearssub-dam0.140215年子坝15yearssub-dam0.18000.03975年子坝5yearssub-dam0.14020.00190.0383

图4 白羊草内生真菌与已知吸附重金属的内生真菌系统进化树分析(Maximum-Likelihood法)Fig.4 B. ischaemum endophytes and heavy metal adsorption endophytes phylogenetic analysis(ML method)
3 讨论
3.1 内生真菌在白羊草中的分布
本研究所调查的4个内生真菌种群分布在同一地区,空间距离较近。调查结果显示白羊草在该地区的染菌率不高。内生真菌的类型与感染率随不同种群变化而变化[29]。从土壤理化性质可以看出5年和30年子坝的C/N与pH基本没有差异,这可能是造成这两个样地白羊草内生真菌完全相同的原因,因为土壤C/N和pH会影响土壤真菌的生长[30],而土壤微生物群落会影响植物内生真菌的结构[31]。15年和45年子坝土壤C/N差异不明显,pH有极显著差异,这会导致这两个样地白羊草内生真菌产生差异[30]。另一个导致内生真菌差异的原因是由于白羊草所处的植物群落不同,不同的植被群落代表多样的凋落物类型,而凋落物是内生真菌宿主的主要营养来源[32-33],营养的多样性造成内生真菌繁殖体的多样性[34]。在恢复15年的样地中,植被以矮小的草本和零星低矮的灌木为主,如冷蒿,曲枝委陵菜(Potentillayokusaiana),杠柳(Periplocasepium)等,且植被覆盖度低,种类少。而45年子坝的植被以较高的荆条(Vitexnegundovar.heterophylla),狼尾草为主,植被盖度基本为100%,植物多样性高。2012年在对云南会泽的铅锌矿废渣研究中也从其上生长的植物中分离出镰刀菌属和青霉属的内生真菌[35]。在四川汉源铅锌矿区植物中也得出相似的结果[36]。这与该铜尾矿库白羊草内生真菌的分离结果有相同之处。
3.2 内生真菌培养特征及孢子多态性
根据实验结果可以看出,内生真菌菌落大多呈圆形、白色,有少数为红色或褐色,还有些许发黑的情况。菌落表面似毡状覆盖,质地疏松,生长速度不一。白羊草内生真菌生长速度位于5.515~12.548 mm/d之间,比分离自内蒙古中东部羽茅0.22~2.86 mm/d[13]和红菇(Russulavinosa)1.89~2.63 mm/d[10]中的内生真菌生长速度快,孢子大小位于2.085~7.072 μm之间,与羽茅(4.8~9.8 μm)、光稃早熟禾(Poapsilolepis)(2.7~5.0 μm)的内生真菌孢子大小相近[13],而比麦冬(Ophiopogonjaponicus)内生真菌的孢子(7.2~11.0 μm)小[37]。从不同恢复年限的子坝中分离出形态各异的内生真菌,首先,可能由于恢复年限不同导致白羊草的生境差异,从而不仅影响白羊草的生长,也间接影响了白羊草内生真菌群落结构;其次,可能是由于白羊草所含营养物质不同,不同真菌对营养物质的需求有一定差异,从而影响内生真菌的侵染和生长[38];再者,宿主植物基因型不同,所含内生真菌的种类也不同,说明有些内生真菌存在宿主特异性[39]。
3.3 白羊草中内生真菌的系统发育关系
虽然分离出的内生真菌形态和序列均不同,但是分析各子坝白羊草中的内生真菌发现,它们的聚类分析基本都可以聚在一起,亲缘关系较近。子坝间的遗传距离最大的是45年子坝和15年子坝的白羊草内生真菌,为0.18。这可能是因为子坝上植被恢复年限间隔较长,但其空间距离较小,因而对内生真菌的基因交流影响较小[13]。但子坝之间白羊草内生真菌的遗传距离不完全为0,说明恢复年限带来的环境变化对子坝之间内生真菌的遗传距离还是有一定影响。分离得到的内生真菌表型有16种,但是5.8S-ITS序列只有3种。导致这一结果的原因可能是,同一属不同种的真菌,基因组5.8S-ITS区虽然差异不大,但仍表现出不同的菌落形态及孢子特征。
3.4 尾矿库白羊草内生真菌与已知吸附重金属内生真菌的系统发育分析
把白羊草内生真菌与已知吸附重金属的内生真菌做系统进化树分析(图4)发现,I1与绿色木霉有相近的亲缘关系,绿色木霉对镉有良好的吸附作用[27],与它亲缘关系相近的I1能够生活在镉超标土壤的植物体内,是否对镉也有吸附作用还需进一步研究。而其他菌虽然与这些已知的吸附重金属的内生真菌亲缘关系相对较远,但是在这种尾矿库环境下依然能够在白羊草内正常生存,其能够耐受这种环境的原因及其是否也具有吸附重金属的能力还有待进一步研究。
4 结论
利用PDA培养基分离的方法,从4个不同恢复年限的子坝白羊草中共分离出16种不同形态内生真菌。各菌落形态各异,生长速度位于5.515~12.548 mm/d之间,孢子形态以球型和椭圆型为主,孢子大小介于2.085~7.072 μm。
分子鉴定结果显示16种内生真菌的5.8S-ITS序列有3种类型,分别属于镰刀菌属、赤霉属、青霉属。通过计算遗传距离得出,子坝之间白羊草内生真菌的基因交流影响较小,同时,不同恢复年限对子坝之间内生真菌的遗传距离也存在一定的影响。
将白羊草内生真菌与已知的吸附重金属的内生真菌做系统进化分析发现,I1与吸附镉的绿色木霉亲缘关系较近。
References:
[1] Tan Y X. Study on the Potential Harm and Prevention Measure in Shibahe Tailing[D]. Xi’an: Chang’an University, 2012. 谭永祥. 十八河尾矿库潜在危害及防治措施研究[D]. 西安: 长安大学, 2012.
[2] Xu Q F, Dong K H. The dominant species of shrub grassland-Bothriochloaischaemum. Grassland and Turf, 2004, (3): 20-24. 许庆方, 董宽虎. 温性灌草丛类建群种——白羊草. 草原与草坪, 2004, (3): 20-24.
[3] Guo J M. Comprehensive Evaluation of Different Population ofBothriochloaischaemumDrought Resistance in Shanxi[D]. Taigu: Shanxi Agricultural University, 2015. 郭晋梅. 山西不同居群白羊草抗旱性综合评价[D]. 太谷: 山西农业大学, 2015.
[4] Mi J. The Reproductive Character and Regrowth Performance of Old World Bluestem (Bothriochloaischaemum) Population in Shanxi Rangelands[D]. Taigu: Shanxi Agricultural University, 2005. 米佳. 山西白羊草种群繁殖特性及再生性能研究[D]. 太谷: 山西农业大学, 2005.
[5] Zhang X, Li Y, Wei Y K,etal. Distribution and rDNA-ITS sequence analysis ofEpichloё endophyte symbiosis withAchnatherumsibiricumin mid- and eastern Inner Mongolia Steppe. Acta Ecologica Sinica, 2007, 27(7): 2904-2910. 张欣, 李熠, 魏宇昆, 等. 内蒙古中东部草原羽茅Epichloё属内生真菌的分布及rDNA-ITS序列系统发育. 生态学报, 2007, 27(7): 2904-2910.
[6] Arnold A E. Understanding the diversity of foliar endophytic fungi: progress, challenges, and frontiers. Fungal Biology Reviews, 2007, 21(2): 51-66.
[7] Cheng Z S, Tang W C, Su Z J,etal. Identification of mangrove endophytic fungus 1403 (Fusariumproliferatum) based on morphological and molecular evidence. Journal of Forestry Research, 2008, 19(3): 219-224.
[8] Zhang Y. Isolation of Endophytic Fungi fromPortulacaoteraceaand Study on their Influence on Hosts Growth[D]. Hohhot: Inner Mongolia Agricultural University, 2015. 张瑜. 马齿苋内生真菌的分离、鉴定及其对宿主生长的影响[D]. 呼和浩特: 内蒙古农业大学, 2015.
[9] Han Y J, Liang Y, Yuan X Y. Isolation and antifungal activity of endophyte fromPopuluseuphraticaoliver. Acta Agriculturae Boreali-occidentalis Sinica, 2014, 23(6): 189-194. 韩艳洁, 梁艳, 袁秀英. 胡杨内生真菌分离及其抑菌活性研究. 西北农业学报, 2014, 23(6): 189-194.
[10] Zeng X L, Liu D L. Isolation and mycelial growth characteristics ofNectriasp. isolated fromRussulagriseocarnosa. Edible Fungi of China, 2013, 32(4): 32-34. 曾宪录, 刘德良. 灰肉红菇内生真菌的分离及生长特性研究. 中国食用菌, 2013, 32(4): 32-34.
[11] Tie W F, Hu Y L, Zhu J B,etal. Isolation and identification of endophytical fungus inLicoricecollected from Xinjiang area. Biotechnology Bulletin, 2010, (9): 149-153. 帖卫芳, 胡鸢雷, 祝建波,等. 甘草内生真菌的分离及鉴定. 生物技术通报, 2010, (9): 149-153.
[12] Zhu M J. Diversity of Endophytes Associated withLeymuschinensisand Its Effects on Host Physio-ecological Characteristics in the Mid-Eastern Inner Mongolia Steppe[D]. Tianjin: Nankai University, 2013. 朱敏杰. 内蒙古中东部草原羊草内生真菌多样性及其对宿主生理生态特性的影响[D]. 天津: 南开大学, 2013.
[13] Wei Y K, Gao Y B, Li C,etal. Genetic diversity ofNeotyphodiumendophytes isolated fromAchnatherumsibiricumpopulation in mid-and Eastern Inner Mongolia steppe. Journal of Plant Ecology, 2006, 30(4): 640-649. 魏宇昆, 高玉葆, 李川,等. 内蒙古中东部草原羽茅内生真菌的遗传多样性. 植物生态学报, 2006, 30(4): 640-649.
[14] Song H. Phylogeny of NineElymusSpecies and Related AsexualEpichloё Endophyte[D]. Lanzhou: Lanzhou University, 2015. 宋辉. 九种披碱草属植物及其Epichloё内生真菌的系统进化[D]. 兰州: 兰州大学, 2015.
[15] Zhu M J, Ren A Z, Wen W,etal. Diversity and taxonomy of endophytes fromLeymuschinensisin the Inner Mongolia steppe of China. FEMS Microbiology Letters, 2013, 340(2): 135-145.
[16] Zhang X. Diversity of Endophyte inAchnatherumsibiricumand Their Coevolution with Host Plants in the Middle East of Inner Mongolia[D]. Tianjin: Nankai University, 2009. 张欣. 内蒙古中东部草原羽茅种群内生真菌的多样性及与宿主植物协同进化的研究[D]. 天津: 南开大学, 2009.
[17] Leuchtmann A, Bacon C W, Schardl C L,etal. Nomenclatural realignment ofNeotyphodiumspecies with genusEpichloё. Mycologia, 2014, 106(2): 202-215.
[18] Ren A Z, Li C, Gao Y B. Endophytic fungus improves growth and metal uptake ofLoliumarundinaceumDarbyshire Ex. Schreb. International Journal of Phytoremediation, 2011, 13(3): 233-243.[19] Ban Y H. Mechanisms of Dark Septate Endophyte Isolated from Pb-Zn Mine Improving Plant Lead Tolerance[D]. Yangling: Northwest A&F University, 2013. 班宜辉. 铅锌矿区深色有隔内生真菌提高植物耐Pb机制研究[D]. 杨凌: 西北农林科技大学, 2013.
[20] Jiang S, Xu Z Q, Zhang C J. Determination and analysis on the pH of soil in Wanyuan City of Sichuan Province. Journal of Anhui Agricultural Sciences, 2009, (25): 12105-12108. 蒋实, 徐争启, 张成江. 四川省万源市土壤pH值测定及土壤酸碱度分析. 安徽农业科学, 2009, (25): 12105-12108.
[21] Long J H, Tan J, Wu Y J,etal. A comparative study on the detection of heavy metal in soil with different digestion methods. Environmental Monitoring in China, 2013, (1): 123-126. 龙加洪, 谭菊, 吴银菊, 等. 土壤重金属含量测定不同消解方法比较研究. 中国环境监测, 2013, (1): 123-126.
[22] Deng H H, Hong W, Wu C Z,etal. Separation, selection and identification on producing lipid strains of endophytic fungi fromPinusmassoniana. Journal of Plant Resources and Environment, 2014, (2): 27-33. 邓慧华, 洪伟, 吴承祯, 等. 马尾松内生真菌产油脂菌株的分离、筛选和鉴定. 植物资源与环境学报, 2014, (2): 27-33.
[23] Zhou Y L. Mycology[M]. Beijing: Higher Education Press (HEP), 1986. 周与良. 真菌学[M]. 北京: 高等教育出版社, 1986.
[24] Sun Y, Sun Y, Chen F M,etal. 6 species of endophyticFusariumisolation and identification. Jiangsu Agricultural Science, 2010, (5): 437-439. 孙勇, 孙颖, 陈凤美, 等. 6种植物中内生镰刀菌的分离和鉴定. 江苏农业科学, 2010, (5): 437-439.
[25] Yakup Arica M, Yasemin K, Ömer G. Entrapment of white-rot fungusTrametesversicolorin Ca-alginate beads: preparation and biosorption kinetic analysis for cadmium removal from an aqueous solution. Bioresource Technology, 2001, 80(2): 121-129.
[26] Xiao X. Application of Heavy Metal Hyperaccumulator Endophytes in Heavy Metal Decontamination[D]. Changsha: Hunan University, 2011. 肖潇. 基于镉超累积植物内生菌的重金属污染修复研究[D]. 长沙: 湖南大学, 2011.
[27] Srivastava S, Agrawal S B, Mondal M K. A review on progress of heavy metal removal using adsorbents of microbial and plant origin. Environmental Science and Pollution Research, 2015, 22(20): 15386-15415.
[28] Deng Z J, Huang H W, Cao L X,etal. Characterization of Cd- and Pb-resistant fungal endophyteMucorsp. CBRF59 isolated from rapes (Brassicachinensis) in a metal-contaminated soil. Journal of Hazardous Materials, 2011, 185: 717-724.
[29] Arnold A E, Herre E A. Canopy cover and leaf age affect colonization by tropical fungal endophytes: Ecological pattern and process in Theobroma cacao (Malvaceae). Mycologia, 2003, 95(3): 388-398.
[30] Siles J A, Margesin R. Abundance and diversity of bacterial, archaeal, and fungal communities along an altitudinal gradient in alpine forest soils: What Are the Driving Factors. Microbial Ecology, 2016, 72(1): 207-220.
[31] Pattison Z, Rumble H, Tanner R A,etal. Positive plant-soil feedbacks of the invasiveImpatiensglanduliferaand their effects on above-ground microbial communities. Weed Research, 2016, 56(3): 198-207.
[32] Herre E A, Mejia L C, Kyllo D A,etal. Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae. Ecology, 2007, 88(3): 550-558.
[33] Osono T, Tateno O, Masuya H. Diversity and ubiquity of xylariaceous endophytes in live and dead leaves of temperate forest trees. Mycoscience, 2013, 54(1): 54-61.
[34] Saucedo-Garcia A, Luisa Anaya A, Espinosa-Garcia F J,etal. Diversity and communities of foliar endophytic fungi from different agroecosystems ofCoffeaarabicaL. in two regions of Veracruz, Mexico. Plos One, 2014, 9(6): 1-11.
[35] Li D W, Xu H M, Mei T,etal. Diversity of endophytic fungi from six dominant plant species in a Pb-Zn mine wasteland in China. Acta Ecologica Sinica, 2012, 32(7): 2288-2293. 李东伟, 徐红梅, 梅涛, 等. 云南会泽铅锌矿废弃矿渣堆常见植物内生真菌多样性. 生态学报, 2012, 32(7): 2288-2293.
[36] Zheng Y K, Chen C, Ren D,etal. Genetic diversity of the plant endophytic fungi in a Pb-Zn mine area in Hanyuan, Sichuan Province, China. Journal of Sichuan Agricultural University, 2013, 31(3): 308-313. 郑有坤, 陈诚, 任丹, 等. 四川汉源铅锌矿区植物内生真菌的遗传多样性初步研究. 四川农业大学学报, 2013, 31(3): 308-313.
[37] Chen Y T, Ding L X, Cheng D Q,etal. Isolation and Identification of endofungi fromLiriopespicata. Journal of Laiyang Agricultural College: Natural Science, 2006, 23(1): 13-16. 陈宜涛, 丁立孝, 程东庆, 等. 麦冬内生真菌镰刀菌的分离鉴定. 莱阳农学院学报: 自然科学版, 2006, 23(1): 13-16.
[38] Sun J Q, Guo L D, Chi D F,etal. Diversity and ecological distribution of endophytic fungi in medicinal plants. Chinese Journal of Science (series C: Life Sciences), 2008, (5): 475-484. 孙剑秋, 郭良栋, 迟德福, 等. 药用植物内生真菌多样性及生态分布. 中国科学(C辑:生命科学), 2008, (5): 475-484.
[39] Collado J, Platas G, Pelaez F. Host specificity in fungal endophytic populations ofQuercusilexandQuercusfagineafrom Central Spain. Nova Hedwigia, 2000, 71(3/4): 421-430.
Distribution and rDNA-ITS sequence analysis of endophyte symbionts ofBothriochloaischaemumat a copper tailings site
CAO Miao-Wen1, JIA Tong1*, JING Ju-Hui2, CHAI Bao-Feng1
1.InstituteofLoessPlateau,ShanxiUniversity,Taiyuan030006,China; 2.InstituteofBiotechnology,ShanxiUniversity,Taiyuan030006,China
Tailing ponds are special growth environment for plants. Soils at such sites contain high concentrations of heavy metals, which affect the physiology and ecology of plants. The aim of this study was to evaluate the endophytic fungi resources at a copper mine tailings site, and to explore whether different endophytic fungi can restore diversity by altering the physical and chemical properties of soil. Therefore, we studied endophytic fungi ofBothriochloaischaemumgrowing in the Shibahe tailings pools at the Tongkuangyu Mine, a copper tailings site.B.ischaemumis the dominant species growing at this site, and it grows in several sub-dams with different recovery times. To investigate the endophytic fungi infection rate ofB.ischaemum, we collected live plants and separated the endophyte from the sheath, and observed and described the characteristics and spore morphology of each fungus. We also selected 16 strains and amplified the 5.8S-ITS region for sequencing and phylogenetic analysis. Based on their phenotypes, the endophytes fromB.ischaemumgrowing in four different sub-dams with different recovery times were separated into different groups. Most endophyte colonies were white, and the growth rate ranged from 5.515 and 12.548 mm/d. The endophytes produced spherical or oval/near oval spores, with sizes ranging from 2.085 μm to 7.072 μm. Sequence analyses showed that there were three different sequences among the 16 kinds of colonies, belonging to the generaGibberella,Fusarium, andPenicillium. The smallest genetic distance was between the sub-dam with 30-years recovery and that with 5-years recovery. The largest genetic distance was between the sub-dam with 45-years recovery and that with 15-years recovery. At copper tailings sites, different soil environments at different stages of restoration might lead to a wide diversity of endophytes infectingB.ischaemum. The results of this study provide a theoretical basis for enriching endophyte resources, and reveal some of the ecological functions of endophytes associated withB.ischaemumat a copper tailings site.
copper tailings; heavy metal;Bothriochloaischaemum; endophyte
10.11686/cyxb2016271
http://cyxb.lzu.edu.cn
2016-07-05;改回日期:2016-09-28
国家自然科学青年科学基金项目(31600308),山西省应用基础研究面上青年基金项目(201601D021101),山西省回国留学人员科研资助项目(2016-006)和山西省科技攻关项目(20150313001-3)资助。
曹苗文(1992-),女,山西汾阳人,硕士。E-mail:18234057492@163.com*通信作者Corresponding author. E-mail:jiatong@sxu.edu.cn
曹苗文, 贾彤, 景炬辉, 柴宝峰. 铜尾矿库白羊草内生真菌的分布及rDNA-ITS系统发育. 草业学报, 2017, 26(5): 163-172.
CAO Miao-Wen, JIA Tong, JING Ju-Hui, CHAI Bao-Feng. Distribution and rDNA-ITS sequence analysis of endophyte symbionts ofBothriochloaischaemumat a copper tailings site. Acta Prataculturae Sinica, 2017, 26(5): 163-172.
