沙冬青种子总黄酮测定方法及纯化工艺研究
2017-05-19陶波方梅张嘉男欧云文贾宁
陶波 方梅 张嘉男 欧云文 贾宁
(甘肃农业大学动物医学院,兰州 730070)
沙冬青种子总黄酮测定方法及纯化工艺研究
陶波 方梅 张嘉男 欧云文 贾宁
(甘肃农业大学动物医学院,兰州 730070)
旨在建立沙冬青种子总黄酮测定方法及沙冬青种子总黄酮纯化工艺。选用常用4种黄酮显色方法,通过紫外波长扫描分别确定槲皮素为对照品及沙冬青种子总黄酮的最佳吸收波长,建立标准曲线,并对各测定方法进行方法学验证,利用新建立的条件方法对沙冬青种子总黄酮进行含量测定;实验选择AB-8、D101、S-8型大孔树脂通过静态吸附及解析试验,筛选出AB-8型大孔树脂进行动态试验,建立大孔树脂纯化工艺条件,进一步通过乙酸乙酯进行萃取,提高其总黄酮纯度。结果显示,以槲皮素为对照品,采用AlCl3-CH4O显色法,在检测波长为335 nm条件下可对沙冬青种子总黄酮含量进行有效测定;AB-8型大孔树脂在上样液浓度为6 mg/mL、上样液pH5.5、上样液体积5 BV、上样液流速3.5 BV/h条件下吸附,以70%乙醇、洗脱液流速1.5 BV/h、洗脱液体积6 BV条件下洗脱,沙冬青种子总黄酮含量由纯化前5.69%提高到41.07%;用AB-8树脂纯化后的总黄酮配置成一定浓度溶液后用乙酸乙酯萃取,总黄酮含量达到76.15%。
沙冬青种子;总黄酮;AlCl3显色法;大孔树脂;萃取;纯化
沙冬青为豆科旱生植物,主要分布于我国西北、蒙古国和俄罗斯。沙冬青也是甘肃与阿拉善戈壁荒漠唯一的强旱生常绿灌木,其种子可提取特种工业用油,枝叶入药,可祛风、活血、止痛、外用主治冻疮、慢性风湿性关节炎等[1]。研究表明,从沙冬青种子中分离、提取的沙冬青主要成分是生物碱;其次是黄酮类化合物[2],黄酮类化合物不仅具有良好的抑菌特性[3,4],而且也具有良好的免疫增强作用[5]和抗肿瘤的作用[6]。
目前,常用总黄酮含量测定方法主要有薄层色谱扫描法、紫外-可见分光光度法、高效液相色谱法、超临界流体色谱法和毛细管电泳法等几种主要的方法。其中紫外-可见分光光度法检测植物中总黄酮的方法具有操作简便,检测成本低廉的特点常被作为主要的测定方法[7]。但由于植物中提取物成分非常复杂,所含总黄酮种类也有所差异,同时,由于选用的检测试剂不同可能也会对沙冬青种子总黄酮测定结果造成误差[8]。本实验针对沙冬青种子总黄酮用槲皮素为对照品,应用紫外-可见分光光度法在不同显色体系中进行含量测定,并分别对其进行方法学验证,建立一种更加可靠、有效的含量测定方法。其次,由于沙冬青种子总黄酮粗提物中总黄酮含量较低且成分复杂,单一使用乙酸乙酯萃取方法效率低且成本较高,而单一使用大孔树脂纯化后,总黄酮含量有所提高,但实际应用价值较低。因此,建立高效的沙冬青种子总黄酮纯化工艺,提高其应用价值具有现实意义。本实验首先使用大孔树脂对其进行富集与纯化[9,10],分别考察了上样液浓度,上样液体积,pH值,洗脱液乙醇浓度,洗脱流速,洗脱液体积对吸附及洗脱效果的影响,然后进一步通过乙酸乙酯萃取方法对沙冬青种子总黄酮进行萃取,通过两者的结合,有效的提高了总黄酮含量,从而确定最佳纯化工艺路径。
1 材料与方法
1.1 材料
沙冬青种子购于宁夏西贝农林牧生态科技有限公司,干燥粉碎后备用。无水乙醇,石油醚,甲醇,亚硝酸钠,硝酸铝,氢氧化钠,乙酸乙酯,无水三氯化铝均为分析纯,购于天津光复化学试剂公司,槲皮素标准品(CAS#117-39-5,LOT:C20J6Y1722,HPLC≥98%)上海源叶生物科技有限公司,AB-8型树脂,D-101型树脂,S-8型树脂均购于天津市光复化工研究所。
1.2 方法
1.2.1 沙冬青种子中总黄酮粗品溶液制备 称取一定量沙冬青种子粉末在提取工艺为温度40℃,乙醇体积分数为70%,提取时间为50 min,料液比为20 g/mL得到沙冬青种子总黄酮粗提液于60℃对其进行干燥处理,研磨过筛获得总黄酮粗品。将总黄酮粗品用70%(V/V)乙醇配置成一定浓度溶液后作为待测样品溶液备用。
1.2.2 不同显色方法 直接测定法:准确吸取样品溶液0.2 mL,用60%乙醇溶液定容至25 mL,充分混匀后,静置5 min后测定吸光度;NaOH显色法[11]:准确吸取样品溶液0.2 mL,加入60%乙醇溶液2 mL,4% NaOH溶液1 mL,混匀后静置显色5 min后以60%乙醇溶液定容至25 mL,测定吸光度;NaNO3-Al(NO3)3-NaOH法显色法:准确吸取样品稀释液0.2 mL,加入蒸馏水2 mL,混匀后加入5% NaNO3溶液1 mL,充分混匀,反应6 min后加入10% Al(NO3)3溶液1 mL,充分混匀,6 min后加入4% NaOH溶液4 mL,混匀后静置显色15 min后以蒸馏水定容至25 mL,测定其吸光度;AlCl3-CH4O显色法[12]:准确吸取样品溶液0.2 mL,以0.01 mol/L AlCl3-CH4O溶液定容至25 mL,充分混匀后,静置10 min后测定吸光度。
1.2.3 最佳检测方法的建立 准确吸取一定量的沙冬青总黄酮待测液和槲皮素标准液,按1.2.2中显色方法进行显色处理,分别在200-600 nm条件下进行波长扫描。根据扫描光谱图选定最佳待测吸收波长,分别以建立以槲皮素为对照品在4种显色方法下的标准曲线,并对4种显色方法在选定的最佳波长下进行精密度、重复性及加样回收率测定。
1.2.4 沙冬青总黄酮纯度测定 按上述1.2.3确立的最佳检测方法,测定吸光度A,根据槲皮素总黄酮含量C(mg/mL)与吸光度A的线性回归方程计算样品溶液中总黄酮的含量 C(mg/mL)。通过计算,得出沙冬青种子中总黄酮提取物的纯度。
1.2.5 大孔吸附树脂型号选择 称取预处理过的大孔吸附树脂1.0 g置于100 mL锥形瓶中,加入50 mL已知浓度的沙冬青黄酮粗提物溶液,放置于恒温振荡器,室温避光振摇12 h使总黄酮充分吸附,过滤,准确量取一定量剩余液,测定剩余液中总黄酮浓度,按照公式(1)计算其吸附率;将吸附饱和的树脂过滤,精密加入70%的乙醇50 mL后放置于恒温振荡器,室温避光振摇12 h使总黄酮充分解析,取滤液过滤后测定解析液中总黄酮浓度,按照公式(2)。

式中,C0为沙冬青样品液初始总黄酮浓度(mg/mL),C1为吸附平衡后沙冬青总黄酮浓度(mg/mL),C2为解析液中沙冬青总黄酮浓度(mg/mL)。
1.2.6 AB-8大孔吸附树脂吸附性能实验
1.2.6.1 大孔吸附树脂对沙冬青种子中黄酮静态吸附动力学实验 称取预处理好的AB-8大孔吸附树脂1.0 g于100 mL锥形瓶中,加入50 mL一定浓度的样品溶液,封口,于台式恒温震荡器中,室温下避光振摇,每小时各取1 mL,测定其黄酮浓度,考察吸附时间对AB-8大孔吸附树脂对沙冬青种子中总黄酮的吸附影响。
1.2.6.2 样品液浓度对吸附性能的影响 配置浓度分别为0.61、1.83、3.05、4.27、5.76、6.71、7.93、9.15、10.37和11.59 mg/mL的沙冬青黄酮粗提物样品液各50 mL,分别加入盛有1.0 g树脂的锥形瓶,封口,置于恒温振荡器,室温避光振摇6 h,使其充分吸附。过滤后,测定滤液中总黄酮浓度,确定树脂的最佳吸附浓度。
1.2.6.3 上样液pH值对吸附的影响 称取预处理好的AB-8大孔吸附树脂1.0 g于锥形瓶中,各加入50 mL浓度为6 mg/mL样品溶液,pH值分别调至3、4、5、6和7,封口,放置在恒温振荡器上,室温避光振摇6 h,考察不同上样液pH值对AB-8大孔吸附树脂对沙冬青种子中总黄酮的吸附影响
1.2.6.4 上样液流速对吸附效果的影响 称取预处理好的AB-8大孔吸附树脂装柱,浓度为6 mg/mL上样液分别以2 BV/h、3 BV/h、4 BV/h和5 BV/h过柱吸附,每10 mL收集一次液体,绘制曲线,确定最佳吸附流速。
1.2.6.5 AB-8 大孔吸附树脂动态吸附条件正交试验 在单因素条件实验的基础上,选择上样液浓度、上样液pH、上样液流速进行正交实验,进一步对影响沙冬青种子总黄酮吸附的条件进行优化。
1.2.7 AB-8 大孔吸附树脂动态洗脱性能实验
1.2.7.1 动态吸附透过实验 称取预处理好的AB-8大孔吸附树脂30.0 g装柱,浓度为6 mg/mL,流速为3.5 BV/h过柱,每10 mL收集一次液体,测定流出液吸光值并计算其浓度。
1.2.7.2 洗脱液浓度对解析效果的影响 本实验采用乙醇溶液为洗脱剂,在洗脱剂流速为1 BV/h下,分别在乙醇体积分数为60%、70%和80%下进行洗脱,考察不同体积分数的乙醇溶液对AB-8大孔吸附树脂解析的影响。
1.2.7.3 洗脱流速对解析效果的影响 将吸附饱和的大孔吸附树脂滤干,以70%乙醇作为洗脱液,控制流速1 BV/h、1.5 BV/h、2 BV/h和2.5 BV/h(为吸附流速的1/2),每10 mL收集一次液体。考察不同洗脱流速对AB-8大孔吸附树脂解析的影响。
1.2.7.4 洗脱液用量对解析效果的影响 将吸附饱和的大孔吸附树脂滤干,以70%乙醇,流速为1.5 BV/h进行洗脱,每10 mL收集一次液体,测定其吸光度,确定其充分洗脱时所需的洗脱液用量。
1.2.8 乙酸乙酯对沙冬青种子中总黄酮萃取 称取一定量由AB-8 大孔吸附树脂纯化的总黄酮粉末,配置成一定浓度的溶液后,用乙酸乙酯按体积1∶1进行萃取(一般萃取3-4次),收集乙酸乙酯相于60℃进行减压蒸馏浓缩,干燥至恒重后测定总黄酮含量。
2 结果
2.1 沙冬青种子中总黄酮测定方法建立
2.1.1 沙冬青种子总黄酮粗提物及槲皮素不同显色方法下波长测定 由于槲皮素对照品与沙冬青种子总黄酮粗提物最大扫描波长存在差异,为提高沙冬青种子中总黄酮含量检测的真实性,减少实验误差,以沙冬青种子总黄酮粗提物显色后扫描结果为主,通过扫描波长数据图谱(图1),确定其各显色方法下的最大吸收波长。直接法:280 nm和325 nm;NaOH法:285 nm和 393 nm;NaNO3-Al(NO3)3-NaOH法:335 nm和390 nm;AlCl3-CH4O法:303 nm和335 nm。在各显色方法下选择最佳吸收波长,建立标准曲线并进行方法学验证。

图1 槲皮素对照品及沙冬青种子总黄酮粗提物波长扫描结果
2.1.2 以槲皮素为标准品在不同显色方法下建立标准曲线 由表1可知,槲皮素在4种显色方法下,根据2.1.1所选择对应的最大吸收波长获得的标准曲线均呈较好的线性关系,通过线性方程计算得出的值可靠有效。

表1 槲皮素标准品4种显色方法下的标准曲线
2.1.3 沙冬青种子总黄酮粗提物在不同显色方法下方法学验证 由表2可知,4种显色方法紧密度RSD值较低,即紧密度都相对较好。直接法重现性RSD值较其他3种显色方法大,且加样回收率低,即该方法测得的总黄酮含量数值偏低;NaOH法加样回收率较大,重现性RSD值较大但在误差范围内,但其稳定性较差;NaNO3-Al(NO3)3法重现性RSD值大,稳定性也差。AlCl3-CH4O法稳定性、重现性RSD值较小,且回收率也较好。综合2.1.1最大扫描波长数据图谱分析,以槲皮素为对照品,通过AlCl3-CH4O显色法在检测波长为335 nm下对沙冬青种子总黄酮粗提物含量测定操作方法简单,具有很好的稳定性、重复性和准确度等优点。
2.1.4 待测样品溶液总黄酮含量测定 将5份待测样品测得的吸光值A求得平均值后,利用所得标准曲线回归方程计算得出待测溶液中总黄酮的浓度为1.249 mg/mL(表3),沙冬青种子总黄酮粗提取物含量为5.69%。

表2 沙冬青种子中总黄酮4种显色方法方法学验证

表3 待测样品溶液吸光值
2.2 AB-8大孔吸附树脂对沙冬青种子中总黄酮纯化条件
2.2.1 不同型号大孔吸附树脂对沙冬青总黄酮吸附率及解析率 通过表4可知,在相同条件下树脂的类型不同,对总黄酮吸附和解析能力也有所差异。实验结果表明,S-8型大孔树脂吸附能力最强,
D101大孔树脂吸附能力略强于AB-8大孔树脂;S-8型大孔树脂解析能力最差,AB-8型大孔树脂解析能力强于D101型大孔树脂。综合上述情况,选择AB-8型大孔树脂作为纯化所用树脂。

表4 3种大孔吸附树脂静态吸附及解吸性能
2.2.2 AB-8大孔吸附树脂吸附性能的实验
2.2.2.1 大孔吸附树脂对沙冬青种子中黄酮静态吸附动力学实验 由图2可知,随着时间的增加,剩余液总黄酮浓度逐渐减少,在0-3 h内,总黄酮浓度迅速减小,当达到6 h时,剩余液总黄酮浓度随时间增加几乎不变,说明AB-8树脂对沙冬青种子中总黄酮的吸附快速达到吸附饱和,因此AB-8大孔树脂适合进行沙冬青种子中总黄酮的纯化。

图2 AB-8大孔吸附树脂静态吸附动力学曲线
2.2.2.2 样品液浓度对吸附性能的影响 由图3可知,AB-8大孔树脂吸附能力随上样液浓度增加而增强,在总黄酮较低浓度时,溶液中杂质与总黄酮存在竞争而使其吸附率较低。当总黄酮浓度过高时,容易导致总黄酮分子之间发生聚沉而黏附于树脂表面,不利于树脂吸附。因此,当总黄酮粗体物上样液浓度确定为6 mg/mL时,吸附效果较好。

图3 上样液浓度对吸附性能影响
2.2.2.3 上样液pH值对吸附的影响 由图4可知,上样溶液在弱酸性条件下,大孔树脂吸附效果较好,pH值为5的时候,吸附效果最好,当溶液酸性过强,黄酮类化合物容易转为佯盐导致吸附率下降。
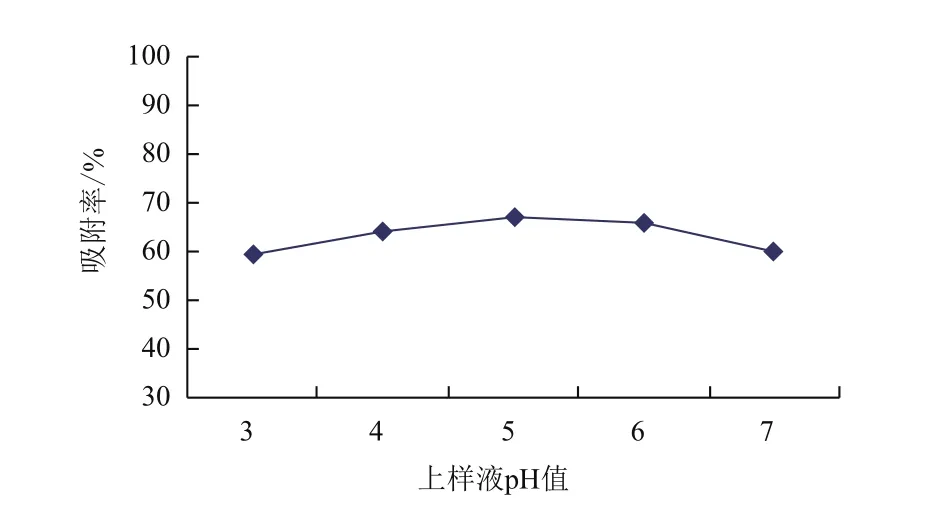
图4 上样液pH值对吸附性能的影响
2.2.2.4 上样液流速对吸附的影响 由图5可知,当上样液流速为2 BV/h时,吸附效果最好,随着上样流速增大,溶液中总黄酮不能充分被大孔树脂吸附导致吸附率降低。为了保证大孔树脂充分利用及提高生产效率,实验选用最佳上样流速为3 BV/h。

图5 上样液流速对吸附率的影响
2.2.2.5 AB-8 大孔吸附树脂动态吸附条件正交试验 正交实验设计表如表5所示。正交实验极差分析显示,影响AB-8大孔吸附树脂吸附的诸因素的主次关系依次是上样液流速(D)>上样液浓度(A)>pH值(B)。从表6可以得出最佳组合为A2B1D3,即上样液浓度6 mg/mL、pH值5.5、上样液流速3.5 BV/h,在此条件下沙冬青种子总黄酮吸附率达到87.33%。

表5 吸附工艺正交实验设计表

表6 L9(34) 正交实验设计与结果
2.2.3 AB-8 大孔吸附树脂动态渗漏试验 由图6可知,随着上样液体积增加,流出液黄酮浓度逐渐升高,表明树脂逐渐趋于饱和平衡。当上样液体积达到5 BV时,随着上样液体积增加,流出液总黄酮浓度与初始浓度相同且不再变化,表明AB-8树脂吸附达到饱和。

图6 动态吸附渗露曲线
2.2.4 AB-8大孔吸附树脂动态解析性能的试验
2.2.4.1 解析液浓度对解析效果的影响 由图7可知,用60%乙醇进行洗脱时相比70%、80%乙醇洗脱峰型较宽且完全洗脱黄酮所需乙醇体积更多,70%乙醇与80%乙醇峰型接近,综合成本考虑,选择70%乙醇作为洗脱条件。

图7 不同浓度乙醇的洗脱曲线
2.2.4.2 洗脱液流速对洗脱效果的影响 由图8可知,当上样液流速为1 BV/h的时候,洗脱效果最好。随着洗脱液流速增加使得洗脱液与大孔树脂作用时间减少,被吸附的总黄酮不能充分解析,造成解析率减低。洗脱流速过慢则会增加生产周期,为提高总黄酮得率及缩短生产周期,实验选择最佳洗脱流速为1.5 BV/h。

图8 不同洗脱流速的渗漏曲线
2.2.4.3 洗脱液用量对洗脱效果的影响 由表7可知,随着洗脱液用量增加,洗脱液中黄酮含量逐渐增加。当洗脱液用量达到6 BV时,洗脱液黄酮含量随洗脱液用量增加而增加量极小,考虑到成本,确定洗脱液用量为6 BV。

表7 不同体积70%乙醇洗脱效果
3 讨论
3.1 沙冬青种子总黄酮测定方法
目前总黄酮的测定主要以芦丁、槲皮素作为对照品,通过AlCl3-CH4O法和NaNO3-Al(NO3)3-NaOH法进行显色,但由于NaNO3-Al(NO3)3-NaOH法使用的试剂较多且不同植物所提取的总黄酮成分有所差异,对检测带来很大误差。本实验选用槲皮素为对照品,通过4种显色方法对沙冬青种子总黄酮进行显色,分别对其进行波长扫描后发现经AlCl3-CH4O法显色后,沙冬青种子总黄酮在303 nm和335 nm处均出现明显的最大吸收峰,通过方法学验证可知AlCl3-CH4O法在335 nm处精密度、重现性、稳定性的相对标准偏差(RSD)分别为0.541%、1.05%、0.62%,均在误差范围以内,其加样回收率达到102.57%,故以槲皮素为对照品在波长335 nm通过AlCl3-CH4O法显色后测定沙冬青种子总黄酮的方法可行,能为更加准确检测沙冬青种子总黄酮提供依据。
3.2 沙冬青种子总黄酮纯化工艺
由于沙冬青种子总黄酮粗提物中总黄酮含量较低且成分复杂,常单一使用乙酸乙酯萃取方法效率低且成本较高,而单一使用大孔树脂纯化后,总黄酮含量有所提升,但实际应用价值较低。本实验分别挑选S-8(极性),AB-8(弱极性),D101(非极性)三种大孔树脂,通过试验选择出吸附和解析性能相对较好的AB-8型大孔树脂,分别从上样液浓度,上样液体积,上样液流速,pH值,洗脱液乙醇浓度,洗脱流速,洗脱液体积对吸附及洗脱效果的影响进行考察,从而确定最佳纯化工艺,纯化后沙冬青种子总黄酮含量由纯化前5.69%提高到41.07%;经大孔树脂纯化后的总黄酮,配置成一定浓度溶液后用乙酸乙酯萃取,总黄酮含量达到76.15%。
4 结论
以槲皮素为对照品在波长335 nm通过AlCl3-CH4O法显色后测定沙冬青种子总黄酮的方法可行,能为更加准确检测沙冬青种子总黄酮提供依据。
确定最佳纯化工艺为:上样液浓度6 mg/mL、上样液体积5 BV、上样液流速3 BV/h,洗脱液为70%乙醇、洗脱液流速1.5 BV/h、洗脱液体积6 BV,纯化后沙冬青种子总黄酮含量由纯化前5.69%提高到41.07%;经大孔树脂纯化后的总黄酮,配置成一定浓度溶液后用乙酸乙酯萃取,总黄酮含量达到76.15%。该工艺可行性高,可用于沙冬青种子总黄酮的纯化,使其具有更好的应用价值。
[1] 王庆锁, 李勇. 珍惜濒危植物沙冬青研究概况[J]. 生物多样性, 1995, 3(3):153-156.
[2]冯文娟, 欧阳发, 苏亚伦, 等. 蒙古沙冬青的化学成分[J]. 中国中药志, 2011:36(8):1040-1042.
[3]方菊. 竹叶黄酮的提取分离及抑菌效果研究[D]. 合肥:合肥工业大学, 2012:50-56.
[4]周玮靖, 佀国涵, 孙智达, 等. 荔枝皮黄酮抑菌性能及其作用机理研[J]. 天然产物研究与开发, 2011, 23(2):332-336.
[5]王志宏, 雷明盛, 彭胜, 等. 杜仲黄酮对小鼠淋巴细胞增殖及IL-2和IFN-γ诱生的影响[J]. 天然产物研究与开发, 2016(4):514-518.
[6]Jia ZS, Tang MC, Wu JM. The determination flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64:555-559.
[7]周晨, 谢宛玉. 黄酮类化合物诱导肿瘤细胞凋亡分子机制研究进展[J]. 中国医药导报, 2010, 7(10):18-19.
[8]吕国红, 钟晓凌, 李良, 等. 枳椇子总黄酮测定方法的比较分析[J]. 湖北工业大学学报, 2009, 24(1):9-12.
[9]顾媛媛, 代金红, 王建明, 等. 大孔树脂对凤仙透骨草总黄酮的纯化研究[J]中医药学报, 2013, 41(4):79-81.
[10]冉靓, 武子敬, 冉阳, 等. 大孔吸附树脂纯化板栗壳总黄酮的研究[J]. 安徽农业科学, 2013, 41(2):827-829.
[11]董怡, 林恋竹, 赵谋明. 光果甘草叶总黄酮测定方法[J]. 食品科学, 2013, 34(6):195-197.
[12]丁明玉, 赵纪萍, 李擎阳. 贯叶金丝桃提取物中总黄酮的测定方法[J]. 分析实验室, 2001, 20(6):45.
[13]邱佳妹, 周爱存. 马尾松松针总黄酮纯化工艺的研究[J]. 2013, 34(5):247-250.
(责任编辑 李楠)
Determination and Purification of Total Flavonoids from Seeds of Ammopiptanthus mongolica
TAO Bo FANG Mei ZHANG Jia-nan OU Yun-wen JIA Ning
(College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070)
This work is to establish the determination and purification method of total flavonoids from seeds of Ammopiptanthus mongolica. Four chromogenic methods were chosen for the determination of total flavonoids,the best absorption wavelengths were selected by UV-wavelength scanning of quercetin standard and total flavonoids from seeds of A. mongolica. Standard curves for quercetin by four chromogenic methods were built,and each method was verified via methodology,and the new experimental condition and method after verification were used to determine the content of total flavonoids from seeds of A. mongolica. In this experiment,3 kinds of macroporous resins of AB-8,D101,and S-8 were selected for static adsorption and elution test,and AB-8 was chosen for dynamic test,with which the process condition for purifying total flavonoids from seeds of A. mongolica was established,and the extraction was conducted with ethyl acetate to improve the purity of total flavonoid. The results showed that the determination of total flavonoids from seeds of A. mongolica with AlCl3-CH4O chromogenic method at 335 nm and quercetin as the standard substance was reliable and effective. Under the optimal condition,adsorption with AB-8 macroporous resins was 5 BV of 6 mg/mL sample solution at pH 5.5 at rate of 3.5 BV/h,and then elution was 6 BV of 70% ethanol at rate of 1.5 BV/h,the purity of the product was 41.07% from 5.69% before purification. The total flavonoids after purified with AB-8 resin were prepared into a certain concentration solution,and then extracted with ethyl acetate,the total flavonoids content reached 76.15%.
seeds of Ammopiptanthus mongolica;total flavonoids;AlCl3chromogenic method;macroporous resin;extraction;purification
10.13560/j.cnki.biotech.bull.1985.2017.05.009
2016-10-30
国家自然科学基金项目(31560686)
陶波,男,硕士研究生,研究方向:动物病理学及新兽药研发;E-mail:315661125@qq.com
贾宁,男,硕士生导师,教授,研究方向:动物疾病病理与免疫病理学;E-mail:jianing@gansu.edu.cn
