基于多胺转运系统的抗肿瘤药物研究进展
2017-05-19李建明丁劲松
李建明 丁劲松
(中南大学湘雅药学院,长沙 410013)
基于多胺转运系统的抗肿瘤药物研究进展
李建明 丁劲松
(中南大学湘雅药学院,长沙 410013)
多胺是维持细胞生长分化等生命活动的必需物质。肿瘤的增殖与细胞内多胺水平密切相关,利用肿瘤细胞膜表面高表达的多胺转运系统介导多胺类似物和缀合物进入细胞,可耗竭细胞内多胺并诱导肿瘤细胞凋亡。也可利用多胺聚阳离子的结构特点进行基因递送,提高外源基因的转染效率。综述了基于多胺转运系统的多胺类似物,缀合物和基因递送的癌症治疗研究进展,旨为以多胺结构为基础的抗肿瘤药物研究提供参考。
多胺转运系统;多胺类似物;多胺缀合物;肿瘤靶向;基因递送
多胺是广泛存在于生物体内的脂肪族有机阳离子化合物。天然多胺包括腐胺(Putrescine,PUT),亚 精 胺(Spermidine,SPD) 和 精 胺(Spermine,SPM)(图1-A),其对细胞增殖、分化、染色质构象维持、离子通道调节和细胞膜稳定性维持等具有重要作用[1,2]。哺乳动物通过鸟氨酸-尿素循环生成多胺,鸟氨酸脱羧酶(Ornithine decarboxylase,ODC)和S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxylase,S-AdeMetDC)是多胺合成的限速酶[3]。在生理条件下,细胞内多胺水平受其生物合成、代谢和细胞膜上多胺转运系统(Polyamine transport system,PTS)的精密调控,维持细胞周期的正常运转。在病理条件下,特别是肿瘤的发生发展中,常伴随多胺代谢异常[4]。肿瘤细胞的增殖需要细胞内高多胺水平促进DNA复制、蛋白质合成和肿瘤组织血管生成,因而多胺合成酶活性上调,细胞膜上PTS高表达[5]。
PTS是一种特殊结构的膜蛋白,肿瘤细胞膜上过表达的PTS可特异性地将外源多胺转运入胞,以满足肿瘤生长对多胺的旺盛需求。PTS不仅能转运多胺物质,还能转运很多基于多胺结构的分子。其对底物基本要求如下(图1-B):(1)具有2个及以上正氮原子;(2)氮原子周围带最大正电荷;(3)氮原子间最佳距离约为4个亚甲基长度;(4)具有非极性结构且空间位阻小[6,7]。利用PTS对底物分子泛宿主性的特点,设计合成结构多样的多胺类似物和缀合物。这些化合物不具备天然多胺的生理功能,而是抑制多胺合成酶的表达、诱导多胺代谢酶的活性或竞争性阻碍癌细胞对外源性多胺的摄取,耗竭细胞内多胺而诱导细胞凋亡[8],是一种具有重要临床应用前景的抗肿瘤手段。此外,多胺骨架中氮原子携带正电荷,可与带负电的生物大分子如DNA、RNA等结合,为肿瘤治疗基因、多肽类大分子等药物的入胞递送提供了可能[9]。本文综述了近年来多胺类似物、缀合物,以及基于多胺的基因递送系统在抗肿瘤治疗方面的研究进展,旨为基于多胺转运系统的抗肿瘤药物的研究和设计提供参考。
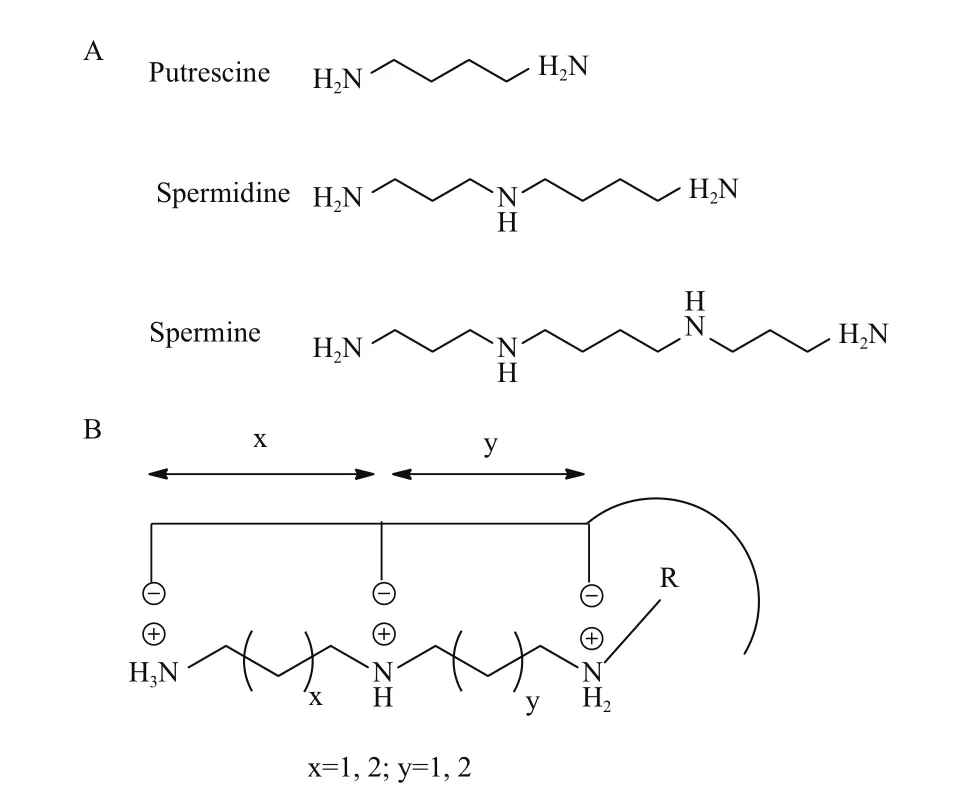
图1 天然多胺(A)及多胺转运系统底物结构模型(B)
1 多胺类似物
1.1 端基对称取代的多胺类似物
多胺类似物的合成最早是从天然多胺的端基对称修饰开始的,最典型的是精胺和亚精胺的端基双乙基化,如双乙基异精胺[N1,N11-bis(ethyl)norspermine,BENSpm],双乙基精胺[N1,N12-bis(ethyl)spermine,BESpm]和双乙基高精胺[N1,N14-bis(ethyl)homospermine,BEHSpm](图2-A)。它们可通过PTS的识别大量转运入胞,抑制多胺合成酶ODC和S-AdeMetDC,同时上调精胺/亚精 胺-乙 酰 基 转 移 酶(Spermidine/spermine N1-acetyltransferase,SSAT),快速耗竭细胞内多胺而抑制肿瘤增殖[10]。此类化合物修饰铂(Pt),钯(Pd)等金属离子后,可对细胞增敏,具有更强的DNA损伤效果[11]。大量研究表明,末端取代基大于乙基时,该类化合物的活性显著下降;基于精胺修饰的4胺类似物的抗癌效果普遍优于基于亚精胺修饰的3胺类似物;且具有3-3-3碳链骨架的化合物整体抗肿瘤活性高于3-4-3骨架结构的化合物[12,13]。
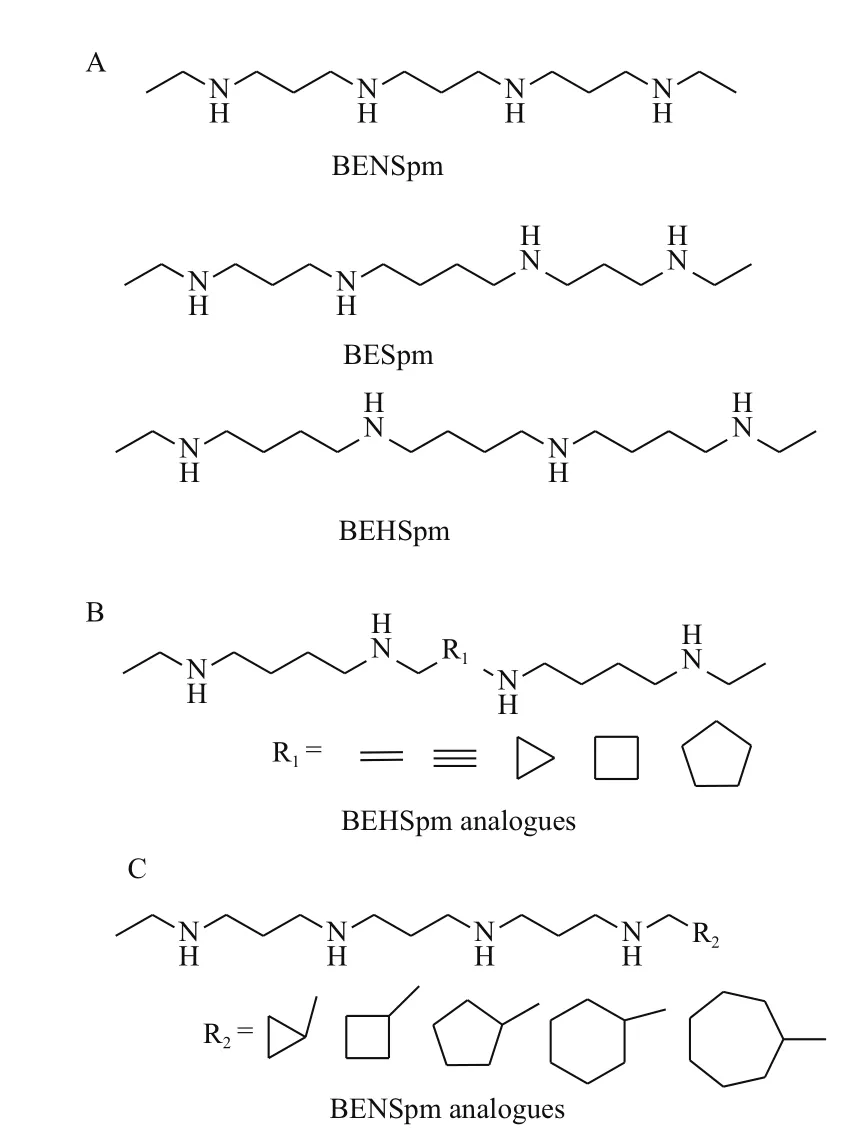
图2 多胺类似物的各代表化合物
将多胺中央碳链用双键、三键或环烷基等部分代替,可得到第二代端基对称取代的多胺类似物。这类化合物构象或旋光性的改变会影响其与DNA的结合形式,使其抗癌活性表现出较大差异。如将BEHSpm中央丁烷部分用1,2-环丙烷取代后,其对前列腺癌DU145和DUPro细胞的IC50值降低了2倍以上,且顺式结构的抑癌效果要优于反式结构。但当取代基增至四元环或五元环时(图2-B),较大的空间位阻会使化合物活性显著降低[14]。研究表明,多胺骨架碳-碳链的转动自由度有利于其与DNA、RNA等生物大分子结合而发挥抗肿瘤作用,当部分碳链旋转受限时,会降低或完全丧失多胺类似物的抗癌特性[15]。
1.2 端基不对称取代的多胺类似物
由于多胺骨架内部和端基氮原子选择性保护的问题,直到20世纪90年代才首次合成了端基不对称取代的多胺类似物。它们具有更强的DNA结合力和细胞杀伤效果。最典型的是将BENSpm改性为N1-炔丙基-N11-乙基异精胺(N1-propargyl-N11-ethylnorspermine,PENSpm)或N1-(环丙基)-N11-乙基异精胺(N1-cyclopropyl-methyl-N11-ethylnorspermine,CPENSpm,图2-C)后,具有更强的细胞周期毒性,且对SSAT有高度诱导效果,能更迅速地耗竭细胞内多胺而诱导细胞凋亡[12]。当BENSpm末端取代基由三元环增至七元环时,对SSAT诱导作用逐渐降低,对精胺氧化酶(Spermine oxidase,SMO)具有一定的诱导活性,产生过氧化氢而增强细胞氧化应激。其中,七元环取代的BENSpm(N1-cycloheptylmethyl-N11-ethylnorspermin,CHENSpm)可影响非小细胞肺癌H157细胞的微管蛋白聚合并诱导细胞G2/M期阻滞[16,17]。
2 多胺缀合物
多胺缀合物是将抗肿瘤疗效确切的药物缀合多胺骨架结构,通过PTS提高药物的肿瘤靶向性。同时,多胺骨架带有的正电荷可增加多胺缀合物与细胞内DNA的相互作用,增强化合物对DNA的杀伤效果(图3)。目前研究较广泛的为萘酰亚胺类多胺缀合物。萘酰亚胺类化合物是一种抗肿瘤效果良好的DNA嵌入剂,但其具有骨髓抑制,神经毒性等不良反应[18]。将此类化合物与二胺或三胺骨架结合,可提高其对肿瘤细胞的选择性。研究表明,3-乙酰基-萘酰亚胺-精胺缀合物可诱导HepG2细胞产生大量活性氧簇,激活线粒体凋亡途径,将细胞增殖阻滞于S期[19]。3,6-二硝基-萘酰亚胺-精胺缀合物可通过氢键和静电作用插入DNA碱基对之间,阻碍DNA的损伤修复而诱导细胞凋亡,且其对白血病细胞(K562)、人乳腺癌细胞(MB-231)和肝癌细胞(7721)的活性优于处于III期临床实验阶段的萘酰亚胺类药物氨萘非特(Amonafide)[20]。此外,许多具有平面刚性结构的药效团缀合多胺骨架后,也具有良好的肿瘤细胞选择性。如蒽-高精脒缀合物Ant-4,4可阻滞HL-60细胞的G1-S期转变[21]。卟啉-多胺系列缀合物可诱导HaCat和MCF-7细胞的程序性凋亡[22]。氮杂-亚精胺和苯并氮杂卓-精胺系列缀合物可高度亲和PTS,抑制细胞对外源性多胺的摄取,对L1210细胞具有较好的抗增殖效果[23]。

图3 多胺缀合物的构效关系模型
目前研究得较成功的多胺缀合物为表鬼臼毒素(依托泊苷)键合精胺得到的化合物F14512,已进入II期临床研究[24,25]。与母体化合物依托泊苷相比,F14512对PTS的选择性和亲和性较强,可显著抑制白血病,肺癌和乳腺癌等多种癌细胞的增殖[26]。其他抗癌药物偶联多胺也显示出良好的抗癌效果。如在喜树碱(Camptothecin,CPT)C21位羧基引入精胺,亚精胺,高亚精胺等多胺侧链,可改善CPT的水溶性并增加其与DNA拓扑异构酶I的结合效力。其中,CPT-亚精胺缀合物具有较稳定的DNA损伤效果,其对NCI-H460细胞的抗癌效果优于其他链长的CPT-多胺缀合物[27]。研究表明,亲水性的多胺骨架可提高药物的水溶性,且调节多胺碳链长度可改变缀合物与DNA的结合位点和结合能力,对改善抗肿瘤活性化合物的溶解性和促凋亡效果具有较好的应用前景。
3 作为基因递送载体
基因治疗是癌症治疗中一种强有力的手段,但外源基因进入机体后具有易被核酸酶(DNase I)降解和难以内化进入癌细胞的缺点。正电性的多胺骨架可通过静电作用与负电性的外源性基因相结合,稳定DNA的二级和三级构象并将其压缩成多胺-DNA复合物,促进DNA的细胞内化并保护其免受DNase I降解失活。此外,多胺也可偶联壳聚糖,明胶和聚乙烯等高分子载体,制备包载DNA的多胺-阳离子纳米粒,提高DNA的选择性和转染效率[28]。
3.1 多胺-DNA复合物
多胺结合DNA磷酸骨架后,可提高DNA双螺旋结构的稳定性,形成的多胺-DNA复合物更易内化进入细胞。在考察系列多胺类似物促进寡核苷酸(triplex-forming oligonucleotide,TFO)细胞摄取的研究中发现,MCF-7细胞对1,21-二胺-4,9,13,18-四氮杂二十一烷(1,21-diamino-4,9,13,18-tetraazahenicosane,3-4-3-4-3)-TFO复合物的摄取比游离TFO增加了近6倍。提示多胺类似物的双乙基残基和亚甲基桥结构对TFO具有高亲和力,二者可形成紧实的多胺-DNA复合物而有助于细胞摄取[29]。多胺碳链的构型和旋光性也会影响其与DNA的亲和力。如立体异构对二甲基精胺的DNA压缩效果和损伤保护作用的研究中发现,与精胺和其他构型的二甲基精胺相比,R,R-二甲基精胺具有较好的DNA压缩效率,其形成的多胺-DNA复合物内化入DU145细胞后可避免质粒DNA损伤并降低细胞的氧化应激效应[30]。此外,利用刺激响应型的多胺前药压缩DNA,可在肿瘤细胞中快速释放多胺和治疗基因,协同诱导细胞凋亡。如将BENSpm用可还原的二硫键合成双(2-羟乙基)二硫化前药(DSS-BEN),制备压缩TNF-α编码的质粒DNA的复合物(图4)。其可通过PTS内化入胞并同时释放BENSpm和质粒DNA,降低B16F10和U2OS细胞内的精胺和亚精胺水平,并上调细胞内多胺代谢酶SSAT和SMO而诱导细胞凋亡。且DSS-BEN-DNA复合物的TNF-α基因转染效率和细胞杀伤效果要显著优于无二硫键的BENSpm-DNA复合物[31]。
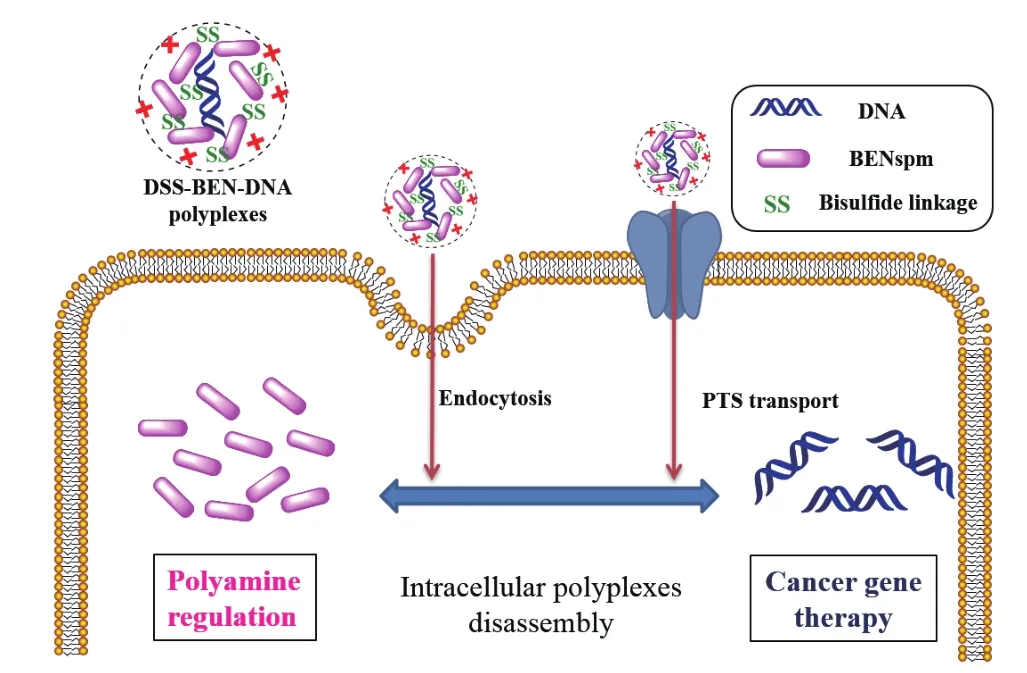
图4 DSS-BEN-DNA复合物作用机理示意图
3.2 多胺-聚阳离子纳米粒
与病毒基因载体相比,聚乙烯亚胺(PEI)、壳聚糖和多聚赖氨酸等非病毒基因载体具有免疫原性低、安全好等特点,但这些阳离子聚合物的基因转染效率较低,癌细胞选择性较差。将此类材料修饰多胺后,制备载DNA的多胺-聚阳离子纳米粒,可促进DNA的细胞摄取。同时粒子进入细胞后形成的阳离子酸性囊泡可通过质子海绵效应从溶酶体逃逸,在核定位信号的辅助下进入细胞核,增加DNA的转染效果。亲水性多胺和非病毒载体的疏水性碳链形成的两亲性结构可提高DNA的包载效率和稳定性。如用不同链长的二烷基磷酸酯、磷脂、胆固醇和系列多胺混合制备载DNA的阳离子纳米脂质体,DNA的转染效率显著优于常用的基因载体PEI,且较长碳链的二烷基磷酸酯和低分子量的多胺(如精胺和亚精胺)可形成更紧实和更小粒径的载药纳米粒,DNA的稳定性和细胞靶向性更强[32]。壳聚糖纳米粒生物可降解性和生物相容性的特点使其作为基因载体的研究日益增多,但转染效率较低的缺点限制了其进一步的应用。壳聚糖的多胺(如精胺)改性可改善其水溶性,提高生理pH的缓冲能力。与未修饰精胺的壳聚糖纳米粒相比,精胺-壳聚糖载体中的高胺含量有助于增强纳米粒的溶酶体逃逸效果,其对A549细胞的转染效率提高了近5倍[33]。此外,多胺和DNA的共递送可同时作用于多胺代谢通路和细胞核等多个靶点,增强抗肿瘤疗效。如利用pH敏感的羧醛键偶联多胺类似物胍丁胺和聚苯乙烯,制备载siRNA的阳离子纳米粒(图5)。其内化进入HepG2和MCF-7细胞后,可成功释放出胍丁胺和siRNA,同时抑制多胺合成关键酶ODC和S-AdeMetDC,并竞争性阻碍PTS摄取外源性多胺,细胞凋亡效果显著优于单独递送胍丁胺和siRNA的纳米粒[34]。随着多胺-聚合物载体材料的不断开发及其理化性质的阐明,目前已合成并表征了多胺-树枝状大分子(PAMAM-G4)和多胺-PEG等阳离子载体材料,其具有尺寸可控,高载药量和长循环等特点,有望成为安全有效的新型基因递送载体[35-37]。
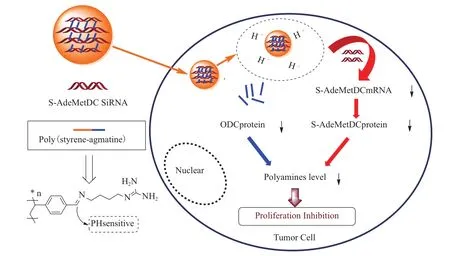
图5 聚(苯乙烯-胍丁胺)载药纳米粒作用机理示意图
4 结语
肿瘤细胞的异常增殖依赖于细胞内多胺水平的高度调控,利用多胺的结构特点合成多胺类似物和缀合物,通过多胺转运系统介导入胞,可耗竭细胞内多胺或阻碍细胞对外源性多胺的摄取,从而诱导细胞凋亡。正电性的多胺骨架可制备多胺-DNA复合物和多胺-阳离子纳米粒,增加DNA的靶向性和转染效率。但肿瘤细胞的多胺代谢受多条信号通路所调控,单一方式耗竭细胞内多胺易被其他方式所代偿。随着多胺结构构效关系的进一步阐明,以及新的多胺-阳离子载体材料的不断出现,多胺类似物、多胺缀合物和DNA的联合递送可多通路,多靶点抑制肿瘤细胞增殖,最大化发挥抗肿瘤治疗的协同效应,为基于多胺转运系统的抗肿瘤治疗药物的设计和制剂研究提供了新的前景。
[1] Wallace HM, Fraser AV, Hughes A. A perspective of polyamine metabolism[J]. Biochemical Journal, 2003, 376(1):1-14.
[2] Nowotarski SL, Woster PM, Jr CR. Polyamines and cancer: implications for chemotherapy and chemoprevention[J]. Expert Reviews in Molecular Medicine, 2013, 15(3):139-147.
[3] Igarashi K, Kashiwagi K. Modulation of cellular function by polyamines[J]. Int J Biochem Cell Biol, 2010, 42(1):39-51.
[4] Minois N, Carmonagutierrez D, Madeo F. Polyamines in aging and disease[J]. Aging, 2011, 3(8):716-732.
[5] Moinard C, Cynober L, Bandt JPD. Polyamines:metabolism and implications in human diseases[J]. Clin Nutr, 2005, 2:184-197.
[6] Gardner RA, Delcros JG, et al. N1-substituent effects in the selective delivery of polyamine conjugates into cells containing active polyamine transporters[J]. J Med Chem, 2004(24):6055-6069.
[7] Wang C, Delcros JG, Biggerstaff J. Synthesis and biological evaluation of N1-(anthracen-9-ylmethyl)triamines as molecular recognition elements for the polyamine transporter[J]. Journal of Medicinal Chemistry, 2003, 46(13):2663-2671.
[8] Jr CR, Marton LJ. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases[J]. Dressnature Reviews Drug Discovery, 2007, 6(5):373-390.
[9] Thomas TJ, Tajmir-Riahi HA, Thomas T. Polyamine-DNA interactions and development of gene delivery vehicles[J]. Amino Acids, 2016, 48(10):2423-2431.
[10] Wallace HM, Fraser AV. Polyamine analogues as anticancer drugs[J]. Biochem Soc Trans, 2003, 31(2):393-396.
[11] Silva TM, Fiuza SM, et al. Increased breast cancer cell toxicity by palladination of the polyamine analogue N 1, N 11-bis(ethyl)norspermine[J]. Amino Acids, 2014, 46(2):339-352.
[12] Casero RA Jr, Woster PM. Recent advances in the development of polyamine analogues as antitumor agents[J]. Journal of Medicinal Chemistry, 2009, 52(15):4551-4573.
[13] Casero RA Jr, Woster PM. Terminally alkylated polyamine analogues as chemotherapeutic agents[J]. Journal of Medicinal Chemistry, 2001, 44(1):1-26.
[14] Valasinas A, Sarkar A, Reddy VK, et al. Conformationally restricted analogues of 1N, 14N-bisethylhomospermine(BE-4-4-4):synthesis and growth inhibitory effects on human prostate cancer cells[J]. J Med Chem, 2001, 44(3):390-403.
[15] Mitchell JL, Leyser A, Holtorff MS, et al. Antizyme induction by polyamine analogues as a factor of cell growth inhibition[J]. Biochemical Journal, 2002, 366(2):663-671.
[16] Huang Y, et al. Molecular mechanisms of polyamine analogs in cancer cells[J]. Anti-Cancer Drugs, 2005, 16(3):229-241.
[17] Boncher T, Bi X, Varghese S, et al. Polyamine-based analogues as biochemical probes and potential therapeutics[J]. Biochemical Society Transactions, 2007, 35(2):356-363.
[18] 罗稳, 李展, 翟洋洋, 等. 萘酰亚胺多胺衍生物的合成及其抗肿瘤活性[J]. 应用化学, 2013, 30(3):265-270.
[19] 刘英杰, 等. 一种萘酰亚胺-多胺缀合物对人肝癌HepG2细胞的杀伤作用[J]. 中国药学杂志, 2016(3):207-212.
[20] 田智勇, 苏雷朋, 谢松强, 等. 萘酰亚胺-多胺缀合物的合成、生物活性和荧光光谱[J]. 有机化学, 2013(7):1514-1521.
[21] Rui T, Ghani RA, Phanstiel O, et al. Ant 4, 4, a polyamineanthracene conjugate, induces cell death and recovery in human promyelogenous leukemia cells(HL-60)[J]. Amino Acids, 2013, 44(4):1193-1203.
[22] Sarrazy V, Garcia G, et al. Photodynamic effects of porphyrinpolyamine conjugates in human breast cancer and keratinocyte cell lines[J]. J Photochem Photobiol B, 2011, 103(3):201-206.
[23] Tomasi S, Renault J, Martin B, et al. Targeting the polyamine transport system with benzazepine- and azepine-polyamine conjugates[J]. J Med Chem, 2010, 53(21):7647-7663.
[24] Mouawad F, Gros A, et al. The antitumor drug F14512 enhances cisplatin and ionizing radiation effects in head and neck squamous carcinoma cell lines[J]. Oral Oncol, 2014(2):113-119.
[25] 许晓辉, 孙陶利, 许莉莉, 等. 鬼臼毒素类新药的研发思路[J].转化医学杂志, 2014, 3(3):162-165.
[26] Thibault B, Clement E, Zorza G, et al. F14512, a polyamine-vectorized inhibitor of topoisomerase II, exhibits a marked anti-tumor activity in ovarian cancer[J]. Cancer Lett, 2016(1):10-18.
[27] Samorì C, et al. The role of polyamine architecture on the pharmacological activity of open lactone camptothecin-polyamine conjugates[J]. Bioconjug Chemi, 2008, 19(11):2270-2279.
[28] Vijayanathan V, Agostinelli E, et al. Innovative approaches to the use of polyamines for DNA nanoparticle preparation for gene therapy[J]. Amino Acids, 2014, 46(3):499-509.
[29] Thomas RM, Thomas T, Wada M, et al. Facilitation of the cellular uptake of a triplex-forming oligonucleotide by novel polyamine analogues:structure-activity relationships[J]. Biochemistry, 1999, 38(40):13328-13337.
[30] Nayvelt I, et al. DNA condensation by chiral alpha-methylated polyamine analogues and protection of cellular DNA from oxidative damage[J]. Biomacromolecules, 2010, 11(1):97-105.
[31] Zhu Y, Li J, Kanvinde S, et al. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer[J]. Molecular Pharmaceutics, 2014, 12(2):555-563.
[32] Dewa T, Asai T, Tsunoda Y, et al. Liposomal polyaminedialkyl phosphate conjugates as effective gene carriers:chemical structure, morphology, and gene transfer activity[J]. Bioconjugate Chemistry, 2010, 21(5):844-852.
[33] Jiang H, Lim H, Kim Y, et al. Chitosan-graft-spermine as a gene carrier in vitro and in vivo[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2011, 77(1):36-42.
[34] Cui PF, Xing L, et al. Polyamine metabolism-based dual functional gene delivery system to synergistically inhibit the proliferation of cancer[J]. Int J Pharm, 2016, 506(1-2):79-86.
[35] Sanyakamdhorn S, Chanphai P, et al. Encapsulation of biogenic and synthetic polyamines by nanoparticles PEG and mPEG-anthracene[J]. J Photochem Photobiol B, 2014, 130(1):30-39.
[36] Mandeville JS, Bourassa P, Thomas TJ, et al. Biogenic and synthetic polyamines bind cationic dendrimers[J]. PLoS One, 2012, 7(4):2010-2026.
[37] Chanphai P, Tajmir-Riahi HA. Thermodynamic analysis of biogenic and synthetic polyamines conjugation with PAMAM-G4 nanoparticles[J]. J Photochem Photobiol B, 2015, 155:13-19.
(责任编辑 狄艳红)
Drug Research in Cancer Therapy Based on Polyamine Transport System
LI Jian-ming DING Jin-song
(Xiangya School of Pharmaceutical Sciences,Central South University,Changsha 410013)
Polyamine is an essential substance in cells growth,differentiation and other life activities. The proliferation of tumor is closely related to the level of intracellular polyamine. Delivering polyamine analogs and conjugates into cells,mediated by polyamine transport system overexpressed on tumor cell surface,leads to the exhaustion of intracellular polyamine and then induces tumor cells apoptosis. In addition,using the positive structure characteristics of polyamine to deliver therapeutic genes may increase the transfection efficiency of exogenous genes. In order to provide reference for the research of anticancer agents based on polyamine in the future,the research progress on polyamine analogues and conjugates for treating cancer and using polyamine as a gene deliver vector are summarized here.
polyamine transport system;polyamine analogues;polyamine conjugates;tumor targeting;gene delivery
10.13560/j.cnki.biotech.bull.1985.2017.05.005
2016-09-23
国家自然科学基金资助项目(81603061,81573374),中南大学研究生自主探索创新基金资助项目(2016zzts495)
李建明,男,硕士研究生,研究方向:药物传递系统与新药给药系统;E-mail:ming199203@sina.com
丁劲松,男,博士,研究方向:药物新制剂及其生物有效性评价;E-mail:dingjs0221@163.com
