NK细胞表面Fcγ受体3A的基因多态性对NK细胞功能的影响
2017-05-19孙舒岚李晓曦苏楠都田赵张桂荣
孙舒岚,李晓曦,苏楠,都田赵,张桂荣
(中国医科大学肿瘤医院,辽宁省肿瘤医院中心实验室,沈阳110042)
NK细胞表面Fcγ受体3A的基因多态性对NK细胞功能的影响
孙舒岚,李晓曦,苏楠,都田赵,张桂荣
(中国医科大学肿瘤医院,辽宁省肿瘤医院中心实验室,沈阳110042)
目的研究自然杀伤细胞(NK)表面Fcγ受体3A(FCGR3A)的基因多态性对NK细胞功能的影响。方法取患者外周血,利用实时PCR方法确定FCGR3A基因型,在曲妥珠单抗刺激下进行体外培养。检测各基因型的NK细胞扩增倍数。同时检测NK细胞表面活化受体表达及其ADCC活性。结果体外在曲妥珠单抗刺激下,FCGR3A野生型患者的NK细胞扩增倍数是变异型的8倍左右。NK细胞活化受体表达及体外ADCC活性均高于变异型患者。结论体外实验结果表明FCGR3A的基因多态性影响NK细胞功能及对单克隆抗体的应答水平。
自然杀伤细胞;FCGR3A;基因多态性;曲妥珠单抗
自然杀伤细胞(natural killer cell,NK)表面的Fcγ受体3A(FCGR3A,CD16)存在单核苷酸多态性(single-nucleotide polymprphism,SNPs),按其第158个氨基酸V型=Valine(野生型)或者F型=Phenylalanin(突变型),可分为V/V、V/F及F/F型人群。V型FCGR3A从分子结构上与曲妥珠单抗的Fc段可以更紧密地结合,而F型的受体,和抗体药物的结合力较弱[1-2]。研究[3-4]表明,临床上V/V型患者的无复发生存期要明显高于V/F型和F/F型这两种变异型患者,提示FCGR3A的基因多态性导致曲妥珠单抗的疗效差异。
然而目前尚未有文献报道FCGR3A基因多态性对NK细胞功能的影响。因此本研究将详细解析FCGR3A基因多态性对NK细胞增殖、活化及抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)功能的影响。
1 材料与方法
1.1 细胞培养
人白血病细胞系细胞K562细胞培养于含10%胎牛血清的RPMI 1640培养基中;Her2阳性乳腺癌细胞系细胞BT-474培养于ATCC hybrid-care培养基中,在37℃、饱和湿度、5%CO2孵箱中培养,每3~4 d换液传代,取对数生长期细胞用于实验。
1.2 临床样本收集
选择年龄≥18岁、Ⅰ~Ⅱ期Her2阳性乳腺癌、ECOG≤2、2个月内未接受任何药物或治疗且签署知情同意书的患者的入组。V/V型、V/F型及F/F型患者各10例。样品采集:采集50 mL入组人群外周血,立刻进行检测及培养。
1.3FCGR3A的基因多态性检测
以FCGR3A基因序列设计合成上下游引物。上游5’-CTGAAGACACATTTTTACTCCCAA(A/C)-3’,下游5’-TCCAAAAGCCACACTCAAAGAC-3’,扩增产物大小为73 bp。并添加0.5 mmol/L dTNP,2 mmol/L MgSO4和1 U PlatinumRtaq High Fidelity polymerase及配套的High Fidelity PCR buffer。配置PCR反应体系。扩增条件:95℃5 min;95℃30 s,66℃30 s,72℃30 s,45个循环;72℃8 min。取实时PCR产物10 μL加5×上样缓冲液4 μL 3%琼脂糖凝胶电泳,EB染色,拍照并进行图像分析。根据PCR结果将患者分为V/V型,V/F型和F/F型。
1.4 NK细胞培养
将曲妥珠单抗包被在无处理的细胞培养瓶内,向其中加入从外周血中提取的单个核细胞,模拟曲妥珠单抗在体内的刺激。培养周期为14 d。为了保证NK细胞的增殖活性,所有的培养体系中均加入白细胞介素2。
1.5 活化受体检测
采集培养14 d的NK细胞,利用流式细胞分析仪检测NK细胞活化受体的表达情况(包括NKp30,Nkp44,NKp46,NKG2D)。
1.6 CD107a表达检测
将培养14 d的NK细胞与白血病细胞株K562以1∶1的比例混合,37℃、饱和湿度、5%CO2孵箱中培养4 h。用流式细胞仪检测NK细胞表面的CD107a表达。未与K562细胞混合的NK细胞CD107a表达作为基线。
1.7 曲妥珠单抗依赖性ADCC活性检测
培养后的NK细胞与Her2阳性乳腺癌细胞系BT474细胞按一定效靶比例混合,同时添加600 ng/mL的曲妥珠单抗,单独只有BT474细胞培养系作为阴性对照,添加TritonX的作为阳性对照。利用CCK8检测试剂盒对曲妥珠单抗依赖性ADCC活性进行检测。对所得各组吸光光度值进行计算,杀伤率=[1-(Aet-Ae)/At]×100%,其中A为单纯效应细胞孔即NK细胞孔的吸光光度值;At为单纯靶细胞孔即BT474细胞孔的吸光光度值;Aet为效应细胞加靶细胞孔的吸光光度值。
1.8 统计学分析
2 结果
2.1 利用实时PCR法确定FCGR3A的基因多态性
通过实时PCR方法检测FCGR3A的基因多态性。根据FCGR3A第158个氨基酸可将FCGR3A分为V/V型,V/F型和F/F型。其中V/V型为野生型,V/F型和F/F型为突变型,见图1。
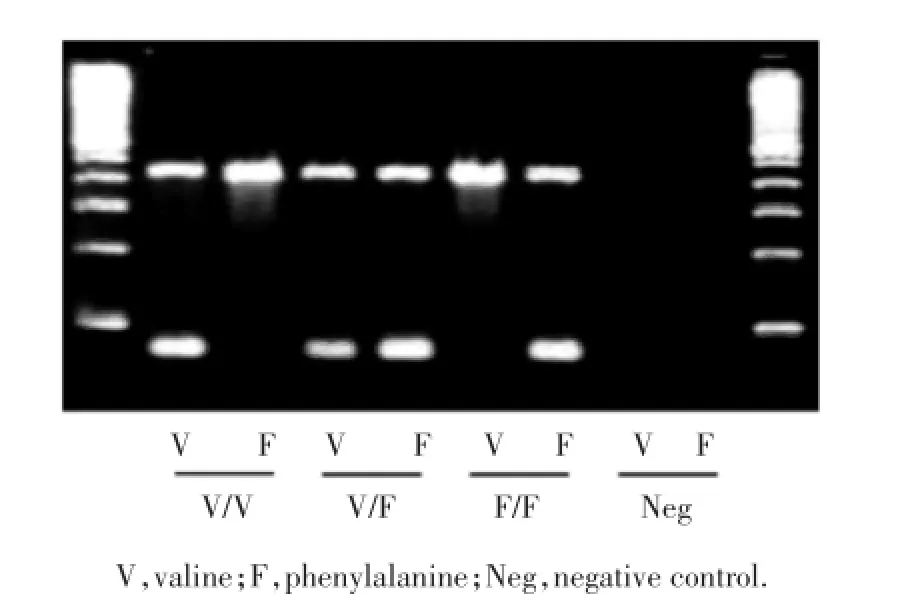
图1 通过实时PCR方法检测FCGR3A的基因多态性Fig.1Analysis of FCGR3A polymorphisms by real-time PCR
2.2 对比曲妥珠单抗刺激后的V/V型、V/F型及F/F型患者的体外NK细胞扩增倍数
体外利用曲妥珠单抗刺激培养NK细胞,发现V/V型的NK细胞增殖率要高于V/F型或者F/F型的患者,是V/F型患者的2.68倍,是F/F型患者的8.25倍左右,见表1。并且曲妥珠单抗刺激后NK细胞(CD56+和CD3-)所占比例在V/V型和F/F型患者间更是相差甚远,见图2。V/V型患者的培养体系中有78%的NK细胞,而F/F型患者培养体系中NK细胞只占3.9%。以上2项结果表明由于FCGR3A的基因多态性,严重影响了NK细胞的扩增能力。
2.3 对比曲妥珠单抗刺激后的V/V型及F/F型患者的NK细胞活化受体表达水平
曲妥珠单抗刺激后的NK细胞表面活化受体表达在基因多态中也存在差别。NKp30,NKp46,NKG2D,CD107a的表达水平V/V型的患者均高于F/F患者,差异有统计学意义(P<0.01),见图3。此结果说明由于FCGR3A的基因多态性,影响了NK细胞的活化程度。
表1 比较曲妥珠单抗刺激后NK细胞数及增殖率Tab.1Comparison of NK cell number and proliferation rate

表1 比较曲妥珠单抗刺激后NK细胞数及增殖率Tab.1Comparison of NK cell number and proliferation rate
1)P<0.01 vs V/V group.
?
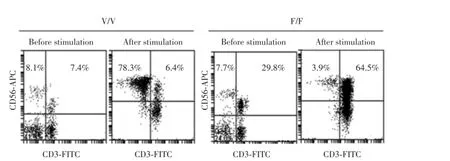
图2 对比曲妥珠单抗刺激后NK细胞所占比例Fig.2Comparison of the NK cell percentage after trastumab stimulation
2.4 对比V/V型、V/F型及F/F型患者的体外曲妥珠单抗依赖性ADCC活性
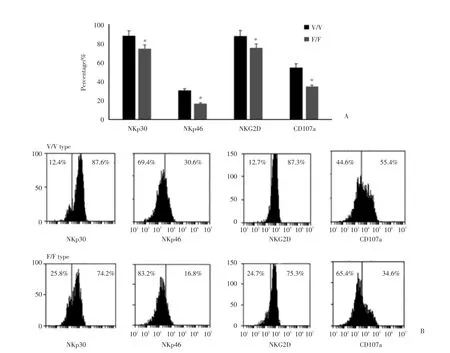
图3 对比曲妥珠单抗刺激后NK细胞活化受体表达水平Fig.3Comparison of expression of NK cell activating receptors after trastumab stimulation
3类患者培养后的NK细胞在效靶比为8的时候,检测曲妥珠单抗依赖性ADCC活性,见图4。V/V型患者NK细胞的ADCC活性要高于其余两者。计算得到杀伤率结果有统计学差异(P<0.01)。虽然ADCC活性三者间并未有特别显著的差距,然而考虑到NK细胞整体绝对值的差异,V/V型患者的抗肿瘤活性要远远高于V/F型和F/F型患者。
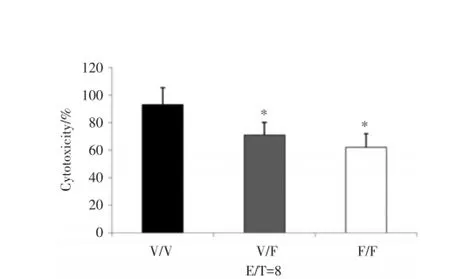
图4 对比V/V型、V/F型及F/F型患者的体外曲妥珠单抗依赖性ADCC活性Fig.4Comparison of trastumab-dependent NK cell cytotoxicity
3 讨论
曲妥珠单抗联合其他化疗和激素疗法可提升Her2阳性乳腺癌患者的临床疗效,改善生存期,然而单药曲妥珠单抗的客观有效率并不高,为12%~34%[5-7]。所以如何与曲妥珠单抗联合治疗,从而增强曲妥珠单抗的疗效一直是研究的热点。近年来的研究[8]表明,曲妥珠单抗的抗肿瘤效果主要来源于NK的ADCC作用,曲妥珠的临床疗效受体内NK细胞活性影响很大,NK细胞治疗联合曲妥珠单抗可提高乳腺癌的临床疗效[9-11],日渐被人们所认识。
然而,临床上曲妥珠单抗联合NK细胞免疫疗法对某些Her2过表达乳腺癌患者的疗效有限。有研究表明,NK表面负责结合曲妥珠单抗FCGR3A的基因存在单核苷酸多态性,可能影响曲妥珠单抗的疗效。野生型V/V型患者的无进展生存期与总生存期也高于突变型V/F型或F/F型患者。V/F及V/V型人群在欧美占80%以上,在亚洲也有85%左右[12-14],因此研究FCGR3A基因多态性对NK细胞功能影响为研究曲妥珠个体差异奠定理论基础。
本研究表明,体外曲妥珠单抗刺激下,V/F型和F/F型这两种突变型患者的NK细胞扩增能力,活性及ADCC功能明显低于V/V型患者。FCGR3A的基因多态性影响了NK细胞与曲妥珠单抗的结合能力,减弱了曲妥珠单抗的刺激信号,不仅降低了NK细胞在体内的ADCC活性,同时还影响了NK细胞的增殖能力。这从另一个角度诠释了V/F型和F/F型患者对曲妥珠单抗耐药的原因。该研究结果为今后曲妥珠单抗适用人群的选定提供了理论支持。
[1]GAVIN PG,SONG N,KIM SR,et al.Association of polymorphisms in FCGR2A and FCGR3A with degree of trastuzumab benefit in the adjuvant treatment of ERBB2/HER2-positive breast cancer:analysis of the NSABP B-31 trial[J].JAMA Oncol,2017,3(3):335-341.DOI:10.1001/jamaoncol.2016.4884.
[2]MUSOLINO A,NALDI N,BORTESI B,et al.Immunoglobulin G fragment C receptor polymorphisms and clinical efficacy of trastuzumab-based therapy in patients with HER-2/neu-positive metastatic breast cancer[J].Clin Oncol,2008,26(11):1789-1796.DOI:10.1200/JCO.2007.4.8957.
[3]BOERO S,MORABITO A,BANELLI B,et al.Analysis of in vitro ADCC and clinical response to trastuzumab:possible relevance of FcγRIIIA/FcγRIIA gene polymorphisms and HER-2 expression levels on breast cancer cell lines[J].Transl Med,2015,14(1):24. DOI:10.1186/s12967-015-0680-0.
[4]BEANO A,SIGNORINO E,EVANGELISTA A,et al.Correlation between NK function and response to trastuzumab in metastatic breast cancer patients[J].Transl Med,2008,6(1):25.DOI:10.1186/ 1479-5876-6-25.
[5]PARK HS,SONN,KIM S,et al.Effects of hormone receptor status on the durable response of trastuzumab-based therapy in metastatic breast cancer[J].Breast Cancer Res Treat,2017 Feb 27[Epub ahead of print].DOI:10.1007/s10549-017-4175-y.
[6]WEINER GJ.Building better monoclonal antibody-based therapeutics[J]Nat Rev Cancer,2015,15(6):361-370.DOI:10.1038/ nrc3930.
[7]CHENG M,CHEN Y,XIAO W,et al.NK cell-based immunotherapy for malignant diseases[J].Cell Mol Immunol,2013,10(3):230-252.DOI:10.1038/cmi.2013.10.
[8]MENTLIK JA,COHEN AD,CAMPBELL KS.Combination immune therapies to enhance anti-tumor responses by NK cells[J].Front Immunol,2013,4(6):481.DOI:10.3389/fimmu.2013.00481.
[9]BATTELLA S,COX MC,SANTONI A,et al.Natural killer(NK)cells and anti-tumor therapeutic mAb:unexplored interactions[J]. J Leukoc Biol,2015,99(1):87-96.DOI:10.1189/jlb.5VMR0415-141R.
[10]SHEVTSOV M,MULTHOFF G.Immunological and translational aspects of NK cell-based antitumor immunotherapies[J].Front Immunol,2016,7(5):492.DOI:10.3389/fimmu.2016.0492.
[11]GUILLEREY C,HUNTINGTON ND,SMYTH MJ.Targeting natural killer cells in cancer immunotherapy[J].Nat Immunol,2016,17(9):1025-1036.DOI:10.1038/ni.3518.
[12]MUSOLINO A,NALDI N,BORTESI B,et al.Mmunoglobulin G fragment C receptor polymorphisms and clinical efficacy of trastuzumab-based therapy in patients with HER-2/neu-positive metastatic breast Cancer[J].Clin Oncol,2008,26(11):1789-1796. DOI:10.1200/JCO.007.14.8957.
[13]SUZUKI E,NIWA R,SAJI,S,et al.A nonfucosylated anti-HER2 antibody augments antibody-dependent cellular cytotoxicity in breast cancer patients[J].Clin Cancer Res,2007,13(6):1875-1882.DOI:10.1158/1078-0432.CCR-06-1335.
[14]LEPPERS-VAN DE STRAAT FG,VAN DER POL WL,JANSEN MD,et al.A novel PCR-based method for direct Fc gamma receptor IIIa(CD16)allotyping[J].Immunol Methods,2000,242(1/ 2):127-132.
(编辑 于溪)
Effect of FCGR3A Polymorphisms on NK Cell Function
SUN Shulan,LI Xiaoxi,SU Nan,DU Tianzhao,ZHANG Guirong
(Central Laboratory,Cancer Hospital of China Medical University,Liaoning Cancer Hospital&Institute,Shenyang 110042,China)
ObjectiveTo investigate the effect ofFCGR3Apolymorphisms on NK cell function.MethodsPeripheral blood samples from cancer patients were collected andFCGR3Apolymorphisms were confirmed by PCR.In vitro proliferation rates,ADCC activity,and expression of NK cell activating receptors were compared under trastumab stimulation.ResultsThis study showed that the wild-typeFCGR3Aexhibited a higher affinity to trastumab along with better NK cell proliferation and ADCC activity than the mutant type.Compared to the patients with wild-type FCGR3A,the proliferation rates of NK cells in patients with the mutant type were reduced by approximately 8-fold.In addition,the expression of NK cell activating receptors in patients with wild-typeFCGR3Awas higher than in patients with the mutant type.ConclusionMutations inFCGR3Areduce NK cell function,causing a poor reaction to monoclonal antibody.
natural killer cell;FCGR3A;Polymorphisms;trastumab
R392.12
A
0258-4646(2017)05-0439-05
10.12007/j.issn.0258-4646.2017.05.014
辽宁省科技厅博士启动项目(201501109)
孙舒岚(1984-),女,助理研究员,博士.
张桂荣,E-mail:zhang.lth@163.com
2017-01-05
网络出版时间:
