几丁质脱乙酰酶的研究进展
2017-05-18杨倩刘建辉蒋彤董莉莉段宏玉孙纪录
杨倩,刘建辉,蒋彤,董莉莉,段宏玉,孙纪录
(1.河北农业大学理工学院,河北沧州061100;2.河北农业大学食品科技学院,河北保定071001)
几丁质脱乙酰酶的研究进展
杨倩1,刘建辉1,蒋彤1,董莉莉1,段宏玉1,孙纪录2,*
(1.河北农业大学理工学院,河北沧州061100;2.河北农业大学食品科技学院,河北保定071001)
几丁质脱乙酰酶(chitin deacetylase,CDA)是可以催化几丁质脱乙酰基反应生成壳聚糖的酶类。壳聚糖因其具有抗菌、抗癌、抗病毒等特性,在医药、化工、食品等行业具有广阔的应用前景。对CDA的研究概况进行了综述,包括酶学性质、催化机理、分离纯化的方法等,同时对CDA产生菌的筛选方法及过程做了简要的阐述,并对CDA今后的重点研究方向进行了展望。
几丁质脱乙酰酶;几丁质;壳聚糖;脱乙酰
几丁质又称甲壳素,是由N-乙酰-D-葡萄糖胺以β-1,4糖苷键连接而成的天然高分子多糖,在自然界中含量仅次于纤维素。但由于其溶解性差,应用受到一定限制[1]。几丁质的衍生物壳聚糖,又称脱乙酰甲壳素,是天然多糖中唯一大量存在的碱性氨基多糖。壳聚糖具有抗菌、抗癌、抗病毒等作用,并且具有良好的生物相容性和生物可降解性,在医药、食品、化工等行业得到了广泛应用[2]。目前,生产壳聚糖主要是采用化学方法。化学方法需要使用大量的浓碱,除反应时间长、成本高、耗能大、产品质量不稳定等缺点外,反应过程中生成的某些有毒的物质(如肼等),也会对环境造成严重的污染[3]。而采用生物酶法降解几丁质可以克服化学方法的缺点。几丁质脱乙酰酶(chitin deacetylase,CDA)是催化几丁质转化为壳聚糖的关键酶,能够脱去几丁质分子中的乙酰基生成壳聚糖。本文针对几丁质脱乙酰酶的研究概况进行综述,以期为后续几丁质脱乙酰酶的进一步研究与应用提供理论支持。
1 CDA的研究概况
1.1 CDA的酶学性质
由于CDA的来源不同,其酶学性质也存在差异性。到目前为止,自然界所发现的CDA都是糖蛋白。CDA热稳定性良好,大多数CDA的最适温度为50℃~60℃。而最适pH差异较大,一般胞外酶的最适pH为7~12,胞内酶最适pH为4.5~6。大部分CDA的等电点(isoelectric point,pI)都在酸性范围内[3-4]。影响CDA酶学性质的因素主要有温度、pH、底物状态及浓度、相对分子质量和金属离子等。不同金属离子对CDA酶学性质的影响不同,同种金属离子也可能因其浓度不同而起相反的作用,比如对于红球菌(Rhodococcus)所产的CDA,高浓度的Ca2+、Mn2+、K+抑制其酶活,而低浓度的Ca2+、Mn2+、K+却是该酶的激活剂[5]。表1列举了不同来源CDA的性质。
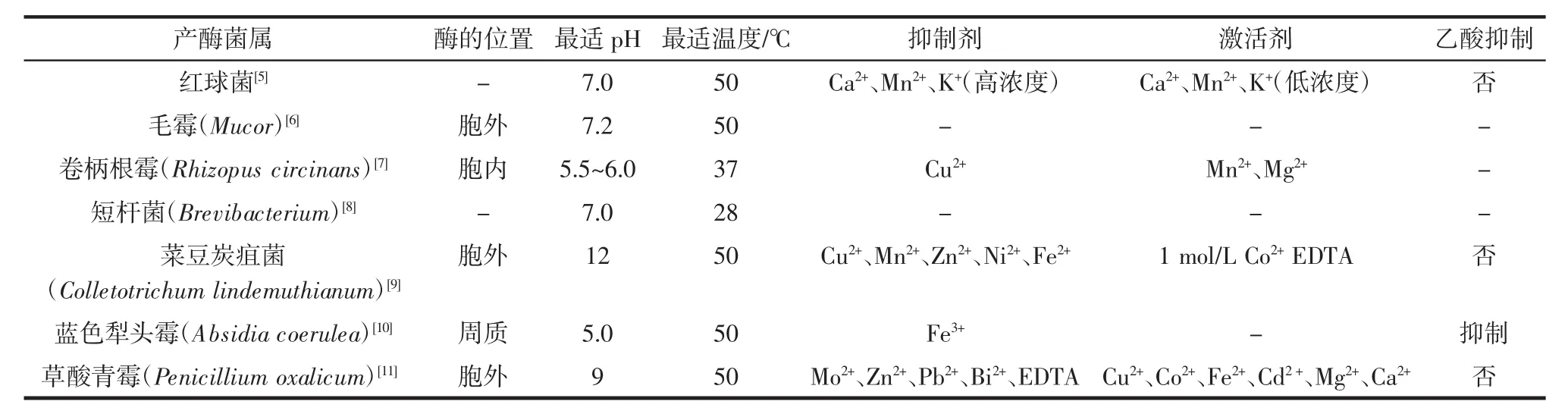
表1 不同来源CDA的性质Table 1 The property of the CDA from different sources
1.2 CDA的催化机理
在关于CDA催化机理的研究中,Martinou等以鲁氏毛霉(Mucor rouxii)中的CDA为样本,通过1HNMR和13CNMR光谱检测,发现CDA水解乙酰基的反应是多位点进攻模式,即可同时脱除多个位点的乙酰基,脱除乙酰基的个数与作用点的个数有关[12]。CDA的作用机制与其他酶作用于多聚体底物的作用机制相近。据测试结果合理推测其水解过程可能为:CDA与几丁质的N-乙酰-D-葡萄糖胺长直链结合,从结合位点的非还原端开始水解,依次脱除乙酰基,完成后与长链脱离,再结合另一条长链继续作用[13-14]。此外,来源于菜豆炭疽菌的CDA可将壳二糖乙酰化生成2-乙酰氨基-2-脱氧-D-吡喃葡萄糖-(1→4)-2-氨基-2-脱氧-D-葡萄糖,这是一种不常见的特殊催化产物。该CDA在3 mol/L乙酸钠存在下,可以催化逆向脱乙酰反应[15]。
1.3 CDA的分离纯化
纯化CDA常用的方法主要为层析法。Kafetzopoulos等采用3步层析法将鲁氏毛霉的粗酶提取物进行纯化。纯化倍数为97.3,得率11.9%,酶的比活力为2.968U/mg[16]。Tokuyasu等[17]对菜豆炭疽菌产生的粗酶提取物同样通过3步层析法进行纯化,达到电泳纯。纯化倍数为944、得率为4.05%、酶的比活力为18.4 U/mg[17]。Jeraj等将黑根霉(Rhizopus nigricans)的粗酶提取物采用2步层析法,分别通过CM凝胶色谱柱和DEAE-纤维色谱柱进行分离纯化,达到电泳纯。纯化倍数为21.2、得率为5.2%、比活力为40.3 U/mg[18]。Pareek等将草酸青霉的粗酶液通过2步层析法对CDA进行了纯化,达到电泳纯。纯化倍数为88.25、得率为11.06%、比活力为55.38 U/mg[11]。
1.4 产CDA的微生物种类
CDA在1974被首次报道,是由Araki和Ito在鲁氏毛霉中发现的[19],之后研究者们又在一些致病的真菌和细菌中发现了CDA的存在[20]。现已发现的产几丁质脱乙酰酶的微生物种类较为广泛,主要有细菌、放线菌、真菌等。部分重要的产CDA的微生物列于表2中。

表2 产CDA的微生物Table 2 The microorganisms producing CDA
2 产CDA微生物的筛选
筛选过程一般分为初筛和复筛。初筛是从平板筛选培养基上筛选得到可疑菌落,复筛即进一步确认可疑菌株是否能产几丁质脱乙酰酶并测定其酶活力。
2.1 初筛的方法及过程
2.1.1 初筛的方法
初筛的方法主要有两种。一是透明圈法,其原理是以胶体几丁质作为唯一氮源制成平板筛选培养基,如果有能产生CDA的菌存在,便可以分解几丁质产生透明圈。通过透明圈的大小判断微生物对几丁质的分解能力和CDA的活性。此法的不足之处在于:胶体几丁质的平板是半透明的,所以观察效果并不明显[32]。二是变色圈法,其原理是将对硝基乙酰苯胺作为平板筛选培养基的底物之一,可以脱去几丁质乙酰基的微生物也可以脱去对硝基乙酰苯胺上的乙酰基,生成黄色的对硝基苯胺,这样就可以通过平板筛选培养基上是否出现黄色以及黄色面积的大小来判断是否有产生CDA的微生物存在和其脱乙酰基的能力大小。此法反应现象明显,易于观察,缺点在于对硝基乙酰苯胺有毒,难溶于冷水,高温易分解,不易操作。
2.1.2 初筛的过程
根据实际情况采样,采样后应尽快进行富集培养,一般富集培养时间为3 d~7 d,再进行平板筛选,从平板筛选培养基上挑选可疑菌落进行划线分离纯化培养,最后接种到斜面培养基上进行保存。
2.2 复筛的方法及过程
2.2.1 CDA酶活力测定方法
由于天然几丁质不溶于水,需经特殊处理后才能用作酶活力测定的底物。因此,CDA酶活力测定受到限制,使得CDA的研究进展缓慢。以下介绍几种已报道的CDA酶活力测定方法。
2.2.1.1 比色法
CDA催化胶体几丁质生成葡萄糖胺单体,再利用吲哚-盐酸分光光度法测定反应终产物中糖胺的含量,计算CDA的酶活力[33]。其实验原理是使用亚硝酸盐脱除己糖胺的氨基生成己糖苷,吲哚与产物己糖苷在盐酸溶液中发生颜色反应,通过测定颜色反应前后的吸光值,即可得出反应前后乙酰基的脱除量。比色法实验结果存在重现性较差的缺点。
2.2.1.2 放射法
其原理是将可溶性几丁质中的乙酰基用放射性物质进行标记,将其作为底物应用CDA进行催化,反应结束后通过测定其中放射性乙酸的含量计算出CDA的催化效率。放射法存在成本高、操作繁琐、耗时长等缺点[15]。
2.2.1.3 对硝基乙酰苯胺分光光度法
将对硝基乙酰苯胺作为反应底物,经CDA催化后生成对硝基苯胺。使用分光光度法测定反应后对硝基乙酰苯胺的吸光度与标准曲线对比,从而计算出CDA的酶活。此法操作简单、准确度高,适合从大批量样品中筛选目标菌株[34]。
2.2.2 复筛的过程
将初筛得到的菌株接种到相应的种子培养基,进行摇床培养,使其在种子培养基中能够恢复活力并提前适应发酵条件。然后将种子培养液接种到相应的发酵培养基中,发酵培养基能提供给其较适宜的发酵产酶条件。培养适当时间后即可测其酶活力。
3 结论与展望
虽然几丁质脱乙酰酶的研究目前取得了一定进展,但同时也存在许多问题。
3.1 在CDA的分离纯化与催化机理方面
目前关于CDA分离纯化的研究还比较少,分离纯化方法单一,主要是层析法。随着科学技术的进步应不断简化,以有利于实现CDA的工业化生产。CDA的催化机理的研究对其工业化生产至关重要,因此可以将此列为研究方向进行深入探究。
3.2 在筛选产CDA的微生物的研究方面
目前已在多种菌属中筛选到能产CDA的菌。但是,由于筛选出来的产CDA的菌株大多活力不高,发酵提取的条件不成熟,调控机理尚未研究清楚,不能应用于工业化大规模生产。因此,通过诱变育种和分子生物学方法,选育和构建具有稳定遗传性状的CDA高产菌株仍是未来重要研究方向。另外,天然几丁质不能作为筛选产CDA菌的底物,因其晶体结构难以进行脱乙酰基反应,必须将其经过预处理。因此,研究几丁质简单快速的预处理方法,破坏其晶体结构也是今后研究的一个重点。
[1] Xi Y,Pan P L,Ye Y X,et al.Chitin deacetylase family genes in the brown planthopper,Nilaparvata lugens,(Hemiptera:Delphacidae) [J].Insect Molecular Biology,2014,23(6):695-705
[2] Liu J,Jia Z,Sha L,et al.Identification and characterization of a chitin deacetylase from a metagenomic library of deep-sea sediments of the Arctic Ocean[J].Gene,2016,590(1):79-84
[3] 王皓,吴丽,朱小花,等.甲壳素脱乙酰酶的研究概况及展望[J].中国生物工程杂志,2015,35(1):96-103
[4]刘丽,赵祥颖,田延军,等.甲壳素脱乙酰酶的研究及应用进展[J].山东食品发酵,2009(4):23-25
[5]张菁菁,董文宾,缑敬轩.几丁质脱乙酰酶菌株的筛选鉴定及酶学性质[J].食品工业科技,2012,33(6):244-246
[6]蒋霞云,周培根,李燕,等.几种霉菌产甲壳素脱乙酰酶活力比较及部分酶学性质[J].上海海洋大学学报,2006,15(2):211-215
[7] Gauthier C,Clerisse F,Dommes J,et al.Characterization and cloning of chitin deacetylases from Rhizopus circinans[J].Protein Expression&Purification,2008,59(1):127-137
[8]张灿,黄德智,李丰硕,等.海洋产几丁质酶菌株的筛选及发酵条件优化[J].吉林农业大学学报,2012,34(2):141-146
[9] Shrestha B,Blondeau K,Stevens W F,et al.Expression of chitin deacetylase from Colletotrichum lindemuthianum,in Pichia pastoris: purification and characterization[J].Protein Expression&Purification,2004,38(2):196-204
[10]Win N,Stevens W.Shrimp chitin as substrate for fungal chitin deacetylase[J].Applied Microbiology&Biotechnology,2001,57(3): 334-341
[11]Pareek N,Vivekanand V,Saroj S,et al.Purification and characterization of chitin deacetylase from Penicillium oxalicum SAEM-51[J]. Carbohydrate Polymers,2012,87(2):1091-1097
[12]Martinou A,Bouriotis V,Stokke B T,et al.Mode of action of chitin deacetylase from Mucor rouxii,on partially N-acetylated chitosans [J].Carbohydrate Research,1998,311(1):71-78
[13]张菁菁.几丁质脱乙酰酶菌株的选育[D].西安:陕西科技大学, 2012:19-20
[14]Aguila E M D,Gomes L P,Cristina Tristo Andrade,et al.Biocatalytic production of chitosan polymers from shrimp shells,using a recombinant enzyme produced by Pichia pastoris[J].American Journal of Molecular Biology,2012,2(4):341-350
[15]Tokuyasu K,Ono H,Hayashi K,et al.Reverse hydrolysis reaction of chitin deacetylase and enzymatic synthesis of β-d-GlcNAc-(1→4) -GlcN from chitobiose[J].Carbohydrate Research,1999,322(1/2): 26-31
[16]Kafetzopoulos D,Martinou A,Bouriotis V.Bioconversion of chitin to chitosan:purification and characterization of chitin deacetylase from Mucor rouxii[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(7):2564-8
[17]Tokuyasu K,Ohnishikameyama M,Hayashi K.Purification and characterizationofextracellularchindeacetylase from Colletotrichum lindemuthianum[J].Bioscience Biotechnology&Biochemistry,1996, 60(10):1598-603
[18]Jeraj N,KunicˇB,Lenasi H,et al.Purification and molecular characterization of chitin deacetylase from Rhizopus nigricans[J].Enzyme&Microbial Technology,2006,39(6):1294-1299
[19]Araki Y,Ito E.A pathway of chitosan formation in Mucor rouxii:enzymatic deacetylation of chitin[J].Biochemical&Biophysical Research Communications,1974,56(3):669-75
[20]李少雅,赵丹,孙晓彤,等.对美国白蛾几丁质脱乙酰酶(hccda5)基因原核表达影响因素的研究[J].河北农业大学学报,2015,38 (4):81-85
[21]Kauss H,Jeblick W,Young D H.Chitin Deacetylase from the plant pathogen Colletotrichum lindemuthianum[J].Plant Science Letters, 1983,28(2):231-236
[22]Gao X D,Katsumoto T,Onodera K.Purification and characterization of chitin deacetylase from Absidia coerulea[J].Journal of Biochemistry,1995,117(2):257-263
[23]Alfonso C,Nuero O M,Santamaría F,et al.Purification of a heatstable chitin deacetylase from Aspergillus nidulans,and its role in cell wall degradation[J].Current Microbiology,1995,30(1):49-54
[24]黄惠莉,叶存印,姚云艳.枯草芽胞杆菌甲壳素脱乙酰酶的筛选及酶学性质[J].微生物学通报,2004,31(5):33-37
[25]蔡俊,杜予民,杨建红,等.甲壳素脱乙酰酶产生菌的筛选及产酶条件[J].武汉大学学报(理学版),2005,51(4):485-488
[26]Baker L G,Specht C A,Donlin M J,et al.Chitosan,the deacetylated form of chitin,is necessary for cell wall integrity in Cryptococcus neoformans[J].Eukaryotic Cell,2007,6(5):855-867
[27]Yamada M,Kurano M,Inatomi S,et al.Isolation and characterization of a gene coding for chitin deacetylase specifically expressed during fruiting body development in the basidiomycete Flammulina velutipes,and its expression in the yeast Pichia pastoris[J].Fems Microbiology Letters,2008,289(2):130-137
[28]李朝丽,郭建生.甲壳素脱乙酰酶产生菌产酶条件的优化[J].生物学杂志,2009,26(6):45-47
[29]万芳芳.高产甲壳素脱乙酰酶菌株的筛选及发酵研究[D].长沙:中南林业科技大学,2012:30-33
[30]Sun Y,Zhang J,Wu S,et al.Statistical optimization for production of chitin deacetylase from Rhodococcus erythropolis HG05[J].Automobile Technology,2014,102(1):649-652
[31]Ramos-Puebla A,Santiago C D,Trombotto S,et al.Addition of abscisic acid increases the production of chitin deacetylase by Colletotrichum gloeosporioides in submerged culture[J].Process Biochemistry,2016,51(8):959-966
[32]金香.几丁质降解菌的筛选、鉴定及酶学特性的研究[D].哈尔滨:哈尔滨工业大学,2007:27
[33]刘丽萍.几丁质脱乙酰酶产生菌的筛选[D].泰安:山东农业大学, 2007:43-52
[34]刘丽萍,赵祥颖,刘建军,等.一种简易、高效产几丁质脱乙酰酶菌种的筛选方法[J].食品与发酵工业,2008,34(1):65-68
Research Advance of Chitin Deacetylase
YANG Qian1,LIU Jian-hui1,JIANG Tong1,DONG Li-li1,DUAN Hong-yu1,SUN Ji-lu2,*
(1.College of Science and Technology,Hebei Agricultural University,Cangzhou 061100,Hebei,China;2.College of Food Science and Technology,Hebei Agricultural University,Baoding 071001,Hebei,China)
Chitin deacetylase(CDA)is an enzyme which can catalyze deacetylase reaction in chitin generating chitosan.Chitosan has several excellent properties,such as antibacterial,anticancer,and antiviral,with wide application prospect in the medicine,chemical,and food industries.The research situation of CDA was reviewed,including enzymatic properties,catalytic mechanism,the method of separation and purification,etc. Furthermore,the screening methods and process of CDA producing strains were briefly introduced,and the future research direction of CDA was prospected.
chitin deacetylase;chitin;chitosan;deacetylation
10.3969/j.issn.1005-6521.2017.10.045
2016-08-25
河北省科技计划项目“利用蟹壳和小球藻生产新型海洋多糖的关键技术研究及功能食品开发”(15273204D)
杨倩(1986—),女(汉),副教授,博士,研究方向:食品安全。*通信作者:孙纪录(1972—),男(汉),教授,博士,研究方向:食品生物技术。
