改良LAMP快速检测酸土脂环酸芽胞杆菌的研究
2017-05-18杨粤张蕴哲张先舟马晓燕张伟
杨粤,张蕴哲,张先舟,马晓燕,张伟
(河北农业大学食品科技学院,河北保定071000)
改良LAMP快速检测酸土脂环酸芽胞杆菌的研究
杨粤,张蕴哲,张先舟,马晓燕,张伟*
(河北农业大学食品科技学院,河北保定071000)
建立改良环介导等温扩增(loop-mediated isothermal amplification,LAMP)检测酸土脂环酸芽胞杆菌的方法。以酸土脂环酸芽胞杆菌的16S rRNA基因保守区域设计4条特异性引物,优化反应体系,通过荧光曲线、琼脂糖凝胶电泳和白色沉淀判定扩增结果。同时,对LAMP引物特异性、灵敏度、检出限进行研究。LAMP法在61℃,60 min内完成酸土脂环酸芽胞杆菌的检测。2株酸土脂环酸芽胞杆菌呈阳性结果,17株非酸土脂环酸芽胞杆菌呈阴性结果,表明该种检测方法具有高特异性。检测纯菌灵敏度为7.2 CFU/mL,对人工污染苹果汁样品中酸土脂环酸芽胞杆菌的检出限是18 CFU/mL。LAMP法检测酸土脂环酸芽胞杆有操作简单、灵敏度高、特异性强等优点,应用前景广阔。
环介导等温扩增;酸土脂环酸芽胞杆菌;16S rRNA;检测
酸土脂环酸芽胞杆菌(Alicyclobacillus acidoterrestris,A.acidoterrestris)是引起果汁腐败的主要菌种,是一种嗜酸耐热、好氧型的革兰氏阳性菌,其生存能力强,能经受酸性条件下的巴氏杀菌过程而存活[1]。A. acidoterrestris在生长代谢时能产生愈创木酚、2-6-二氯苯酚和2-6-二溴苯酚等物质,影响果汁口感。严重的会在包装物底部出现雾状浑浊或白色沉淀,破坏果汁质量和营养价值[2]。A.acidoterrestris在低浓度时很难检出,因此一般在果汁产品流通后才会被发现[3]。在国际贸易中,果汁产品经常会因A.acidoterrestris的污染而被大量的退货,索赔的事件时有发生,这不但损害了国家的形象,而且给浓缩果汁产业带来了巨大的经济损失[4]。现在研究人员对A.acidoterrestris的研究主要集中在是利用防腐剂[1],天然抗菌剂[5],物理处理[6]等方法,在加工的过程中控制A.acidoterrestris在果汁中的生长,但是这些方法并不能保证果汁中不存在A.acidoterrestris。因此,建立一种高效、快速的检测A.acidoterrestris的方法对于我国浓缩果汁产业的健康可持续发展具有重要的意义[7]。
传统的微生物培养法是目前A.acidoterrestris在果汁行业公认的检测方法[8],该种检测方法程序复杂,劳动密集,至少需要3 d~5 d[9]。快速检测A.acidoterrestris的方法有仪器检测和分子检测。其中,仪器检测包括傅里叶红外光谱[10]、高效液相色谱指纹图谱法[11]和电子鼻技术[12],仪器检测实现了检测的快速准确,但是需要专业的操作人,且样品前处理复杂。分子检测包括酶联免疫吸附技术(enzyme linked immunosorbent assay,ELISA)[13]、聚合酶链反应(polymerase chain reaction,PCR)[14]。ELISA检测灵敏度低且容易出现交叉反应。PCR技术需要精密的温度循环装置,操作仅限于实验室。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是2000年由日本生物学家Notomi T等[15]发明的一种新型的体外等温扩增特异核酸片段技术。该种检测方法是针对靶基因的6个区域设计4条特异的引物,利用一种具有链置换活性的DNA聚合酶(Bst DNA polymerase)在恒温条件(65℃左右)保温几十分钟,即可完成核酸的高效扩增。整个扩增反应在30 min~60 min内可以扩增出109~1010[16]倍靶序列拷贝。本试验是在普通LAMP的基础上,针对A.acidoterrestris的16S rRNA基因保守区域设计引物,在反应体系中添加了结合双链DNA的荧光染料SYBR GreenⅠ,利用实时荧光监测仪对反应进行实时监测,建立了A.acidoterrestris快速的检测方法,为检测A. acidoterrestris提供了一种更加新型、便捷的方法。
1 材料与方法
1.1 材料
1.1.1 试验菌株
本试验共用菌19株,试验菌株见表1。

表1 实验菌株Table 1 Strains in this study
1.1.2 主要仪器与试剂
实时荧光监测仪(ESE Quant Tube Scanner):德国Stockach公司;PCR扩增仪(Whatman T Gradient基因扩增仪):德国Biometra公司。
Bst DNA聚合酶(Bst DNA polymerase)、限制性内切酶、基因组DNA提取试剂盒:均购自于上海生工生物工程有限公司;SYBR GreenⅠ:购自北京天恩泽基因科技有限公司;Taq DNA polymerase、MgSO4、dNTPs:均购自北京全式金有限公司;LAMP和PCR引物合成:北京华大基因;所有的培养基均购自北京陆桥技术有限责任公司。
1.1.3 培养基与果汁样品
K氏培养基(酵母粉2.5 g、蛋白胨5.0 g、琼脂粉15.0 g、葡萄糖1.0 g、吐温80 1.0 mL,溶于1 L无菌蒸馏水中,用苹果酸调节pH(3.7+0.1),115℃灭菌30 min);浓缩苹果汁购自保定大型超市并经PCR检测为A.acidoterrestris阴性。
1.2 方法
1.2.1 酸土脂环酸芽胞杆菌的培养与基因组DNA的提取
取保藏的A.acidoterrestris(CICC10374)在K氏琼脂培养基上进行划线,44°C培养24 h,传代培养2次。挑取传代培养的单菌落接种至新鲜无菌的K氏液体培养基中,44°C,200 r/min摇床培养12 h。
采用试剂盒法提取 A.acidoterrestris的基因组DNA,按照说明书操作。
1.2.2 引物设计
引物是LAMP反应成功的关键[17],本试验根据Genebank中A.acidoterrestris 16S rRNA基因组已知序列(基因号:KC193183.1),利用在线软件(http://primerexplorer.jp/e/)设计了4条特异性引物,即F3、B3、FIP和BIP。
F3 GCTTGACATCCCTCTGACC B3 CGCCTTCCTCCGACTTAC
FIPCGACAACCAT GCACCACCT-GGTGCAGAGATGTACCTTC
BIP AGCTCGTGTCGTGAGATGTTG-AGTCCCCACCTCTACGTG
1.2.3 酸土脂环酸芽胞杆菌实时荧光LAMP反应体系的优化
建立A.acidoterrestris实时荧光LAMP检测25 μL反应体系,分别对反应体系中的温度、引物浓度、Bst DNA polymerase添加量、dNTPs添加量进行优化。反应温度分别设置为:59、60、61、62、63℃;内外引物比分别设置为2∶1、4∶1、6∶1、8∶1、10∶1;Bst DNA polymerase添加量分别设置为 0.6、0.8、1.0、1.2、1.4 μL;dNTPs添加量分别设置为1.0、1.5、2.0、2.5、3.0 μL。确定最适反应体系和反应条件。
1.2.4 扩增产物的分析
实时荧光LAMP可以通过三种方法分析扩增产物:(1)利用实时荧光监测仪,根据扩增曲线判定反应结果;(2)琼脂糖凝胶电泳;(3)观察反应管底部白色沉淀。
1.2.5 特异性分析
本试验对2株A.acidoterrestris和17株非A.acidoterrestris进行检测。分别取表1中19株细菌过夜培养的菌悬液1 mL,用试剂盒法提取各个菌株基因组DNA作为模板,根据1.2.4建立的反应体系和反应条件进行检测,对LAMP引物进行特异性分析。
1.2.6 灵敏度试验
将A.acidoterrestris的标准菌经K氏液体培养基培养12 h后,利用平板菌落计数法,测得原菌液浓度为7.2×106CFU/mL。用无菌生理盐水进行10倍系列稀释,并分别取各个稀释倍数菌悬液1 mL,使用试剂盒法提取A.acidoterrestris基因组DNA,进行LAMP和PCR灵敏性试验。
1.2.7 人工污染苹果汁样品检出限分析
人工污染果汁前,经PCR法鉴定果汁中不含A. acidoterrestris。挑取K氏培养基上44°C培养12 h的A.acidoterrestris单菌落,制成一定浓度的菌悬液。选取菌悬液1 mL添加到苹果汁中(25 mL苹果汁样品已溶于225 mL无菌生理盐水中)。利用平板菌落计数法,测得人工污染苹果汁样品混合液中A.acidoterrestris的活菌数为1.8×105CFU/mL,用无菌生理盐水进行10倍系列稀释。分别取各个稀释倍数污染样品均质液1 mL,使用试剂盒法提取A.acidoterrestris基因组DNA,进行LAMP检测,确定检出限。
2 结果与分析
2.1 LAMP反应体系和反应条件的建立。
按1.2.4所述对LAMP反应体系和反应条件的优化。温度优化结果如图1所示,当反应温度为61°C时,出峰最早;引物比优化结果如图2所示,当内外引物比为4∶1时,出峰最早;Bst DNA聚合酶优化结果如图3所示,当添加量为1.0 μL时,出峰最早;dNTPs优化结果如图4所示,当dNTPs添加量为2.5 μL时,出峰最早。经过对反应体系和反应条件的优化,确定最适反应体系为:10 μmol/L FIP和BIP各1.6 μL,10 μmol/L F3和B3各0.4 μL,10 mmol/L dNTPs 2 μL,8 000 U/mL的Bst DNA聚合酶1.0 μL,50 mmol/L Mg-SO4 2.5 μL,10×Bst DNA聚合酶缓冲液2.5 μL,DNA模板1 μL,SYBR GreenⅠ(400×稀释)0.5 μL,用灭菌双蒸水补足25 μL反应体系。最佳反应温度61℃,反应时间为90 min(根据扩增情况,反应可随时终止)。
扩增产物的判定可以通过实时荧光监测仪、琼脂糖凝胶电泳和观察反应管底部白色沉淀。首先利用实时荧光监测仪可以随时观看扩增结果,阴性无起峰现象,阳性会有明显的扩增曲线(如图5 A)。其次通过琼脂糖凝胶电泳观看扩增结果,阳性会有梯形条带(如图5 B)。最后可以通过观察反应管底部白色沉淀,判断扩增结果,阳性结果反应管会变浑浊或有少量白色沉淀产生(如图5 C)。3种判定结果一样,证明反应管1未发生扩增,反应管2发生了扩增反应。

图1 反应温度优化Fig.1 Optimization of temperature

图2 引物优化Fig.2 Optimization of primer

图3 Bst DNA聚合酶优化Fig.3 Optimization of Bst DNA polymerase

图4 dNTPs优化Fig.4 Optimization of dNTPs
2.2 LAMP产物的酶切分析结果
通过理论推导可知,对LAMP扩增产物进行酶切,产生的片段大小应为270 bp和180 bp。本实验中,选用限制性内切酶NaeI对扩增产物进行酶切得到的片段大小与理论值相符(如图6)。
2.2 LAMP引物特异性分析
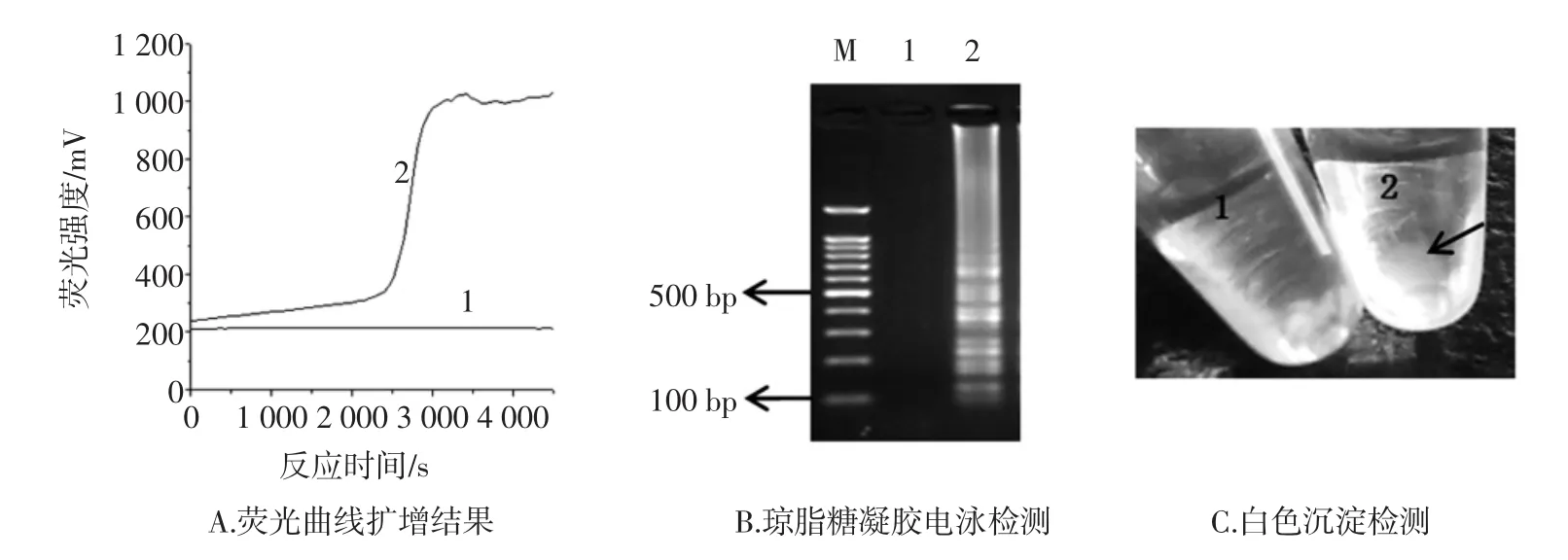
图5 LAMP扩增结果Fig.5 The results of amplification by LAMP
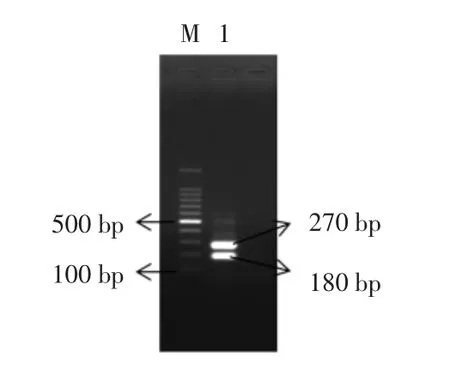
图6 LAMP产物酶切结果分析Fig.6 Enzyme digestion analysis of LAMP
采用2.1建立的反应体系,对2株A.acidoterrestris以及17株非A.acidoterrestris进行检测,结果如图7所示。通过实时荧光曲线可知仅有2株A.acidoterrestris有明显的扩增曲线,即发生特异性扩增,其他菌株均无明显的扩增曲线(如图7A~7C)。通过琼脂糖凝胶电泳可知,仅2株A.acidoterrestris出现梯形条带,其他菌株均没有出现梯形条带(如图7D)。通过观察沉淀可知,仅2株A.acidoterrestris有白色沉淀产生,其他菌株无白色沉淀(如图7E)。3种检测方法得到结果相同,证明本实验中的LAMP引物具有特异性。
2.3 酸土脂环酸芽胞杆菌LAMP检测的灵敏性试验
酸土脂环酸芽胞杆菌LAMP检测的灵敏性试验见图8。
如图8所示,A.acidoterrestris(CICC10374)浓度为7.2×106CFU/mL~7.2×100 CFU/mL时,反应呈现典型的扩增曲线(图8 A),琼脂糖凝胶电泳有梯形条带产生(图8 B),反应管底部有白色沉淀产生(图8 C)。当A.acidoterrestris的浓度为7.2×10-1CFU/mL时,反应无典型的扩增曲线(图8 A),琼脂糖凝胶电泳无梯形条带产生(图8 B),反应管底部无白色沉淀产生(图8 C)。同时采用PCR法对A.acidoterrestris的灵敏度进行检测,结果如图8D所示。当A.acidoterrestris(CICC10374)浓度为7.2×106CFU/mL~7.2×102CFU/mL时,有扩增条带,当A.acidoterrestris(CICC10374)浓度为7.2×101CFU/mL~7.2×10-1CFU/mL时,无扩增条带。因此,LAMP法检测A.acidoterrestris的灵敏度为7.2× 100 CFU/mL,是PCR检测法的100倍。

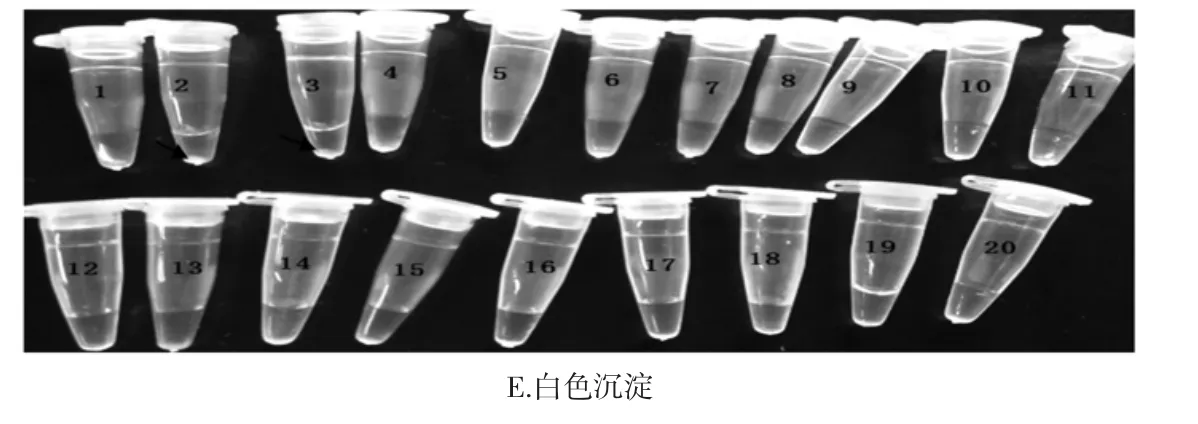
图7 LAMP引物特异性检测结果Fig.7 The specificity of the LAMP primer

图8 酸土脂环酸芽胞杆菌灵敏性试验Fig.8 The sensitivity of A.acidoterrestris
2.4 人工污染检出限的确定
当人工污染果汁样品中A.acidoterrestris浓度为1.8×105CFU/mL~18 CFU/mL时,反应呈现出典型的扩增曲线(图9 A),琼脂糖凝胶电泳有梯形条带产生(图9 B),反应管底部有白色沉淀(图9 C)。当A.acidoterrestris浓度为1.8×100 CFU/mL时,反应无扩增曲线(图9 A),琼脂糖凝胶电泳无梯形条带产生(图9 B),试管无白色沉淀(图9 C)。结果表明,LAMP法检测人工污染苹果汁中A.acidoterrestris污染果汁的检出限为1.8×101CFU/mL。
3 结论

图9 苹果汁酸土脂环酸芽胞杆菌的检出限分析Fig.9 Detection limit of LAMP for A.acidoterrestris in apple juice
酸土脂环酸芽胞杆菌被称为嗜酸嗜热细菌,可以经受巴氏杀菌而在果汁中存活,给果汁行业带来一系列问题[18]。因此,建立一种快速检测A.acidoterrestris方法势在必行。李建科等[13]建立的酶联免疫吸附技术检测苹果汁中A.acidoterrestris检出限为105CFU/mL。2014年王周立等[14]基于PCR法建立了快速检测A. acidoterrestris的研究,确定在检出限低于10 CFU/mL。陈静等[19]采用普通的LAMP技术,实现了检测灵敏度为4.5×101CFU/mL。本实验建立的改良LAMP检测A. acidoterrestris与上述几种快速检测方法具有明显的优势。首先在普通LAMP反应基础上添加荧光染料SYBR GreenⅠ,使得检测的灵敏度明显提高;其次该种检测方法对扩增产物的判定可以通过荧光曲线,琼脂糖凝胶电泳和裸眼观察扩增反应副产物-白色焦磷酸镁沉淀,鉴定结果简单,可依据各个检测机构的条件而选择不同的判定方法。另外,LAMP引物的设计是针对靶基因DNA上6个特定的区域而设计的4条引物,保证了扩增的特异性。但是,在操作时需要注意防污染,避免出现假阳性结果。
从研究结果可知,基于LAMP技术改良的检测方法灵敏度为7.2×100CFU/mL,是普通PCR检测的10倍。对人工污染苹果的检出限为1.8×101CFU/mL,实现了快速高效的检测。因此,改良的LAMP法检测酸土脂环酸芽胞杆菌操作简便、耗时少、特异性强、灵敏度高的优势,适合在食品部门得到推广和应用。
[1] Cai R,Yuan Y,Wang Z,et al.Effects of preservatives on Alicyclobacillus acidoterrestris,growth and guaiacol production[J].International Journal of Food Microbiology,2015,214:145-150
[2] Molva C,Baysal A H.The effect of sporulation medium on Alicyclobacillus acidoterrestris guaiacol production in apple juice[J]. LWT-Food Science and Technology,2016,69:454-457
[3] Chang S S,Kang D H.Alicyclobacillus spp.in the Fruit Juice Industry:History,Characteristics,and Current Isolation/Detection Procedures[J].Critical Reviews in Microbiology,2004,30(2):55
[4] Zhang J,Yue T,Yuan Y.Alicyclobacillus contamination in the production lineofkiwi productsin China[J].PlosOne,2013,8(7):e67704
[5] Huertas J P,Esteban M D,Antolinos V,et al.Combined effect of natural antimicrobials and thermal treatments on Alicyclobacillus acidoterrestris,spores[J].Food Control,2014,35(1):73-78
[6] Alberice J V,Funeshuacca M E,Guterres S B,et al.Inactivation of Alicyclobacillus acidoterrestris in orange juice by saponin extracts combined with heat-treatment.[J].International Journal of Food Microbiology,2012,159(2):130
[7] Steyn C E,Cameron M,Witthuhn R C.Occurrence of Alicyclobacillus in the fruit processing environment——a review.[J].International Journal of Food Microbiology,2011,147(1):1-11
[8] Henczka M,Djas M,Filipek K.Optimisation of a direct plating method for the detection and enumeration of Alicyclobacillus acidoterrestris spores.[J].Journal of Microbiological Methods,2013,92 (1):1-8
[9] Wang Z,Yue T,Yuan Y,et al.Development of Polyclonal Antibody-Based Indirect Enzyme-Linked Immunosorbent Assay for the Detection of Alicyclobacillus,Strains in Apple Juice[J].Journal of Food Science,2012,77(11):643-9
[10]Lin M,Al-Holy M,Chang S S,et al.Rapid discrimination of Alicyclobacillus strains in apple juice by Fourier transform infrared spectroscopy[J].International Journal of Food Microbiology,2006,105 (3):369-376
[11]Rui A F U Y C.Application of lipase and esterase fingerprinting in the rapid identification of thermo-acidophilic bacteria[J].Journal of Northwest A&F University,2012,40(3):163-168
[12]Hartyáni P,Dalmadi I,Knorr D.Electronic nose investigation of Alicyclobacillus acidoterrestris,inoculated apple and orange juice treated by high hydrostatic pressure[J].Food Control,2013,32(1): 262-269
[13]Li J,Xia K,Yu C.Detection of Alicyclobacillus acidoterrestris,inapple juice concentrate by enzyme-linked immunosorbent assay[J]. Food Control,2013,30(1):251-254
[14]Wang Z,Cai R,Yuan Y,et al.An immunomagnetic separation-realtime PCR system for the detection of Alicyclobacillus acidoterrestris in fruit products.[J].International Journal of Food Microbiology, 2014,175(2):30-35
[15]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12): E63
[16]Ye J,Coulouris G,Zaretskaya I,et al.Primer-BLAST:a tool to design target-specific primers for polymerase chain reaction.[J].BMC Bioinformatics,2012,13(1):134
[17]Niessen L,Luo J,Denschlag C,et al.The application of loop-mediated isothermal amplification (LAMP)in food testing for bacterial pathogens and fungal contaminants.[J].Food Microbiology,2013,36 (2):191-206
[18]Piskernik S,Klancˇnik A,Demšar L,et al.Control of Alicyclobacillus,spp.vegetative cells and spores in apple juice with rosemary extracts[J].Food Control,2016,60:205-214
[19]Chen J,Ma X,Yuan Y,et al.Sensitive and rapid detection of Alicyclobacillus acidoterrestris using loop-mediated isothermal amplification.[J].Journal of the Science of Food&Agriculture,2011,91(6): 1070-1074
Development of Loop-mediated Isothermal Amplification Method for Rapid Detection of Alicyclobacillus acidoterrestris
YANG Yue,ZHANG Yun-zhe,ZHANG Xian-zhou,MA Xiao-yan,ZHANG Wei*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,Hebei,China)
Development of loop-mediated isothermal amplification method was established to detect for Alicyclobacillus acidoterrestris(A.acidoterrestris).Taking A.acidoterrestris 16S rRNA gene specific sequence as the target sequence,the primer sequence was designed.The reaction conditions were optimized and results observed by fluorescence curve,agarose gel electrophoresis and turbidity.The specificity,sensitivity and detection limit were detected by this method.The detection could be complished at 61°C within 60 min by LAMP.The specificity of the assay was confirmed using 2 A.acidoterrestris strains and 17 non-A.acidoterrestris strains.The detection sensitivity and detection limit were 7.2 CFU/mL,18 CFU/mL,respectively.The advantages of simple operation,high specificity and sensitivity of LAMP maked it to apply in future.
loop-mediated isothermal amplification(LAMP);Alicyclobacillus acidoterrestris;16S rRNA;detection
10.3969/j.issn.1005-6521.2017.10.038
2016-08-25
杨粤(1991—),女(汉),在读研究生,研究方向:有害微生物检测与控制。
