发酵法生产DHA过程中油脂及DHA质量分数的快速定量测定
2017-05-17赵祥颖张家祥杨丽萍刘建军田延军范宜晓
赵祥颖, 赵 晨, 张家祥, 杨丽萍, 刘建军, 田延军, 范宜晓
(1.山东省食品发酵工程重点实验室,山东 济南 250013;2.山东省食品发酵工业研究设计院,山东 济南 250013)
发酵法生产DHA过程中油脂及DHA质量分数的快速定量测定
赵祥颖1,2, 赵 晨1,2, 张家祥1,2, 杨丽萍1,2, 刘建军1,2, 田延军1,2, 范宜晓1,2
(1.山东省食品发酵工程重点实验室,山东 济南 250013;2.山东省食品发酵工业研究设计院,山东 济南 250013)
针对发酵法生产DHA生产过程实时监控的需求,建立了一种简单、快速、准确的检测菌体细胞中油脂及DHA含量的方法。主要考察了菌体干燥,菌体细胞破壁方法、油脂抽提溶剂、油脂甲酯化方法以及内标选择等对菌体内油脂及DHA含量测定的影响等,确定了以湿菌体为分析样本,采用酸热法细胞破壁、正己烷抽提油脂、十九烷酸甲酯为内标、碱催化甲酯化测定发酵液中油脂及DHA含量方法,整个分析过程可在1~2 h内完成,特别适合DHA发酵过程的中间分析化验。
DHA;油脂分析;发酵控制;海洋真菌
二十二碳六烯酸 (Docosahexaenoic acid,简称DHA)是一种无毒副作用、食用安全的ω-3型多不饱和脂肪酸[1-3]。目前,DHA产品主要来源于深海鱼油,但产品质量会随鱼种类、捕捞季节、地点的差异而不同,且易受环境污染。研究表明鱼类体内的DHA成分是通过食物链蓄积获得,主要来源于海洋微生物[4-5]。以微生物发酵法制备DHA,具有生长周期短,易于大规模培养[6],不饱和脂肪酸成分单一,分离纯化简便等优点,有望替代鱼油成为DHA主要来源。胞内油脂含量及DHA占总油脂的比例是利用微生物发酵生产DHA过程控制的重要技术参数和指标,快速、准确地测定DHA对生产调控具有重要意义。有关DHA生产菌种选育及发酵工艺研究的文献中所采用的DHA测定方法基本相同,具体为:离心收集的菌体细胞,冷冻干燥,冻干菌粉采用超声波进行细胞破壁,再用溶剂萃取油脂[7-8]进行甲酯化,或破壁细胞直接进行甲酯化。甲酯化方法主要有乙酰氯甲醇甲酯化和三氟化硼催化甲酯化,内标多以奇数碳游离脂肪酸或脂肪酸甲酯[9]进行气相色谱测定。上述方法由于菌体细胞冻干所需时间较长,甲酯化步骤较繁琐,整个测定耗时较长,不能满足工业化生产中间过程控制对于发酵参数需实时反馈的需求。为此,作者将针对目前海洋真菌发酵生产DHA的实际需求,开发建立一种适用于工业生产过程控制的快速、准确测定DHA含量方法。
1 材料与方法
1.1 试剂与药品
十九烷酸甲酯标准品,纯度≥99%、十九烷酸标准品,纯度≥99%、正己烷为色谱纯、甲醇、氢氧化钾、盐酸、氯化钠为分析纯。
1.2 菌体细胞培养、收集、干燥
采用裂殖壶菌发酵生产DHA,发酵结束后,准确量取发酵液5 mL,6 000 r/min离心5 min,弃去上清,菌体用去离子水洗涤2次,收集菌体细胞直接或冻干后用于油脂含量和DHA比例的测定。
1.3 细胞破壁和油脂抽提
1.3.1 研磨破壁和油脂抽提 将收集的5 mL发酵液湿菌体或冻干菌体,置于研钵中充分研磨,加入10mL正己烷转移至刻度试管中,充分震荡萃取1 min,静置分层后,取上层清液1mL于用于甲酯化。1.3.2 酸热破壁和油脂抽提 将收集的5 mL发酵液湿菌体或冻干菌体,加入4 moL/L盐酸溶液4 mL,混匀后沸水浴10min,流水冷却至室温冰浴15 min,加入正己烷10 mL,充分震荡萃取1 min,静置分层后,取上层清液1mL于用于甲酯化。
1.3.3 超声破壁和油脂抽提 将收集的5 mL发酵液湿菌体或冻干菌体,加入蒸馏水4mL,混匀后超声处理20min,加入10mL正己烷转移至刻度试管中,充分震荡萃取1min,静置分层后,取上层清液1 mL于用于甲酯化[10]。
1.4 油脂甲酯化方法
1.4.1 标准物质溶液配制 十九烷酸甲酯内标溶液:称取十九烷酸甲酯标准品0.04 g(精确至0.000 1 g),于 10 mL容量瓶中,加入适量正己烷使溶解,然后稀释至刻度,摇匀备用。
十九烷酸标准液:称取十九烷酸标准品0.04 g(精确至 0.000 1 g),于10 mL容量瓶中,加入适量正己烷使溶解,然后稀释至刻度,摇匀备用。
二十二碳六烯甲酯酸标准液:称取二十二碳六烯甲酯标准品0.01 g(精确至 0.000 1 g),于 10 mL容量瓶中,加入适量正己烷使溶解,然后稀释至刻度,摇匀备用。
1.4.2 三氟化硼-甲醇甲酯化 取上述1 mL待测样品中加入内标液1mL、0.5moL/L KOH-甲醇溶液1 mL,混匀后,置65℃水浴15 min,冷却至室温,加入三氟化硼乙醚-甲醇溶液(三氟化硼乙醚)与甲醇体积比为3∶7)3mL,65℃水浴5min,冷却至室温,加入饱和氯化钠溶液2mL、正己烷1 mL,充分震荡,离心分层取上层有机相用于气相色谱分析[9]。
1.4.3 KOH-甲醇甲酯化 向1 mL待测试样中加入内标液1 mL、0.5 mol/L KOH-甲醇溶液0.2 mL,剧烈震荡5 min(或向1 mL待测试样中加入内标液1 mL、4 mol/L KOH-甲醇溶液0.2 mL,剧烈震荡1min),静置或离心分层,取上层有机相用于气相色谱分析。
1.5 菌体细胞油脂含量测定
1.5.1 正己烷萃取法 将收集的5 mL发酵液湿菌体或冻干菌体,置于研钵中充分研磨,加入10 mL正己烷转移至刻度试管中,充分震荡萃取1min,1 000 r/min离心,取上层清液置于旋转蒸发仪中出去有机溶剂,用精密天平秤重,得到油脂质量分数。
1.5.2 氯仿甲醇萃取法 将收集的5mL发酵液湿菌体或冻干菌体,置于研钵中充分研磨,并加入1.5mL蒸馏水,以及5.7 mL氯仿和甲醇体积比为1∶2的混合液,震荡混匀后,加入1.875mL氯仿,震荡混匀,后加入1.875 mL蒸馏水,充分混匀,1 000 r/min离心,取上层清液置于旋转蒸发仪中出去有机溶剂,用精密天平秤重,得到油脂质量分数[7]。
1.6 油脂组成分析测定
1.6.1 气相色谱分析 采用安捷伦GC-7890B气相色谱仪,DB-23(60 mm×0.25 mm×0.25 mm)毛细管柱用于油脂气相色谱分析。选用高纯氮气作为载气,柱流量3.0 mL/min,尾吹流量30 mL/min,气化室温度250℃;检测器为FID检测器,温度280℃,氢气流速40 mL/min,空气流速400 mL/min;柱箱初始温度100℃,之后以25℃/min升至200℃,再以4℃/min升至230℃,保持9 min;进样量为1μL,分流比为30∶1。

1.6.2 DHA及油脂质量分数的计算 采用内标法进行定量测定。式中,Ai为DHA甲酯峰面积;As为内标峰面积;fis为脂肪酸甲酯i相对于内标的相对校正因子;Mi为脂肪酸i的相对分子质量;M甲酯为脂肪酸i甲酯的相对分子质量;m为待测试样质量;ms为内标的质量。
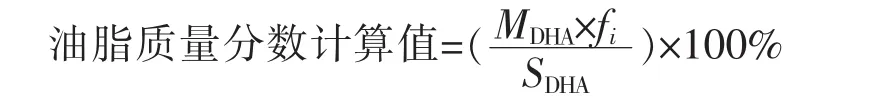
式中,MDHA为DHA质量分数;SDHA为DHA占总脂肪酸的比例;fi为相对校正因子(数值为1.04)。
2 结果与讨论
2.1 菌体干燥对细胞内油脂分析的影响
有关裂殖壶菌等海洋真菌生产DHA文献报道中,细胞内油脂及DHA质量分数的测定通常使用冷冻干燥后的菌体,而在工业生产中,为了对生产过程进行实时监控,需要快速获得检测结果,而将菌体细胞冷冻干燥所需时间比较长,不能满足中间控制要求,因此本文研究探讨直接采用湿菌体进行油脂和DHA含量的可行性。
将离心收集的湿菌体和经冷冻干燥后的菌体分别进行研磨破壁,采用正己烷进行油脂抽提和油脂含量测定,同时采用三氟化硼-甲醇法对所提油脂甲酯化进行色谱分析,计算油脂和DHA质量分数,结果见表1。
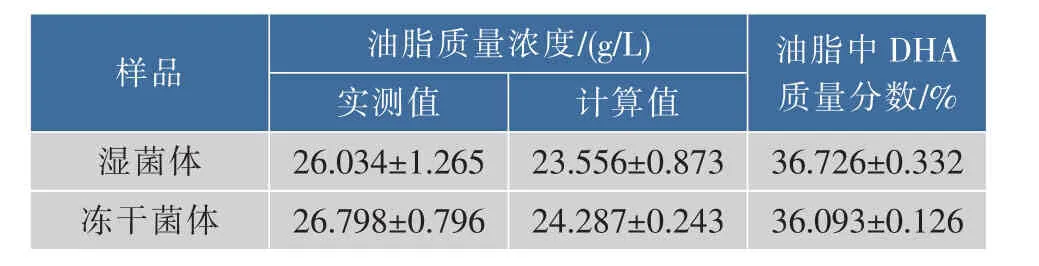
表1 菌体干燥对菌体细胞油脂分析的影响Table 1 Effects of cell freeze-drying on the analysis of lipids and DHA contents
试验结果表明,采用湿菌体和冻干菌体测定的数据差别不显著,说明采用湿菌体进行油脂及DHA质量分数分析是可行的。另,表中数据显示油脂质量浓度的计算值比实测值差别明显,这是因为在油脂分析过程中,油脂中质量分数较低或未被甲酯化的成分出峰峰面积小或没有出峰,计算过程中这些成分就不会计算在内,造成计算值比实测值偏低。这种误差属于系统误差,对于发酵过程数据的监测、比对影响不大。
2.2 抽提溶剂对破壁细胞油脂抽提的影响
一是培养员工爱岗敬业精神。工作中要思想统一,为了共同的工作目标能互不拆台、互相补台,人人都以工作为重。
鱼肉等动物组织中脂肪酸的抽提及含量测定比较经典的方法是Bligh-Dyer法[7],该方法是以氯仿-甲醇为萃取剂萃取样品中的脂肪和脂肪酸,对游离脂肪酸和极性油脂等有较好的抽提效果,油脂提取率比较高。正己烷也是油脂测定中最常用的萃取溶剂,其毒性小,易分离。比较了氯仿-甲醇和正己烷两种萃取剂对湿菌体破壁细胞油脂的抽提效果,DHA含量用三氟化硼-甲醇甲酯化测定,结果见表2。

表2 抽提溶剂对破壁菌体油脂质量分数及DHA比例分析的影响Table 2 Effects of extraction agent on the analysis of lipids and DHA contents
由表2可见,两种萃取剂对裂殖壶菌破壁细胞油脂含量测定结果差别不明显。两种萃取剂抽提的油脂气相分析表明其油脂组成也基本一致,说明菌体细胞中游离脂肪酸和极性脂肪酸含量较低,采用正己烷萃取完全可以满足细胞油脂分析测定要求。
2.3 细胞破壁方法的选择
利用裂殖壶菌等海洋真菌生产DHA,油脂存在于细胞内,必须对菌体破壁后才能进行油脂抽提。菌体破壁常用的方法主要有超声波破壁和研磨破壁,超声破壁过程会产生机械效应、空化效应、热效应,尤其是热效应会使体系温度升高,加之超声破壁所需时间较长,会对油脂中的DHA造成一定的破坏。机械研磨也是油脂测定常用的方法,一般使用研钵或玻璃研磨器,因为方法限制,过程不易标准化,会影响测定结果的准确性。在微生物油脂的研究中,通常采用酸热法[10-11]裂解细胞壁,然后抽提油脂测定其油脂含量和组成。作者考察了上述3种细胞破壁方法对发酵进程中裂殖壶菌湿菌体内油脂和DHA测定的影响,结果见表3。

表3 破壁方法对菌体细胞油脂及DHA质量分数分析的影响Table 3 Effects of cell wall-breaking technologies on the analysis of lipid and DNA contents
从试验结果可以看出,超声破壁所测数据明显偏低,酸热破壁与研磨破壁结果相似。经对破壁效果观察发现,超声破壁所测油脂含量低主要是因为超声破壁不完全,进一步延长破壁时间可以提高油脂实测值,但延长时间也会造成油脂中DHA质量分数降低。研磨破壁由于研钵粗糙度、研磨力度较难量化,测定数据平行性较差;酸热破壁过程标准化程度高数据重现性好,过程简单时间短,是过程控制理想的选择。
不同菌种的细胞壁结构组成不同,导致破壁难易程度差异。作者又考察了酸热法处理时间对裂殖壶菌发酵湿菌体油脂和DHA质量分数测定的影响,结果(表4)显示,酸解时间10min即可达到理想的破壁效果,油脂释放完全。

表4 酸热法处理时间对油脂质量分数及DHA比例分析的影响Table 4 Effects of the duration of acid-heating methods on the analysis of lipids and DHA contents
脂肪酸测定通常采用甲酯化方法将脂肪酸转变为脂肪酸甲酯,再通过气相色谱仪进行定性定量分析。脂肪酸甲酯化方法有酸催化法和碱催化法[12],其中酸催化又包括盐酸催化、硫酸催化、三氟化硼催化等,碱催化有氢氧化钾-甲醇和氢氧化钠-甲醇等方法。酸法催化法步骤繁琐,反应温度高、时间长,但酸催化对游离脂肪酸催化效果好,碱催化可以在室温下进行,反应时间短,但其主要催化转酯化反应,对游离脂肪酸酯化效果差。作者选择十九烷酸和十九烷酸甲酯为内标,比较了三氟化硼催化和氢氧化钾-甲醇催化甲酯化对发酵湿菌体中油脂和DHA含量测定的影响。

表5 甲酯化方法对油脂质量分数及DHA比例分析的影响Table 5 Effects of methyl esterification methods on the analysis of lipids and DHA contents
分析结果(表5)显示,以十九烷酸甲酯为内标,两种甲酯化方法样品的测定结果基本一致,而以十九烷酸为内标,碱催化甲酯化色谱图内标物没有检出,说明碱催化不能使十九烷酸甲酯化,不能选用游离脂肪酸作为内标物。比较两种甲酯化方法的分析结果,油脂中DHA质量分数没有明显的区别,说明两种甲酯化方法都适合发酵湿菌体油脂和DHA质量分数测定。但三氟化硼催化甲酯化方法,步骤多、耗时长,且三氟化硼为剧毒缓化合物,操作危险性较大;相反碱催化可在室温下进行,仅需一步反应,反应时间短,非常适合发酵过程中间化验。裂殖壶菌发酵油脂分析选择十九烷酸甲酯作为内标物,可以很好的适应碱催化甲酯化方法,且平行性较高,同时相对于国标中采用的内标十三烷酸甘油三酯价格低廉,易于采购,适用于规模发酵过程中的数据分析。
2.5 碱催化甲酯化条件的优化
选用的碱催化甲酯化方法,操作简便,反应时间短,国标GB 26400-2011和GB 28404-2012均采用此法,但两标准中采用碱的浓度和反应时间各不相同,比较了这两种甲酯化条件对裂殖壶菌发酵湿菌体油脂分析结果影响。分析结果表明两种国标方法测定的油脂质量分数及DHA比例的结果基本一致,说明此两种方法均可适用于裂殖壶菌指标的测定。为缩短分析时间,选择甲酯化时间相对较短的方法。
3 结语
针对裂殖壶菌发酵生产DHA生产过程监控需要,建立了一种快速、简便、准确的用于发酵液中油脂和DHA含量的测定方法。具体为:取发酵液5~ 10mL,离心收集菌体,洗涤2次,弃去上清,然后加入4moL/L盐酸溶液4mL,混匀后沸水浴10min,冷水冷却至室温,冰浴10 min,加入正己烷10mL,充分震荡1 min,静置分层后,取上层清液1 mL,加入内标液1 mL,4 moL/L KOH-甲醇溶液0.2 mL,剧烈震荡1 min,离心分层,取上层有机相用于气相色谱分析,然后根据内标计算油脂和DHA的质量分数。
作者结合现有的脂肪酸分析方法和微生物菌体油脂测定方法,研究确定了一种快速、准确测定菌体细胞中的油脂和DHA质量分数的分析方法,整个分析过程可在1~2 h完成,方便了对生产过程的优化控制,特别适合DHA发酵过程的中间分析化验。
[1]FEDOROVA D,MARONEPA,BAUTERM,etal.Safety evaluation of DHA-rich Algal oil from Schizochytrium sp[J].Food and Chem ical Toxicology,2011,49:3310-3318.
[2]AIGUO Wu,EM ILY E Noble,ETHIKA Tyagi,et al.Curcumin boosts DHA in the brain:Implications for the prevention of anxiety disorders[J].Biochim ica et Biophysica Acta,2015,1852:951-961.
[3]LYNETTE K Rogers,CHRISTINA J,VALENTINE,et al.DHA supplementation:Current implications in pregnancy and childhood[J].Pharmacological Research,2013,70:13-19.
[4]SIJTSMA L,M.E.de Swaaf.Biotechnologicalproduction and applicationsof theω-3polyunsaturated fatty acid docosahexaenoic acid[J].ApplM icrobiol Biotechnol,2004,64:146-153.
[5]MATILDE SChauton,K jell Inge Reitan,Niels Henrik Norsker,Ragnar Tveteras,Hans T.K leivdal.A techno-economic analysis of industrial production ofmarinemicroalgae as a source of EPA and DHA-rich raw material for aquafeed:Research challenges and possibilities[J].Aquaculture,2015,436:95-103.
[6]LING Xueping,GUO Jing,LIU Xiaoting,etal.Impactof carbon and nitrogen feeding strategy on high production of biomassand docosahexaenoic acid(DHA)by Schizochytrium sp.LU310[J].Bioresource Technology,2015,184:139-147.
[7]BLIGH EG,DYERW J.A rapidmethod of total lipid extraction and purification[J].Biochem Physiol,1959,37:911-917.
[8]CHEN IS,SHEN CSJ,SHEPPARD A J.Comparasion ofmethylene chlorideand chloroform for theextraction of fats from food products[J].Oil Chem,1981,58:599-601.
[9]JIN Lijing,REN Lujing,JI Xiaojun,et al.Fast determination of DHA produced by marine fungi[J].Chinese Journal of Bioprocess Engineering,2010,8(4):67-71.(in Chinese)
[10]KONG Fanm in,ZHAO Xiangying,LIU Jianjun.Lipid extraction of yeastby acid-heating extraction[J].China Brew ing,2010(5):143-146.(in Chinese)
[11]CHOIS A,JUNG JY,KIM Kyochan.Acid-catalyzed hot-water extraction of docosahexaenoic acid(DHA)-rich lipids from Aurantiochytrium sp.KRS101[J].Bioresource Technology,2014,161:469-472.
[12]Ruiz-Rodriguez A,Reglero G,Ibanez E.Recent trends in the advanced analysis of bioactive fatty acids[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51:305-326.
Fast Quantitative Analysis of Lipids and DHA Contents During Fermentation Process for DHA Production
ZHAO Xiangying1,2, ZHAO Chen1,2, ZHANG Jiaxiang1,2, YANG Liping1,2,LIU Jianjun1,2, TIAN Yanjun1,2, FAN Yixiao1,2
(1.Shandong Provincial Key Laboratory of Food and Fermentation Engineering,Jinan 250013,China;2.Shandong Food Ferment Industry Research&Design Institute,Jinan 250013,China)
A simple,fast and accurate method was established to determ ine the composition and contents of lipids and docosa-hexaenoic acid (DHA)during fermentation process for DHA production.The detection for lipids and DHA contents in Schizochytrium was optim ized by drying methods,cell disruptionmethods,theways of lipid extraction,themethods ofmethyl esterification and the selection of internal standards.The optimal analysis used an acid-heating method for cell disruption,n-hexane for lipid extraction,nonadecanoic acidmethylester as the internal standard and methyl esterification catalyzed by alkali catalyst.It was particularly suitable for the intermediate analysisduring fermentationprocessforDNAproductionwhichcouldbeaccomplishedw ithin1-2hours. Keywords:DHA,lipidsanalysis,fermentation control,marine fungi
TS 222
A
1673—1689(2017)04—0405—05
2015-05-29
山东省科技发展计划项目(2014GSF121038)。
赵祥颖(1968—),女,江苏沛县人,理学硕士,研究员,主要从事工业微生物研究。E-mail:xyzhao68@126.com
赵祥颖,赵晨,张家祥,等.发酵法生产DHA过程中油脂及DHA含量的快速定量测定[J].食品与生物技术学报,2017,36(04):405-409.
