玛咖水提物抗小鼠前列腺增生作用
2017-05-17张连富
邹 莹, 张连富*,3
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2江南大学 食品学院,江苏 无锡 214122;3.国家功能食品工程技术研究中心,江南大学,江苏 无锡214122)
玛咖水提物抗小鼠前列腺增生作用
邹 莹1,2, 张连富*1,2,3
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2江南大学 食品学院,江苏 无锡 214122;3.国家功能食品工程技术研究中心,江南大学,江苏 无锡214122)
探讨了玛咖水提物抗前列腺增生的药效物质及其作用机理。将50只雄性ICR小鼠随机分为空白组、模型组、阳性药组,玛咖组(60mg/kg,含苄基芥子油苷1.44mg/kg)及苄基芥子油苷组(1.44mg/kg)。除空白组外,其他组连续30 d皮下注射丙酸睾酮(5.0mg/kg),制造小鼠前列腺增生模型,观察各组小鼠前列腺湿重、前列腺指数;血清中睾酮(T)、雌二醇(E2)、T/E2水平和前列腺酸性磷酸酶的影响及镜下病理学改变。结果显示,与模型组相比,玛咖组和苄基芥子油苷组小鼠前列腺湿重及前列腺指数显著降低(P<0.01),血清T、DHT含量和T/E2比值明显降低(P<0.05或P<0.01),光镜下见前列腺增生程度大为减轻,增生的腺上皮乳头减少或消失,玛咖组的结果与苄基芥子油苷组相似。结果表明,玛咖水提物和苄基芥子油能显著抑制小鼠前列腺增生;苄基芥子油苷是玛咖水提取物抗前列腺增生主要的活性物质。
前列腺增生;苄基芥子油苷;玛咖水提物;丙酸睾酮;抑制作用
良 性 前 列 腺 增 生 症 (benign prostatic hyperplasia,BPH)属于中老年男性常见病,它是前列腺尿道周围区细胞的良性腺瘤性增生表现为尿道周围前列腺腺体进行性增生,从而引起下尿路症状,最终导致膀胱及肾功能损害,严重影响患者的生活质量[1-2]。玛咖(Lepidium meyenii),俗称玛卡、马卡,英文俗称MACA,属十字花科(Brassicaceae)独行菜属(Lepidium)一年生或两年生草本植物,原产于南美安第斯山脉海拔 3 500以上的山区[3]。长期以来,玛咖被认为有抗氧化、抗疲劳、增强免疫力、改善性功能、调节内分泌、提高生育力,同时还可应用于风湿症、呼吸疾病、抑郁症、贫血症、女性更年期综合征等病症的治疗[4]。玛咖中特有的具生物活性的功效成分,如玛咖烯、玛咖生物碱、芥子油苷、异硫氰酸酯、玛咖酰胺、甾醇等具有重要的药理作用[5-8]。Yabar等[9]研究3种生态型玛咖收获前、采收、收获后干燥系列工序的芥子油苷曲线图,通过含量和黑芥子酶活性的影响时发现收获期间的6种芥子油苷,其中苄基芥子油苷在3种生态型中含量最丰富,占总芥子油苷质量的80%。M.Gasco等人研究红玛咖对睾酮诱发良性前列腺增生大鼠的影响,发现红玛咖提取物中苄基芥子油苷剂量不同对前列腺质量减小产生影响,推断苄基芥子油苷可能是玛咖的生物活性成分,但是红玛咖中存在的其他次级代谢物也可能影响前列腺大小[8]。玛咖中的苄基芥子油苷可能与其抑制前列腺增生的功能有关,但缺乏具体的研究证明。作者为阐明玛咖抑制前列腺增生的有效物质及作用机理提供实验依据。
1 材料与方法
1.1 药品与试剂
玛咖水提物粉末:日本 Tokiwa Phytochemical公司产品; 苄基芥子油苷: 日本Tokiwa Phytochemical公司 产 品 ; 丙酸睾 酮 注 射 液(Testosterone propionate,TP):上海通用药业股份有限公司产品;睾酮酶联免疫分析试剂盒、雌二醇酶联免疫分析试剂盒、前列腺酸性磷酸酶和双氢睾酮酶联免疫分析试剂盒:上海江莱生物科技有限公司产品。
1.2 实验动物
ICR小鼠,雄性,体质量(24±2)g,SPF级,由上海格瑞斯威公司提供。试验期间小鼠自由取食和饮水,室温(22±2)℃,湿度(55±5)%,通风,12 h/12 h明暗周期。每周测体质量1次,并根据体质量调整丙酸睾酮注射容积和给药容积。
1.3 主要仪器
电子天平:Mettler公司产品;高速剪切乳化机FA25:德国FLUKO Equipment Shanghai有限责任公司产品。
2 方法
2.1 分组、造模与给药
取ICR雄性小鼠50只,小鼠适应性饲养一周后,随机分为5组,每组10只。各组分别为:①空白组;②模型组;③阳性药组(非那雄胺1 mg/kg);④玛咖组 (60mg/kg);⑤苄基芥子油苷组 (1.44mg/ kg)。于第1天开始,除正常对照组皮下注射大豆油外,另外4组实验组各鼠皮下注射丙酸睾酮(5 mg/(kg/d),连续30 d)[9],分别给③、④、⑤组小鼠灌胃非那雄胺、玛咖、苄基芥子油苷,正常对照组和模型组不给药,灌胃等容量的生理盐水,每天灌胃1次。
2.2 取材和结果处理
连续灌胃30 d后,禁食12 h。每组小鼠分别称其体重后,眼静脉丛取血,分离血清,采用双抗体一步夹心法酶联免疫吸附试验 (ELISA)进行睾酮(testosterone,T)、雌二醇(estradiol,E2)、双氢睾酮(dihydrotestosterone,DHT)含量和前列腺酸性磷酸酶(prostatic acid phospatase,PAP)活性的测定;颈椎脱臼法处死小鼠,剥离前列腺周围组织,摘取前列腺迅速称重,计算各组小鼠前列腺湿质量的平均值,前列腺指数及抑制率(指数=前列腺质量(mg)/体质量(g),抑制率=100((处理组-阴性对照组)/(阳性对照组-阴性对照组)×100))。其后将前列腺组织用体积分数10%甲醛固定,4℃冰箱保存,石蜡包埋,切片,厚4μm,HE染色,光镜下观察各组前列腺组织的细胞学形态。
2.3 统计学分析
实验数据采用SPSS 16.0统计软件处理。将检测结果计算均值和标准差(x±sd),组间比较采用非参数Mann-Whitney U检验。
3 结果
3.1 玛咖和苄基芥子油苷对小鼠前列腺湿质量和前列腺指数的影响
如表1所示,TP处理前后小鼠体质量没显著差异。与正常对照组相比,模型组的前列腺湿质量及指数增大,差异存在统计学意义(P<0.01)。玛咖组(60 mg/kg)和苄基芥子油苷组(1.44 mg/kg)的前列腺湿质量和前列腺指数均显著低于模型组 (P<0.01)。玛咖和苄基芥子油苷前列腺湿质量抑制率分别为84.02%和73.46%,前列腺指数抑制百分率分别为87.48%和77.31%(见表1)。
表1 玛咖水提物和苄基芥子油苷对小鼠前列腺增生模型前列腺湿重和指数的影响(n=10,X±SD)Table 1 Effects of oral adm inistration of M aca aqueous extract and benzyl glucosinolate on body weights and prostatic index in testosterone propionate treated m ice(n=10,±SD)
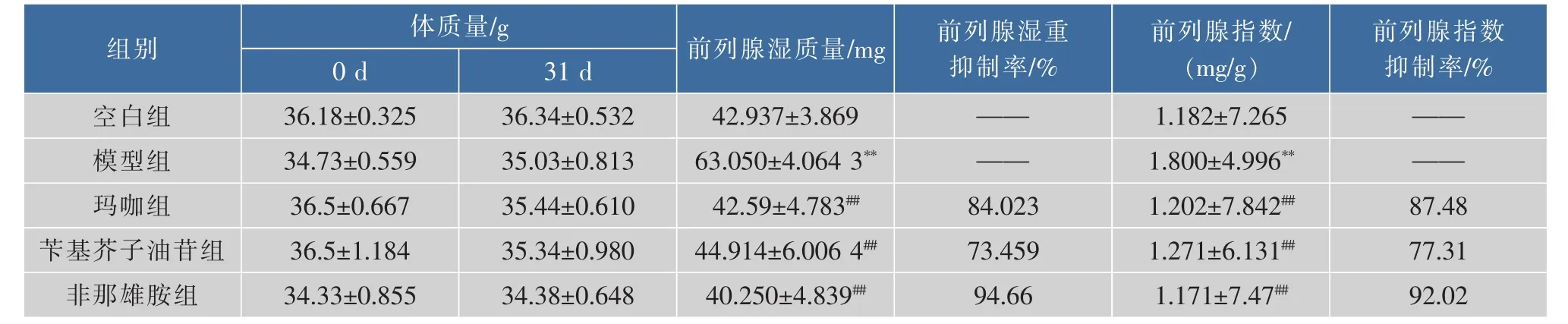
表1 玛咖水提物和苄基芥子油苷对小鼠前列腺增生模型前列腺湿重和指数的影响(n=10,X±SD)Table 1 Effects of oral adm inistration of M aca aqueous extract and benzyl glucosinolate on body weights and prostatic index in testosterone propionate treated m ice(n=10,±SD)
注:模型组与空白组比较,**P<0.01;不同治疗组与模型组比较,##P<0.01。
前列腺指数抑制率/% 0 d 31 d空白组 36.18±0.325 36.34±0.532 42.937±3.869 —— 1.182±7.265 ——模型组 34.73±0.559 35.03±0.813 63.050±4.064 3**—— 1.800±4.996**——玛咖组 36.5±0.667 35.44±0.610 42.59±4.783##84.023 1.202±7.842##87.48苄基芥子油苷组 36.5±1.184 35.34±0.980 44.914±6.006 4##73.459 1.271±6.131##77.31非那雄胺组 34.33±0.855 34.38±0.648 40.250±4.839##94.66 1.171±7.47##92.02组别 体质量/g 前列腺湿质量/mg 前列腺湿重抑制率/%前列腺指数/(mg/g)
3.2 玛咖水提物和苄基芥子油苷对小鼠血清性激素水平和前列腺酸性磷酸酶活性的影响
如图1(c)和图1(d)所示,与空白组相比,模型组小鼠血清T水平显著升高(P<0.01),可能与皮下注射TP有关,而E2水平与空白组相比差异无统计学意义,表明在性腺存在的条件下皮下注射TP可使小鼠体内T含量显著升高,而对E2水平无明显影响,模型小鼠的前列腺组织在外源性雄激素的作用下出现增生。
与模型组相比,苄基芥子油苷组可显著降低模型小鼠血清中的T水平(P<0.01),但玛咖组T水平与模型组没有显著性差异;与模型组相比,玛咖组和苄基芥子油苷组的E2均有显著提高 (P<0.01),但血清中的T/E2的比值均有显著下降(P<0.01),与空白组比较,则无明显差异(图1(b)和(c))。实验结果表明苄基芥子油苷具有明显降低TP致前列腺增生模型小鼠血清中T水平和升高E2水平的作用;提示玛咖组和苄基芥子油苷组抑制模型小鼠前列腺增生的作用可能与其降低雄激素水平、升高雌激素水平有关,改善模型小鼠体内的雌、雄激素比例,从而发挥抗前列腺增生作用。
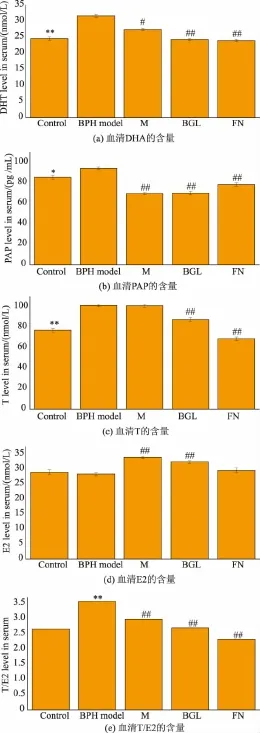

注:Control:空白组;BPH model:模型组;M:玛咖组;BGL:苄基芥子油苷组;FN:非那雄胺组。模型组与空白组比较,**P<0.01,*P<0.05;不同治疗组与模型组比较,##P<0.01,#P<0.05。图1 玛咖水提物和苄基芥子油苷对小鼠前列腺增生模型血清中PAP、DHT、T、E2和T/E2的影响Fig.1 Effects of M aca aqueous extract and benzyl glucosinolate on PAP,DHT,T,E2 and T/E2 in serum
从图1(a)和图1(b)可看出,与空白组相比,模型组小鼠血清中DHT和PAP含量水平明显升 (P<0.05),玛咖组、苄基芥子油苷组与模型组比较有显著性差异(P<0.05),能显著降低实验前列增生模型组小鼠血清中PAP的活性和血清DHT水平;各给药组与空白组比较,则无明显差异。试验结果表明玛咖和苄基芥子油苷均具有抑制前列腺增生模型小鼠前列腺增生,降低模型小鼠PAP的活性和DHT水平的作用。
3.3 玛咖水提物和苄基芥子油苷对小鼠前列腺组织病理学改变的影响
各组前列腺切片镜检结果表明,空白组小鼠前列腺上皮为单层柱状或单层立方上皮构成,腺体较均匀排列,个别腺体腺腔增大,腺腔内有大量的前列腺分泌物腺腔规则,腺体和腺细胞丰富饱满;模型组小鼠前列腺腺体和腺细胞出现明显增生,大部分腺体呈乳头状向腔内突出;腺上皮部分呈高柱状,细胞层次增加,细胞体积增大,细胞质较稀少。可见增生腺体排列紧密,腺上皮细胞数目增多,呈复层或假复层,增生的上皮乳头相互交汇呈层叠或迷路状结构,乳头间成裂隙状腺腔,腺腔内无或仅有少许粉染分泌物;非那雄胺组小鼠的前列腺明显腺体减少,间质增多,腺体也明显减小。玛咖组腺体和腺细胞增生不明显,腺体少量增生,呈乳头状向腔内突出,上皮为为单层柱状上皮,少数呈高柱状,分泌物减少;苄基芥子油苷组小鼠前列腺增生程度大为减轻,大小比较一致,腺细胞丰富饱满,排列整齐,接近正常腺体;非那雄胺治疗组,腺体和腺细胞增生不明显,有少数腺体和细胞出现增生,分泌功能增强,细胞变得明亮增大,见图2。
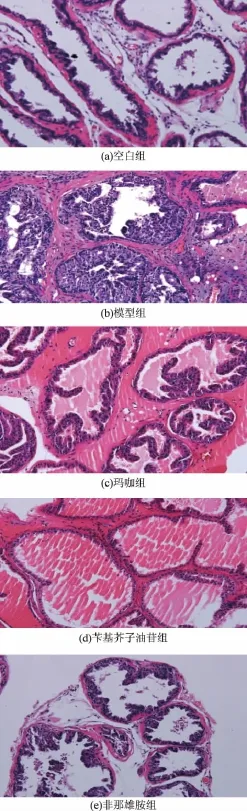
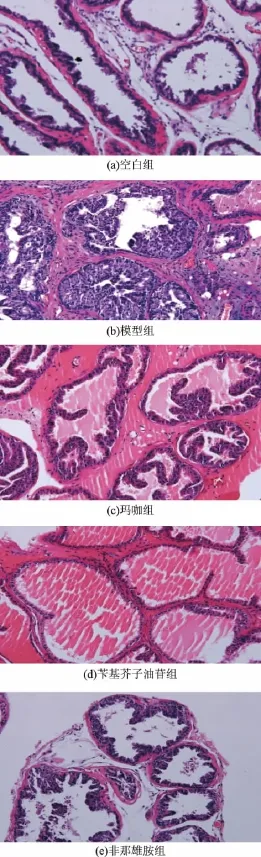
图2 玛咖和苄基芥子油苷对小鼠前列腺组织结构的影响(×200)Fig.2 Effects of M aca aqueous extract and benzyl glucosinolate on histoarchitecture of prostate(× 200)
4 讨论
西药治疗是目前治疗良性前列腺增生的主要方法,但花费高而且有副作用。因此温和,有效,低副作用的植物有效成分提取物和保健品越来越受到人们的关注和欢迎。
研究结果显示玛咖水提物和苄基芥子油苷对TP诱发的前列腺增生具有明显抑制作用。与模型组相比,玛咖和苄基芥子油苷能显著降低小鼠前列腺湿重和指数增高,抑制PAP活力并降低DHT水平。玛咖、苄基芥子油苷能抑制5α-还原酶活性进而降低DHT水平。但玛咖不影响雄性激素受体和T,但它影响前列腺,这表明与苄基芥子油苷和非那雄胺不同,玛咖作用于前列腺5α-还原酶反应后期。玛咖水提物对前列腺湿质量和前列腺指数的抑制率强于苄基芥子油苷,可能是因为玛咖中可能存在其他的活性成分对前列腺湿质量和指数的抑制有协同增效作用。玛咖水提物和苄基芥子油苷同时能显著提高小鼠血清E2水平,抑制T/E2升高,调节性激素平衡,前列腺增生得到抑制,但玛咖水提物中活性成分可能对血清激素水平造成影响,因此苄基芥子油苷组的激素水平更接近空白对照组。玛咖和苄基芥子油苷对前列腺增生的抑制作用相似,根据HPLC数据,玛咖水提物的苄基芥子油苷含量与苄基芥子油苷的剂量相同,都是1.44mg/kg,由此推断玛咖水提物抑制前列腺增生的主要活性物质很可能是苄基芥子油苷。进一步研究苄基芥子油苷在抗前列腺增生中所扮演的角色,将有助于阐明玛咖抑制前列腺增生的分子机制。玛咖对前列腺增生的抑制作用效应较为温和,显示了其作为安全有效的防治男性良性前列腺增生类植物保健品的良好开发前景。
[1]HE Leye.Clinical study of lower urinary tract symptoms and benign prostatic hyperplasia[J].Changsha:Central South University,PhD.2010.
[2]SHEN Nan,REN Kuang,WANGYanchun,etal.Inhibitory effectof secoisolariciresinoldiglusosideon hyperplasia of prostate in ratsand itsmechanism[J].J Jilin Univ(Med Edi),2011,37(2):288-291.
[3]XU Tiancai,XUERunguang,YANGShaohua,etal.Study on thepowder-characteristicsofmacaused asmedicineand food[J].J Chinese Agri Sci Bull,2012,28(12):241-247.
[4]JINWenwen.Study on the functional factors of Lepidium meyenii,a plantw ithmedicine and food characteristics[J].W uhan:Huazhong University of Science&Technology,2006.
[5]LILei,ZHOU Shengsheng.Nutrition,food security assessmentand developmentprospectsofMaca[J].Sci Techn Food Indus,2012,33(5):376-379.
[6]SHENWeizhi,ZHOU Yuxiao,LIN Guangyue,etal.Bioactive constituents and anti-fatigue effects in vivo of Lepidium meyenii(Maca)[J].J Food Sciand Bio,2014,33(7):721-726.
[7]GUSTAVO FGonzales,SARA M iranda,JESSICA Nieto,etal.Redmaca(Lepidium meyenii)reduced prostate size in rats[J]. Reprod Biol Endocrin,2005,3(5):1-16.
[8]GASCO M,VILLEGAS L,YUCRA S,et al.Dose-response effect of Red Maca(Lepidium meyenii)on benign prostatic hyperplasia induced by testosteroneenanthate[J].Phytomedicine,2007,14:460-464.
[9]EM ILIO Yábar,ROM INA Pedreschi,ROSANA Chirinos,etal.Glucosinolate contentandmyrosinase activity evolution in three maca(Lepidium meyenii Walp.)ecotypes during preharvest,harvest and postharvest drying[J].Food Chem,2011,127:1576-1583.
[10]GUO Qinglong,DING Qilong,WU Zhaoqiu.Effectof baicalein on experimental prostatic hyperplasia in rats andm ice[J].Biol Pharm Bull,2004,27(3):333-337.
Protective Effects of Lepidium Meyenii(M aca)Aqueous Extract on Benign Prostatic Hyperp lasia in M ice
ZOU Ying1,2, ZHANG Lianfu*1,2,3
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.National Engineering Research Center For Functional Food,Jiangnan University,Wuxi214122,China)
The main substance in Maca aqueous extract responsible for the inhibition of benign prostatic hyperplasia(BPH)inm icewas investigated in thisstudy and themechanism was discussed. Fifty male ICR m ice were random ly divided into five groups:the control group,the BPH model group,the finasteride group,the Maca extract group treated w ith 60 mg/kg Maca(containing 1.44 mg/kg benzylglucosinolate)and the benzylglucosinolate group w ith a dose of 1.44mg/kg.BHPwas induced in allm ice by subcutaneous injection of testosterone propionate(TP,5.0 mg/kg)w ith the controlgroup excepted.The inhibitory effectson BPH ofMaca extractand benzylglucosinolatewere evaluated using the prostate wet weight,the prostatic index (PI),testosterone (T),dihydrotestosterone(DHT),estradiol(E2),the value of T/E2,the prostatic acid phospatase(PAP)inserum and histopathology exam ination.Comparing w ith the BPH model group,the Maca extract group and benzyl glucosinolate group significantly decreased the prostate wetweight and PI(P<0.01),aswellas the valuesof T,DHT and T/E2 in serum(P<0.05 or P<0.01).A great reduction of BPH was observed w ith the prostate glandular hyperplasia reduced or disappeared.The similar histological effects were achieved for the Maca group and benzyl glucosinolate group.The results confirmed an effective inhibition of BPH in m ice by the Maca aqueous extract and benzyl glucosinolatewhichwas suggested as themain bioactive component in Maca extract.
Benign prostatic hyperplasia,benzyl glucosinolate,maca aqueous extract,testosterone propionate,inhibition effect
R 697.32
A
1673—1689(2017)04—0371—05
2015-05-02
国家自然科学基金项目(31171724);国家“十二五”科技支撑计划项目(2012BAD33B05)。
*通信作者:张连富(1967—),男,河北唐山人,工学博士,教授,博士研究生导师,主要从事功能性食品研究。E-mail:lianfu@jiangnan.edu.cn
邹莹,张连富.玛咖水提物抗小鼠前列腺增生作用[J].食品与生物技术学报,2017,36(04):371-375.
