镉对刺参幼参体内金属硫蛋白含量及其变化规律的影响
2017-05-17张丛尧吴反修张建强左然涛马悦欣常亚青周玮
张丛尧,吴反修,张建强,左然涛,马悦欣,常亚青,周玮
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市水产产业技术创新联合会,辽宁大连116023;3.全国水产技术推广总站,中国水产学会,北京100125)
镉对刺参幼参体内金属硫蛋白含量及其变化规律的影响
张丛尧1、2,吴反修3,张建强2,左然涛1,马悦欣1,常亚青1,周玮1、2
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连市水产产业技术创新联合会,辽宁大连116023;3.全国水产技术推广总站,中国水产学会,北京100125)
为评价水体中镉(Cd2+)对刺参Apostichopus japonicus体内金属硫蛋白(MT)的诱导效果,以刺参幼参(体质量8.87 g±1.12 g)为研究对象,在水温16~18℃下,探讨水体中不同浓度Cd2+(<0.005、0.025、0.050、0.250、0.500 mg/L)胁迫下幼参体内MT含量随Cd2+胁迫时间(0、12、36、60、84、108 h)的变化规律。结果表明:随着Cd2+胁迫时间的延长,幼参肠道、呼吸树和体壁中MT含量呈先升高后趋于平稳的趋势,且在36 h时各组织中MT含量最高或相对较高;Cd2+胁迫36 h时,幼参体内MT含量依次为肠道>呼吸树>体壁,且Cd2+胁迫后幼参各组织间MT含量有显著性差异(P<0.05);各时间点下,Cd2+浓度试验组幼参肠道、呼吸树和体壁中MT含量均显著高于对照组(P<0.05);在Cd2+胁迫各时间点,幼参肠道和呼吸树中MT含量随Cd2+浓度的升高呈显著“阶梯式”升高(P<0.05),体壁中MT含量则随Cd2+浓度的升高而升高,Cd2+浓度为0.025、0.050 mg/L时,体壁中MT含量相差不大(P>0.05),但均显著低于Cd2+浓度最高组(0.500 mg/L)(P<0.05)。研究表明,水体中的Cd2+可诱导刺参组织合成金属硫蛋白,其中对肠道和呼吸树的诱导效果最明显,36 h即可达到较为显著的诱导效果,因此,刺参肠道和呼吸树组织中的MT含量可作为评价水体中重金属Cd2+污染的生物标志物。
镉;刺参;组织;金属硫蛋白
镉是一种常见的毒性较强的重金属污染物,主要通过水和食物进入水生生物体内,并具有很长的潜伏期。它与生物体内的疏基蛋白结合,可抑制多种酶活性或使酶失活[1],从而影响生物体的生长和繁殖。
金属硫蛋白(metallothionein,MT)是一类广泛存在于生物体内的低分子量(相对分子质量通常小于10 000)、富含半胱氨酸的金属结合蛋白或多肽[1-3],具有广泛的生物学功能,可参与机体微量元素的储存、运输和代谢,清除羟基自由基以及解除重金属的毒性等。至今已发现60多种海洋无脊椎动物中存在MT[4-6]。大量研究证明,在重金属银(Ag+)、镉(Cd2+)、铜(Cu2+)、汞(Hg2+)、锌(Zn2+)等诱导下,生物体内MT含量会显著增加,且这种诱导与环境中金属浓度具有一定的相关性,因此,MT可作为指示有毒重金属污染的生物标志物[7]。目前,国内外对重金属暴露下水生生物不同组织中MT的合成、表达及动态变化,在贝类、虾蟹类、鱼类和其他海洋生物中已有报道[8-14]。
刺参Apostichopus japonicus是中国记载的21种食用海参中唯一分布于黄渤海的温带种类,在江苏连云港、山东半岛、辽东半岛、河北北戴河等沿海均有分布,具有极高的营养价值,为“海产八珍”之一[15]。有关镉在刺参中的沉积规律及其对刺参机体免疫性能影响的研究已有一些报道[16-20],但有关镉对刺参体内MT诱导的相关研究报道较少。因此,本研究中探讨了重金属镉胁迫下幼参体内MT的合成及其动态变化规律,旨在为评价重金属镉的污染效应提供相应的毒理学资料,为海参养殖的水环境监测及海参健康养殖提供理论依据。
1 材料与方法
1.1 材料
试验用刺参幼参选自大连金砣水产食品有限公司育苗场。试验前先将幼参在沙滤海水中驯养2周。驯养期间水温为16~18℃,光照<600 lx,连续充气以保证水中溶氧,每天早晚各投喂自配幼参饵料1次,每天清底换水1次,染毒试验前2 d停止投饵。驯养期间幼参生长明显,成活率为100%。
试验用沙滤海水盐度为31.5~32.0,pH为8.1~8.2,氨氮含量<0.12 mg/L,水质指标均符合GB11607—89渔业水质标准;试验用氯化镉(CdCl2·2.5H2O)、三羟甲基氨基甲烷、盐酸均为分析纯,购自国药集团化学试剂有限公司,牛血红蛋白(Solarbio)为北京索莱宝科技有限公司生产。
1.2 方法
1.2.1 重金属Cd2+浓度的设置 经检测,沙滤自然海水中Cd2+含量为0.18 μg/L。以GB 11607-89渔业水质标准中Cd2+质量浓度≤0.005 mg/L为对照组,用CdCl2·5H2O分别配制成Cd2+浓度为0.025、0.050、0.250、0.500 mg/L的4个浓度组,对照组及各浓度组均设置3个平行。
1.2.2 幼参染毒试验 采用静态水质接触染毒,试验在PVC水槽(50 L)中进行。对照组及各浓度组共用15个水槽,均放置30头经事先驯养的健康幼参(体长7.45 cm±0.53 cm,体质量8.57 g± 1.12 g),在水温为16~18℃、连续充气条件下进行染毒试验。试验期间不投饵料,每天换水1次,每次换水1/2,并补充Cd2+至其原有浓度。
1.2.3 组织样品的选取及预处理 分别在染毒0、12、36、60、84、108 h时取样分析不同质量浓度Cd2+胁迫下幼参不同组织中MT含量的变化。从每一水槽中随机取幼参4头,用吸水纸吸干体表,置于冰盘中解剖,分别取出其肠道和呼吸树并切取体壁组织0.1 g,用预冷的去离子水(0~4℃)洗去其表面的组织液和杂质,用吸水纸吸干后将4头幼参的各种组织归类放在一起用分析天平分别称重,然后放入超低温冰箱(-80℃)中冷冻保存备用。
1.2.4 MT含量的分析测定与计算 采用金属/血红蛋白饱和法测定MT含量[21]。将冷冻组织(肠道、呼吸树和体壁)样品解冻后,分别放入10 mL的匀浆器中,按1 g组织样品加入4 mL缓冲液的比例,加入预冷的Tris-HCl缓冲液(pH 8.6),进行冰浴匀浆;匀浆液用2-16 K低温冷冻离心机(SIGMA)离心(0℃,10 000 r/min)30 min;用移液枪吸取0.2 mL上清液注入1.5 mL离心管中,同时加入0.5 mL质量浓度为0.01 mol/L的Cd2+,充分混合后在室温下放置15 min;向其中加入0.2 mL的牛血红蛋白(质量分数为2%),充分混合后放入80℃的水浴锅中水浴加热3 min,再离心(0℃,10 000 r/min)10 min,移取上清液置于新的离心管中;重复加牛血红蛋白步骤2次,将所得的上清液全部取出;用原子吸收分光光度法测定上清液中重金属Cd2+的含量以计算Cd-MT的含量。
因每分子MT可结合7个Cd2+[22],Cd-MT的相对分子质量按照9799计[23],故1 g幼刺参组织中Cd-MT含量(μg/g)的计算公式为
Cd-MT=CCd×V×9799×VS/(G×7×112.4×VN)。其中:CCd为上清液中Cd2+的浓度(μg/mL);V为组织匀浆体积(mL);VS为测定时所取上清液的体积(mL);G为取样组织的质量(g);VN为匀浆后的取样体积(mL)。
1.3 数据处理
试验结果采用SPSS 19.0软件进行统计分析,在单因素方差分析(ANOVA)达到显著水平时(P<0.05),采用Turkey's检验进行组间多重比较,试验数据均以平均值±标准差表示(n=3)。
2 结果与分析
2.1 Cd2+胁迫作用下幼参组织中MT含量的变化
从表1可见:随时间的延长,对照组(Cd2+浓度<0.005 mg/L)幼参肠道、呼吸树和体壁的MT含量无显著性变化(P>0.05);Cd2+浓度试验组幼参3种组织的MT含量均呈先显著升高后趋于平稳的变化趋势;36 h时,Cd2+浓度试验组肠道中MT含量最大,显著高于0、12 h的对应值(P<0.05),但与60、84、108 h所对应的数值均无显著性差异(P>0.05);36 h时,呼吸树和体壁中MT含量在Cd2+浓度为0.500 mg/L时最大,但此时其他浓度试验组呼吸树和体壁MT也具有相对较高的含量,且与60、84、108 h所对应的数值无显著性差异(P>0.05)。
从表1还可见:各时间点下,Cd2+浓度试验组幼参肠道、呼吸树和体壁中MT含量均显著高于对照组(P<0.05);随着水体中Cd2+浓度升高,幼参肠道和呼吸树MT含量在各时间点(12、36、60、84、108 h)均呈“阶梯式”增长,即Cd2+诱导MT的能力呈现高浓度组>低浓度组>对照组,且各组间(除呼吸树12 h时0.050 mg/L与0.250 mg/L浓度组外)均有显著性差异(P<0.05);各时间点下,体壁的MT含量也随Cd2+胁迫浓度的增加而升高,其中0.025、0.050 mg/L Cd2+浓度组体壁的MT含量无显著性差异(P>0.05),但二者均显著低于0.500 mg/L Cd2+浓度组(P<0.05)。
2.2 Cd2+胁迫后幼参各组织中MT合成量的比较
从图1可见:试验结束时,Cd2+浓度试验组幼参肠道、呼吸树和体壁的MT含量均显著高于对照组(P<0.05),且在Cd2+浓度最高时达到最大值,各组织MT含量依次为肠道(6.67 μg/g)>呼吸树(4.94 μg/g)>体壁(3.39 μg/g)(P<0.05);而对照组肠道MT含量显著高于体壁(P<0.05),其余组织间无显著性差异(P>0.05)。
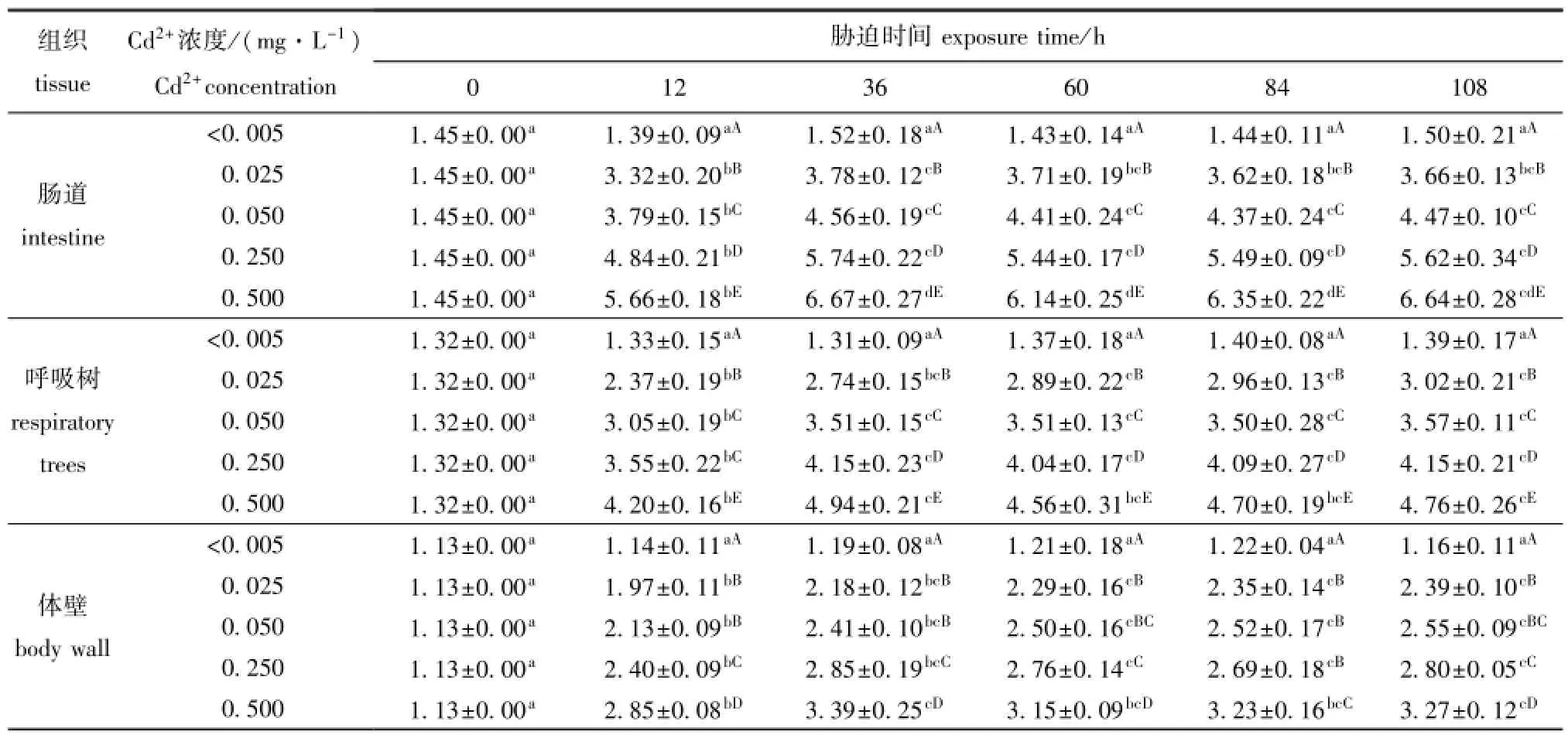
表1 各浓度Cd2+胁迫不同时间对幼参肠道、呼吸树和体壁中金属硫蛋白含量的影响Tab.1 Metallothionein(MT)contents in the intestine,respiratory trees,and body wall of juvenile sea cucumberApostichopus japonicusexposed to various concentrations of cadmium at different timeμg/g
3 讨论
3.1 Cd2+对幼参3种组织MT含量诱导的剂量和时间效应
大量研究证明,在重金属诱导下,生物体内MT含量会显著增加,且这种诱导作用与环境中金属离子的浓度具有一定的正相关性[7]。本研究结果显示,在质量浓度为0.025~0.500 mg/L的Cd2+胁迫下,随着Cd2+浓度的增大,幼参肠道和呼吸树的MT含量显著升高,并表现出明显的剂量-效应关系,Cd2+高浓度组对MT的诱导作用显著大于低浓度组,这表明水中的Cd2+可诱导幼参体内MT的合成和表达。随着胁迫时间的延长,幼参3种组织中的MT含量均表现为先快速升高后趋于平稳的趋势,且在一定时间内呈现明显的剂量-效应关系,表明此剂量-效应关系和处理时间有明显的相关性,即在Cd2+胁迫后的36 h时具有较为显著的诱导效果。本研究结果还表明,在幼参3种组织中MT的诱导量表现为Cd2+高浓度组>低浓度组>对照组,且水中Cd2+对幼参组织MT的诱导作用在36 h时达最大或较大诱导量。这与吴众望等[11]关于重金属离子对凡纳滨对虾的研究结果基本一致,该研究发现,随着重金属离子(Cu2+、Zn2+、Cd2+)浓度的升高和作用时间的延长,凡纳滨对虾肝胰脏MT含量表现为高浓度组>低浓度组>对照组,且诱导效果主要表现在48 h内。此外,周彦锋等[13]研究认为,水体中的Cd2+可诱导鲫组织中MT的合成与表达,且诱导效果主要表现在12 h内,本试验结果只在主要诱导时间(36 h)上与其有一定差异,这可能与不同水生生物的生长、代谢等不同有关。
3.2 Cd2+对幼参MT含量诱导的组织差异性
关于重金属在海产经济动物不同组织中的蓄积及毒性研究,在鱼类、贝类、虾蟹类中已有较多报道。如牙鲆染毒的前7 d,铜在各组织中蓄积速率次序为内脏团>鳃>肌肉[24];镉在栉孔扇贝各组织中蓄积量次序为内脏>鳃>肌肉[25];铜在凡纳滨对虾不同组织中积累浓度依次为肝胰腺>鳃丝>甲壳>肌肉[26];脊尾白虾对重金属镉的累积能力依次为内脏团>鳃>外壳>肌肉>足[27]。以上研究均表明,重金属在海产经济动物不同组织中蓄积量基本均表现为内脏>鳃>肌肉。而在刺参中也具有相同的规律。丁君等[28]发现,幼参对Zn2+、Cu2+的蓄积量依次为呼吸树>消化道>体壁,说明幼参体壁对Zn2+、Cu2+的蓄积量远比消化道和呼吸树低;赵元凤等[29]发现,铅浓度为0.5 mg/L时,刺参各组织中铅蓄积速率依次为内脏团>纵肌>体壁,表明内脏是铅蓄积的主要部位。本试验中研究了不同Cd2+浓度胁迫下幼参肠道、呼吸树和体壁MT含量的变化,结果显示,Cd2+胁迫下幼参3种组织合成MT的能力依次为肠道>呼吸树>体壁。这与上述关于不同组织对重金属蓄积规律的研究结果基本吻合,这种诱导作用与蓄积的金属浓度具有正相关性[30]。
肠道和呼吸树是刺参的主要内脏组织,在代谢活动中发挥了重要作用。肠道是容载、消化食物和吸收营养的组织,而呼吸树为刺参的呼吸器官,需要与外界进行气体交换,以起到鱼、贝类和虾蟹类中鳃的作用,因此,两种组织对重金属的蓄积量相对较高,诱导合成MT的能力也较强。而相比之下,体壁(肌肉)对重金属的亲和性远比肠道和呼吸树弱[23],体壁内的蓄积量较低,其诱导MT的能力也较弱。笔者认为,幼参肠道和呼吸树两种组织可用作评价Cd2+污染的靶组织,而体壁(肌肉)组织则不适合,也侧面反映出,从饮食安全角度分析,食用刺参体壁要比食用整体刺参安全。
水体中的Cd2+可以诱导刺参组织合成MT,其中对肠道和呼吸树的诱导效果最明显,且在36 h时达到较为明显的诱导效果。因此,刺参肠道和呼吸树组织中的MT含量可以作为评价水体中重金属Cd2+污染的生物标志物。
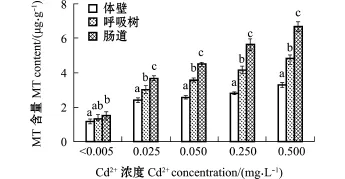
图1 不同Cd2+浓度下各组织108 h时的MT含量Fig.1 Metallothionein(MT)content in intestine,respiratory trees and body wall of juvenile sea cucumberApostichopus japonicusexposed to different concentrations of cadmium for 108 h
[1] 周启星,孔繁翔,朱琳.生态毒理学[M].北京:科学出版社, 2004.
[2] 张艳,杨传平.金属硫蛋白的研究进展[J].分子植物育种, 2006,4(S1):73-78.
[3] 刘安玲,朱必凤.金属硫蛋白的研究进展[J].韶关学院学报:自然科学版,2001,22(3):86-91.
[4] 刘维青.海湾扇贝金属硫蛋白cDNA序列克隆及其在镉和鳗弧菌诱导下的表达研究[D].青岛:中国海洋大学,2004.
[5] Berthet B,Mouneyrac C,Pérez T,et al.Metallothionein concentration in sponges(Spongia officinalis)as a biomarker of metal contamination[J].Comparative Biochemistry and Physiology Part C: Toxicology&Pharmacology,2005,141(3):306-313.
[6] 刘发义,吴玉霖.重金属污染物在海洋生物体内的积累和解毒机理[J].海洋科学,1988,12(5):63-66.
[7] 叶属峰,陆健健.无脊椎动物金属硫蛋白(MTs)多样性及其生态服务功能[J].生物多样性,2000,8(3):317-324.
[8] Bebianno M J,Serafim M A.Comparison of metallothionein induction in response to cadmium in the gills of the bivalve molluscs Mytilus galloprovincialis and Ruditapes decussatus[J].Science of the Total Environment,1998,214(1-3):123-131.
[9] 李春娣,颜文,龙爱民,等.Cu暴露条件下翡翠贻贝(Perna viridis)消化腺内金属和类金属硫蛋白的变化[J].环境科学, 2007,28(8):1788-1795.
[10] Olafson R W,Kearns A,Sim R G.Heavy metal induction of metallothionein synthesis in the hepatopancreas of the crab Scylla serrata[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1979,62(4):417-424.
[11] 吴众望,潘鲁青.重金属离子对凡纳滨对虾肝胰脏MT含量的影响[J].水产学报,2005,29(5):715-718.
[12] 林芃,任宏伟,茹炳根.鱼体内金属硫蛋白与水环境关系的研究[J].北京大学学报:自然科学版,2001,37(6):779-784.
[13] 周彦锋,陈家长,杨光,等.重金属镉胁迫下鲫鱼不同组织中金属硫蛋白的动态变化[J].安全与环境学报,2008,8(3): 18-21.
[14] Martínez M,Del José R,Torreblanca A,et al.Effect of cadmium exposure on zinc levels in the brine shrimp Artemia parthenogenetica[J].Aquaculture,1999,172(3-4):315-325.
[15] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[16] Wang Jing,Ren Tongjun,Wang Fuqiang,et al.Effects of dietary cadmium on growth,antioxidants and bioaccumulation of sea cucumber(Apostichopus japonicus)and influence of dietary vitamin C supplementation[J].Ecotoxicology and Environmental Safety, 2016,129:145-153.
[17] 赵红霞,赵元凤,徐海生,等.镉对刺参组织过氧化氢酶活性影响[J].山西大学学报:自然科学版,2011,34(S2):112-115.
[18] 刘洪展,徐琦,郑风荣,等.镉污染对养殖刺参的毒性效应研究[J].海洋科学进展,2011,29(S1):30-35.
[19] 孙振兴,王慧恩,王晶,等.汞、镉、硒对刺参(Apostichopus japonicus)幼参的单一毒性与联合毒性[J].海洋与湖沼,2009, 40(2):228-234.
[20] 刘静.镉在刺参各组织器官中的分布及对其的影响[D].大连:大连水产学院,2005.
[21] Scheuhammer A M,Cherian M G.Quantification of metallothioneins by a silver-saturation method[J].Toxicology and Applied Pharmacology,1986,82(3):417-425.
[22] 孟范平,肖静,赵顺顺,等.海洋动物金属硫蛋白的提取与分析技术研究进展[J].中国海洋大学学报,2010,40(6):41-46.
[23] Ren Hongwei,Wang Wenqing,Ru Binggen,et al.Purification and identification of metallothionein from Carassius auratus liver induced by cadmium chloride[J].Progress in Biochemistry and Biophysics,1993,20(4):281-285.
[24] 赵元凤,吕景才,吴益春,等.铜在牙鲆(Paralichthys olivaceus)组织蓄积、分配及排放的研究[J].海洋与湖沼,2005,36(2): 139-145.
[25] 王凡,赵元凤,吴益春,等.栉孔扇贝对Cd的累积和排出[J].湛江海洋大学学报,2005,25(4):95-98.
[26] 李湘萍,程波,程江峰,等.铜离子在养殖对虾组织中的积累及其对金属硫蛋白含量的影响[J].青岛科技大学学报:自然科学版,2011,32(5):492-496.
[27] 凌云,王李宝,万夕和,等.江苏南部池养脊尾白虾不同组织中重金属分布特征研究[J].水产科学,2015,34(5):316-320.
[28] 丁君,张学辉,丁鸣,等.幼刺参不同部位对Zn2+、Cu2+的蓄积动力学研究[J].海洋环境科学,2008,27(4):359-362.
[29] 赵元凤,吴益春,吕景才,等.重金属铅在刺参组织的蓄积、分配、排放规律研究[J].农业环境科学学报,2008,27(4): 1677-1680.
[30] 徐立红,张甬元.分子生态毒理学研究进展及其在水环境保护中的意义[J].水生生物学报,1995,19(2):171-185.
Effects of cadmium on content and change of metallothionein in juvenile sea cucumber Apostichopus japonicus
ZHANG Cong-yao1,2,WU Fan-xiu3,ZHANG Jian-qiang2,ZUO Ran-tao1, MA Yue-xin1,CHANG Ya-qing1,ZHOU Wei1,2
(1.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China; 2.Dalian Fisheries Industry Technology Innovation Association,Dalian 116023,China;3.The National Fisheries Techonology Extension Center,China Fisheries Society,Beijing 100125,China)
The contents of metallothionein(MT)were monitored in juvenile sea cucumber Apostichopus japonicus with body weight of(8.87±1.12)g exposed to cadmium concentration of<0.005,0.025,0.050,0.250,and 0.500 mg/L for 0,12,36,60,84,and 108 h at water temperature of 16-18℃to investigate the effects of cadmium on content and change of metallothionein in juvenile sea cucumber.The MT contents were shown to be significantly increased in the intestine,respiratory trees and body wall of juvenile sea cucumber exposed to cadmium with a concentration equal to or higher than 0.025 mg/L(P<0.05),with the maximal content of MT in intestine,followed by respiratory tree and body wall,with significance difference(P<0.05).MT contents in all detected tissues were first found to be significantly increased in the first 36 h,and then kept at a constant level at the exposure time from 36 h to 108 h.The juveniles exposed to cadmium had significantly higher MT contents in intestine and respiratory tree(P<0.05),significantly higher in the body wall at 0.025 mg/L and 0.050 mg/L cadmium than that in the lowest concentration(<0.005 mg/L),and significantly lower MT contents than that in the highest concentration (0.500 mg/L)(P<0.05).The findings indicated that cadmium induced the synthesis of MT,whose contents in intestine and respiratory tree were chosen as the sensitive parameter to assess cadmium contamination of sea water.
cadmium;Apostichopus japonicus;tissue;metallothionein
10.16535/j.cnki.dlhyxb.2017.02.011
2095-1388(2017)02-0184-05
S91
:A
2016-11-11
辽宁省教育厅一般项目(L2014288);辽宁省农业攻关及成果产业化项目(2015203003);大连市科技计划项目(2012B11NC049);国家“十二五”科技支撑计划项目(2015BAD17B05)
张丛尧(1960—),男,讲师。E-mail:zhangcongyao@dlou.edu.cn
左然涛(1985—),男,博士,讲师。E-mail:rtzuo@dlou.edu.cn
