米曲霉生产曲酸的发酵条件研究
2017-05-17刘容孙卫东李军委
刘容+孙卫东+李军委

摘要:【目的】优化米曲霉生产曲酸的发酵条件,提高生产效率,对米曲霉(Aspergillus oryzae)GIM3.423生产曲酸的发酵条件进行研究。【方法】采用单因素试验对摇瓶发酵条件进行优化。【结果】发酵液pH、发酵温度、装液量、摇床转速、接种量等因素影响和制约整个发酵过程,发酵温度30℃,装液量60ml/250ml,摇床转速200rpm,种龄6h,接种量10%,发酵周期控制在13d条件下,曲酸生产的转化率可达23.6%,。【结论】摇瓶发酵最佳条件为发酵温度30℃,装液量60ml/250ml,摇床转速200rpm,种龄6h,接种量10%,发酵周期控制在13d。
关键词:曲酸;米曲霉;发酵条件
中图分类号:TQ925 文献标识码:A 文章编号:1003-4374(2016)06-0025-05
Abstract:【Objective】 In order to optimize the fermentation conditions for producing kojic acid by aspergillus oryzae, and improve production efficiency, in this paper, the fermentation conditions for production of kojic acid by Aspergillus oryzae GIM3.423 have been studied. 【Method】 Shaking flask fermentation was optimized by using single factors test.【Conclusion】The optimum conditions were identified as follow: temperature 30℃,liquid-loading capacity 60mL/250mL,revolution fermentation yield was improved.
Key words:kojic acid;aspergillus oryzae;fermentation condition
曲酸(Kojic acid),化学名为5-羟基-2-羟甲基-1,4-吡喃酮,是一种重要的微生物合成有机酸,存在于酱油、豆瓣酱、酒类的酿造中,在许多以曲霉发酵的发酵产品中都可以检测到曲酸的存在。曲酸具有抗菌、抑菌,抑制酪氨酸酶活性,螯合金属离子,抗细胞增殖,增强免疫细胞活力,清除自由基等生物活性[1-3],被广泛地应用在食品、化妆品、农业等领域极具开发潜力和应用前景[4-5]。
随着曲酸及其衍生物的应用范围不断扩大,其市场需求也不断增加,提高曲酸的生产效率,降低生产成本成为当前的主要的研究课题。本文以曲酸产生菌米曲霉为菌种,以来源广的蔗糖为原料进行游离态发酵试验,研究并优化曲酸发酵工艺条件,以期提高曲酸转化率和生产效率,降低生产成本。
1 材料与方法
1.1 材料
1.1.1 菌种 米曲霉(Aspergillus oryzae)GIM3.423,购于广州微生物研究所微生物菌种保藏中心。
1.1.2 培养基 种子培养基(g/L):蔗糖100,酵母膏6,KH2PO4 5,MgSO4·7 H2O 0.5,吐温(-80)0.01,pH6.0,121℃湿热灭菌15min。
发酵培养基(g/L):按照前期研究优化的培养基配比,蔗糖8%,酵母膏0.3%,乙醇2%,KH2PO4 0.1%,MgSO4·7 H2O 0.05%,KCl 0.05%,121℃湿热灭菌15min。
1.1.3 主要试剂 曲酸,AR,上海源叶生物科技有限公司;3,5-二硝基水杨酸,CP,中国湖州菱湖精细化厂;蔗糖,AR,国药化学试剂有限公司;乙醇,AR,天津市大茂化学试剂厂。
DNS试剂:分别称取DNS(3,5-二硝基水杨酸)10.00g,氢氧化钠16.00g,苯酚5.00g,酒石酸钾钠300.00g,依次加入到蒸馏水中溶解,定容到1000mL,避光保存一周,绘制葡萄糖标准曲线。
FeCl3显色剂:以浓度为0.1% FeCl3-HCl作为曲酸显色剂:准确称取10.000gFeCl3用蒸馏水溶解添加到1000mL容量瓶中,量取22.5mL浓盐酸缓慢加入到容量瓶中,以蒸馏水定容,摇匀,保存备用。
1.2 主要仪器
紫外可见分光光度(UV-2802H),尤尼柯(上海)仪器有限公司;全温度恒温培养振荡器ZHWY-Z11C,上海智诚分析仪器制造有限公司;低速大容量多管离心机LXJ-Ⅱ,成都欣宇实验设备有限公司;DELTA 320 pH计,梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 发酵实验。
(1)孢子悬液的制备。将平展米曲霉GIM3.446接到PDF培养基上活化数次,使菌种活力完全恢复,无菌生理盐水(含有0.01%土温-80)将培养4天菌种的孢子冲洗下来,制成浓度为1.0×107个/mL的孢子悬液,4℃保存备用。
(2)种子培养。按4%的接种量接种将孢子悬液接种到50mL/250mL种子培养基中,30℃,200rap摇瓶培养24h。
(3)发酵培养。种子液按照10%的接种量接种到50mL/250mL发酵培养基中,30℃,200rap摇瓶培养12d检测残糖量、曲酸含量和生物量。
1.3.2 分析方法。
(1)孢子浓度的测定。血球计数板直接计数。
(2)曲酸含量的测定。采用FeCl3比色法测定发酵液中曲酸含量[2]。曲酸标准曲线的绘制:准确称取曲酸1g溶解于蒸馏水中,定容至1000mL,摇匀,制得浓度为1mg/mL的曲酸溶液。分别准确移取0.5mL~4.5mL溶液分别添加得到100mL的容量瓶中,分别加入2mL显色剂,蒸馏水定容至100mL,摇匀。以蒸馏水为空白对照,测定溶液在500nm波长下的吸光值(OD500),以OD500為纵坐标,以曲酸含量(mg)为横坐标,根据测定结果绘制出标准曲线。如图1标准曲线方程为Y=0.0839x+0.0003(R2=0.9999)。
发酵液中曲酸含量的测定:发酵液经抽滤除掉菌体后,准确移取0.2~1mL滤液到100mL容量瓶中,加入FeCl3显色剂2mL,蒸馏水定容,摇匀,测定溶液在500nm波长下的吸光度(OD500),根据标准曲线计算曲酸含量。
(3)残糖的测定。发酵液残糖采用DNS方法测定[3]。
葡萄糖标准曲线的绘制:采用DNS显色法绘制葡萄糖的标准曲线,取6支25mL具塞刻度试管,分别加入0mL~1mL浓度为2mg/mL葡萄糖标准溶液、1mL~0mL蒸馏水和1.5m3,5-二硝基水杨酸溶液(DNS),摇匀,配成葡萄糖含量不同的反应液。将反应液在沸水浴中加热5min后取出,在自来水中迅速冷却至室温,用蒸馏水定容至25mL,摇匀后测定在540nm波长下的吸光值(OD540),以OD540为纵坐标,葡萄糖含量(mg)为横坐标,根据测定结果绘制标准曲线。如图2所示,Y=0.5466x+0.0269(R2=0.9947)。
发酵液残糖的测定:准确移取1mL发酵虑液到100mL容量瓶中,蒸馏水定容。取稀释液1mL到25mL具塞刻度试管中,后续操作同上。最后根据标准曲线计算出发酵液中残糖含量。
(4)生物量的测定。将分析滤纸放置于105℃下干燥至恒重,用于过滤发酵液。过滤结束后,用蒸馏水冲洗菌体3~4次,再将粘有菌体的滤纸放置于105℃下干燥至恒重,称量。根据前后质量差求得发酵液的生物量。
2 发酵条件优化
2.1 初始pH对曲酸产量和转化率的影响
按照优化后的培养基配比(见1.1.2)进行发酵试验,调节发酵初始pH为3、4、5、6、7进行发酵试验,研究不同初始pH对曲酸发酵的影响。
2.2 装液量对曲酸产量和转化率的影响
保持其他条件发酵条件不变,调节摇瓶装液量为20mL/250mL、40mL/250mL、60mL/250mL、80mL/250mL、100mL/250mL,進行发酵试验,研究不同装液量对曲酸发酵的影响。
2.3 种龄对曲酸产量和转化率的影响
保持其他条件发酵条件不变,调节用于接种的种子种龄分为6h、12h、18h、24h,接入到发酵培养基中进行发酵试验,研究不同种子的种龄对发酵的影响。
2.4 接种量对曲酸产量和转化率的影响
保持其他条件发酵条件不变,调节接种量为、6%、8%、10%、12%、14%,进行发酵试验,研究不同接种量对曲酸发酵的影响。
2.5 温度对曲酸产量和转化率的影响
保持其他条件发酵条件不变,调节发酵温度为28℃、30℃、32℃,进行发酵试验,研究不同接种量对曲酸发酵的影响。
2.6 摇床转速对曲酸产量和转化率的影响
保持其他条件发酵条件不变,调节摇床转速120rpm、160rpm、200rpm、240rpm,进行发酵试验,研究不同摇床转速对曲酸发酵的影响。
3 结果与分析
3.1 初始pH对曲酸产量和转化率的影响
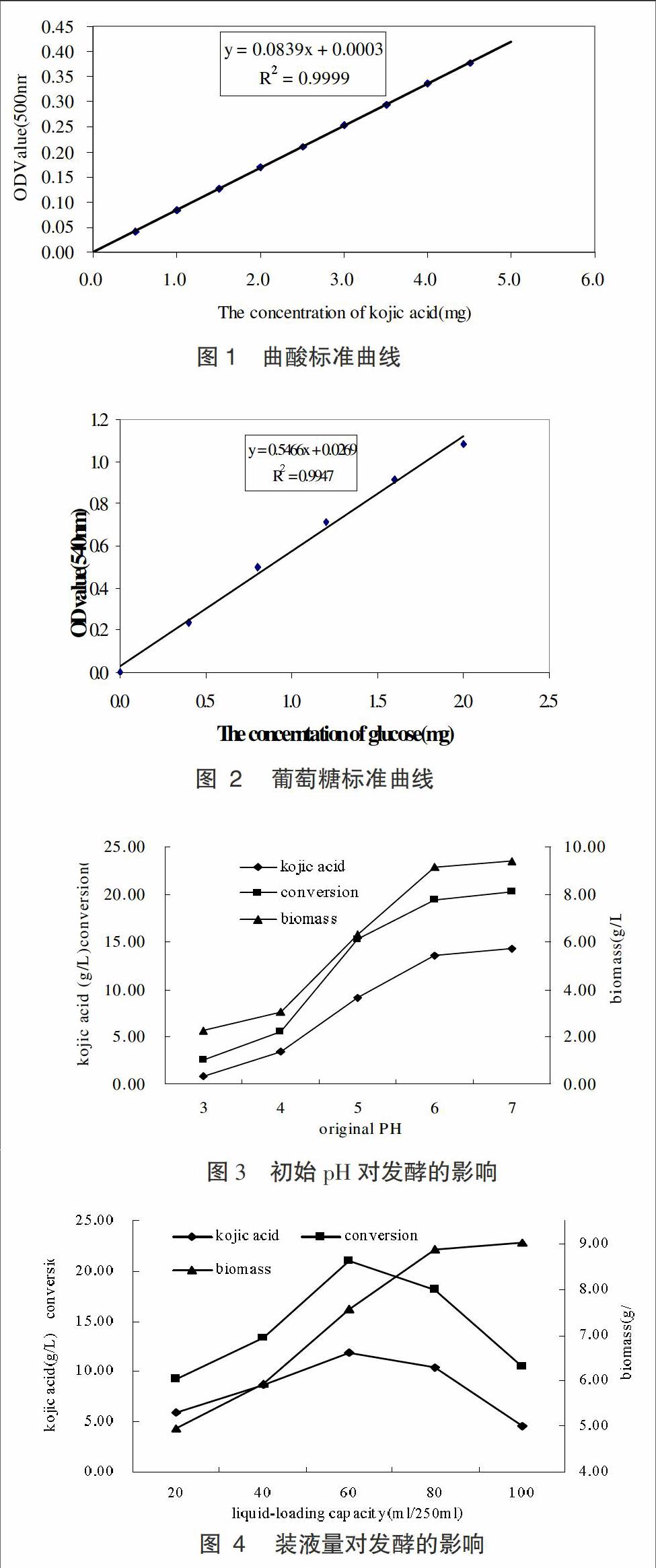
发酵培养液的pH值是微生物发酵生产的一个重要参数,它对菌体的生长和产物的合成有很大的影响,微生物生长和生物合成都有其最适和能够耐受的pH范围,而选择最适pH的原则是既有利于菌体的生长繁殖,又可以最大限度地获得高的产量。本实验考察了不同初始pH对曲酸合成的影响如图3。
图3实验结果显示,发酵培养基初始pH对整个发酵过程表现出比较显著的影响。首先,初始pH在较低的情况下对菌体的生长具有显著的抑制性,结果显示初始pH在3~4时,生物量维持在较低水平;当初始pH值4~6时,生物量随之急剧增加;当初始pH值6~7时,由于受到生长空间的限制,生物量维持在相对稳定的程度。其次,菌体的产酸能力和曲酸转化率也受到了初始pH的影响,较低的pH抑制了菌体生长的同时也抑制了曲酸的合成,当初始pH>4时,曲酸浓度和曲酸转化率随着pH值的增加同时增加,曲酸浓度最高可达14.31g/L,转化率提高至20.31%。故将初始pH值定为7较为适宜。
3.2 装液量对曲酸产量和转化率的影响
米曲霉发酵生产曲酸是一种液态深层好氧发酵,底物经微生物内部的氧化酶经过一系列的复杂转化生成产物,因此,氧气的供应在发酵过程中的作用就显得尤为重要,装液量对于菌体发酵的供氧具有重要的意义。
图4实验结果显示,装液量在20~40mL/250mL,较低的装液量有利于提高发酵液含氧量,同时发酵液的具有较强的流动剪切力,于是形成的菌丝体结构紧密,菌丝体的生长受到限制,具有较低的生物量,菌体的发酵能力相对较低,但是随着装液量的增加,生物量不断增加,发酵液中曲酸浓度也逐渐增加,装液量为60mL/250mL曲酸浓度和曲酸转化率达到最高,曲酸浓度为11.86g/L,转化率21.01%,之后随着装液量的增加,生物量继续增加,超过80mL/250mL以后由于受到缺氧的限制生物量也趋于平稳。结果表明,半缺氧的状态下有益于曲酸发酵。装液量为60mL/250mL较为适宜。
3.3 摇床转速对曲酸产量和转化率的影响
摇床震荡对微生物发酵具有多方面的影响,研究摇床转速对发酵生产具有十分重要的意义。从图5中可以看出,随着摇床转速的不断提高,发酵液的流动剪切力也不断增强导致菌丝体结构结实紧密,阻碍了。
菌丝体的生长,发酵液中的生物量随之持续下降。摇床转速在150~200转/min时,发酵液中的曲酸浓度和曲酸转化率与转速呈正相关,分别达到了14.91g/L和18.75%,当摇床转速超过200rap以后呈稳中有降的趋势,可能是由于生物量持续降低的缘故所致。综合分析,摇床转速控制在200rap较为适宜。
3.4 种龄对曲酸产量和转化率的影响
微生物生长随着生存环境的变化会出现周期性的变化,用于合成次级代谢产的微生物多在稳定期才发挥合成转化功能,而在进入稳定期之前微生物均要经历延滞期,在发酵工业中为了缩短延滞期,在进行微生物发酵之前首先对微生物进行种子扩大培养,使生物量获得迅速增殖。种子培养时间(种龄)过短,菌体浓度低,发酵前的延滞期长;种龄过长,菌体老化,酶活降低,生产效率低,因此选择合适的种龄对后期发酵生产具有很大的影响,本实验考察了不同种龄对发酵产酸的影响如图6。
微生物接入到种子液中进行培养扩增,在适应液体深层培养的环境的同时,生长繁殖到一定数量和并初步具备发酵能力之后接入到发酵培养基中进行发酵转化合成目的产物。用于发酵试验的种子液中微生物的数量和发酵性能与种龄具有直接的关系,同时对后续的发酵试验也具有一定的影响。
图6实验结果显示,随着种龄的增加发酵液生物量随之增加,转化率却逐渐降低,当种龄超过6h后生物量增加放緩。种龄为6h是曲酸浓度达到最高,最高可达14.21g/L,转化率为22.35%。综合分析,用于发酵菌种的种龄应控制在6h。
3.5 接种量对曲酸产量和转化率的影响
微生物在种子培养阶段获得充分的增殖后接入到发酵培养基中进行产物合成,接种量的多少直接影响到发酵液的生物量,因此采用较大的接种量能够有效缩短发酵周期,但是过高的接种量往往导致发酵液中生物量迅速增加,底物消耗过快,在营养物质急剧降低的同时菌体出现代谢放缓。
图7试验结果显示,随着接入到发酵培养基中种子液的增加,发酵液的生物量也随之增加,但是当接种量超过12%以后,由于受到空间的限制,最终生物量不在增加趋于恒定;但是发酵液中曲酸浓度和曲酸转化率随着接种量的增加却经历了先升后降的过程,接种量在6~10%曲酸浓度和曲酸转化率随之增加,最高分别达到了14.38g/L和21.51%。但是当接种量超过10%以后,由于微生物在消耗过多蔗糖用于合成自身结构物质的同时,也导致溶氧的降低,导致曲酸浓度和曲酸转化率的降低,故以10%接种量较为适宜。
3.6 温度对曲酸产量和转化率的影响
微生物发酵主要依靠生物酶的催化作用实现产物的合成,而温度对酶的活性具有显著的影响,稳定的发酵温度是保证发酵系统高效运作的重要保证。不同微生物具有不同的最适生长和代谢温度,只有在最适温度下,才能获得最大的发酵能力。
丝状真菌最适生长温度和产物合成温度一般是在28℃~34℃,种属之间存在较大的差异,即使是同一株菌的最适生长温度和目的产物合成温度也存在很大的差异。本实验考察了不同温度下米曲霉发酵产酸能力如图8。
根据图8实验结果显示,发酵温度为30℃时获得了较高的曲酸产量和较高的曲酸转化率,故本实验菌种最适的产酸温度为30℃,但是温度在32℃时,产生了更高的生物量,说明该菌株的最适生长温度高于30℃。为了在控制生物量的同时获得较高的曲酸产量,故将发酵温度控制在30℃较为适宜。
4 结论
微生物发酵需要合适的发酵条件,发酵液pH、发酵温度、装液量、摇床转速、接种量等,这些因素都将影响和制约整个发酵过程,本研究对米曲霉(Aspergillus oryzae)GIM3.423发酵蔗糖生产曲酸的工艺条件进行优化,通过试验确定了最佳的摇瓶发酵条件:发酵温度30℃,装液量60mL/250mL,摇床转速200r/min,种龄6h,接种量10%,发酵周期控制在13d,在此条件下,曲酸的转化率可达23.6%,大大提高了曲酸的发酵产率。
参考文献:
[1]Jian-long Wang,Can Chen. Biosorbents for heavy metals removal and their future[J].Biotechnology Advances,2009,27(2):195 -226.
[2]H.M.Wan,C.Chen,R.Giridhar.T.S.Chang,et al.Repeated-batch production of kojic acid in a cell-retention fermenter using Aspergillus oryzae M3B9[J].Journal of Industrial Microbiology & Biotechnology,2005,32:227-233.
[3]Ana Paula D.Rodrigues,Antonio Sergio C. Carvalho.Alberdan S. Santos,et al.Kojic acid,a secondary metabolite from Aspergillus sp.,acts as an inducer of macroPHage activation[J].Cell Biology International,2011,35:335-343.
[4]Kazuhiro Takamizawa,Shinobu Nakashima,Yuuichi Yahashi,et al.Optimization of kojic acid production rate using the Box-Wilson method[J].Journal of fermentation and Bioengineering,1996,82 (4):414-416.
[5]董静,孟宪军.米曲霉UC6-90产曲酸的发酵培养基优化[J].食品研究与开发,2007,28(6):52-56.
[6]张理珉,程立忠,陆和生.发酵液中曲酸的提取方法比较[J].生物技术,2000,10(5):44-46.
[7]王俊丽,聂国兴,曹香林等.不同DNS试剂测定木糖含量的研究[J].食品研究与开发,2010,31(7):1-4.
