白杨素对高糖损伤血管内皮的影响
2017-05-17张夏丽韩斯嘉田晴晴高雪梅张轩萍
张夏丽,韩斯嘉,罗 乐,陈 敏,李 洁,田晴晴,高雪梅,张轩萍
(1. 山西医科大学药理学教研室,山西 太原 030001; 2.山西职工医学院生理学教研室,山西 太原 030001)
白杨素对高糖损伤血管内皮的影响
张夏丽1,韩斯嘉1,罗 乐1,陈 敏1,李 洁1,田晴晴1,高雪梅2,张轩萍1
(1. 山西医科大学药理学教研室,山西 太原 030001; 2.山西职工医学院生理学教研室,山西 太原 030001)
目的 探讨急性高糖条件下,白杨素(chrysin,Ch)对血管内皮舒张功能的影响。方法 ① 采用离体血管环实验,设立正常对照组(control)、白杨素处理组(Ch),观察正常糖浓度时,白杨素对大鼠离体主动脉的舒张作用;设立正常糖浓度组(NG, 11 mmol·L-1Glu)、高糖实验组(HG, 44 mmol·L-1Glu)、甘露醇对照组(M, 11 mmol·L-1Glu+33 mmol·L-1Man)和白杨素急性给药组(HG+Ch, 44 mmol·L-1Glu+chrysin 1.0 μmol·L-1),观察急性高糖孵育后,白杨素对大鼠离体主动脉舒张功能的影响。② 采用HUVEC细胞系,设立正常糖浓度组(NG, 5.5 mmol·L-1Glu)、高糖实验组(HG, 33.3 mmol·L-1Glu)、甘露醇对照组(M, 5.5 mmol·L-1Glu+27.8 mmol·L-1Man)以及不同浓度白杨素处理组(Ch 25、50 μmol·L-1),观察白杨素对高糖孵育HUVEC细胞存活率的影响,并检测各组NO释放量。结果 ① 正常糖浓度时,白杨素能浓度依赖性地舒张大鼠主动脉环,其Emax和EC50为(58.94±9.61)%、51.9 μmol·L-1(P<0.01);高糖浓度时,HG组ACh诱导的血管舒张反应性明显降低,其Emax与EC50值分别下降至(32.12±3.92)%、78.0 μmol·L-1(P<0.01),但硝普钠(SNP)诱导的血管舒张无变化;白杨素急性干预后,可以明显改善高糖对ACh诱导的血管内皮依赖性舒张功能的损伤,其Emax与EC50值分别为(70.7±3.87)%和0.852 μmol·L-1(P<0.01)。② HUVEC高糖处理后,细胞存活率降低至(82.56±3.97)%,白杨素(25、50 μmol·L-1)干预后能浓度依赖地增强HUVEC的细胞存活率,其细胞存活率可分别增至(103.4±4.78)%、(107.6±11.58)%;并且能提高高糖处理后细胞培养液NO的释放量。结论 白杨素可以保护急性高糖损伤的血管内皮舒张功能,并增加内皮NO释放。
大鼠离体主动脉; 血管环; 白杨素; 急性高糖; HUVEC; NO
近年来,糖尿病(diabetes mellitus, DM)已经成为继心脑血管疾病、肿瘤之后的第三大严重危害人类健康的疾病[1]。DM可引发多种并发症,包括糖尿病心肌病、糖尿病高血压、糖尿病肾病、糖尿病视网膜病变等一系列血管性疾病[2-3],是DM患者致残致死的主要原因。文献[4]证明,内皮损伤是DM血管并发症的主要因素。因此,减轻内皮损伤、改善内皮功能是减轻血管并发症的主要措施。
天然食源性黄酮类化合物白杨素(chrysin,Ch,化学式C15H10O4)广泛存在于多种植物、蜂胶和蜂蜜中,具有抗氧化应激、抗炎症反应、抗病毒[5]、抗高血糖[6]、抗高血压[7]、抗肿瘤[8]等多种药理学活性。本室前期实验研究结果证明,Ch可以舒张高K+预收缩的大鼠离体主动脉,且与增加血管内皮NO的释放有关,发挥血管内皮依赖性的舒张作用[9]。但是,Ch在急性高糖条件下对血管内皮的舒张作用如何?本实验拟通过离体血管环实验系统和血管内皮细胞相关实验,研究急性高糖条件下Ch对血管内皮依赖性舒张功能的影响。
1 材料与方法
1.1 实验动物与细胞 成年♂ SD大鼠,体质量(220±20)g,由山西医科大学实验动物中心提供,许可证号SCXK(晋)2009-0001。饲养环境湿度50%~60%,温度(22~24)℃,自由摄食饮水。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)购自上海细胞库。
1.2 试剂与仪器 乙酰胆碱(acetylcholine, ACh)、苯肾上腺素(phenylephrine,PE)、HEPES (Sigma公司);白杨素(大连美仑生物有限公司);DMEM低糖培养基(武汉博士德生物工程有限公司);FBS(Sciencell公司);MTT试剂、NO试剂盒(碧云天生物技术公司);其余为市售分析纯试剂。
Power-lab生物信号采集分析系统(澳大利亚埃德公司);HSS-1B数字式超级恒温泵(成都仪器厂);微量加样器(上海求精生化试剂仪器有限公司);SartoriusBS124S精密天平(北京赛多利斯仪器有限公司);PHS-3C精密pH计(上海雷磁公司)。
1.3 方法
1.3.1 Ch对血管主动脉环的舒张作用
1.3.1.1 血管环的制备与内皮活性检测 按照文献[9-11]方法制备大鼠离体主动脉血管环,并检测血管内皮活性。简言之,大鼠麻醉后断头处死,迅速解剖取出主动脉,置于100%饱和O2、4℃的K-H孵育液中,眼科剪分离离体主动脉周围结缔组织和脂肪后,将其剪为长度为(3~4)mm的血管环。用两根不锈钢挂钩平行贯穿于备好的血管环管腔,将离体血管环水平孵育在10 mL浴漕内,其中一根挂钩在下方固定,另一根连于上方的张力换能器,用Power-lab生物信号仪器的测定系统记录主动脉环张力变化。实验过程中,浴管内始终保持有5 mL 37℃的K-H液,并且持续通入100%的医用氧气,15 min换液1次。调整主动脉环的初始张力至2.0 g,平衡1 h,稳定后进行内皮依赖性检测,即所有的主动脉环用KCl 60 mmol·L-1进行收缩刺激,稳定后(即连续2次KCl刺激引起血管收缩的幅度相差小于5%),再用PE(1.0 μmol·L-1)预收缩,待收缩达到坪并稳定后,加入ACh(10 μmol·L-1),当血管环舒张幅度不小于其收缩幅度的70%时,认为内皮完整。ACh/SNP诱发的主动脉最大舒张率(Emax)=(PE诱发的最大张力-ACh/SNP累积加至终浓度时的张力)/PE诱发的最大张力×100%。
1.3.1.2 Ch对PE预收缩正常大鼠主动脉的舒张作用 根据实验需要,将内皮完整主动脉环分为正常对照组(control)、Ch处理组(Ch)。然后,分别向浴管中加入PE(1.0 μmol·L-1),待血管收缩达到峰值并稳定后,分别累积加入Ch (1.0~100 μmol·L-1)及相应体积K-H液,检测各主动脉环的舒张反应功能。
1.3.1.3 急性高葡萄糖孵育对大鼠主动脉舒张功能的影响 根据实验需要,将内皮完整主动脉环分为正常糖浓度组(NG, 11 mmol·L-1Glu)、高糖实验组(HG, 44 mmol·L-1Glu)、甘露醇对照组(M, 11 mmol·L-1Glu+33 mmol·L-1Man)。然后,各组分别在糖浓度为11 mmol·L-1或44 mmol·L-1的K-H液以及甘露醇浓度为33 mmol·L-1的K-H液中孵育4 h。然后向浴管中加入PE(1.0 μmol·L-1),待血管收缩达到峰值并稳定后,分别累积加入ACh (0.001~10 μmol·L-1)、SNP (0.000 1~10 μmol·L-1),检测各主动脉环的舒张反应功能。
1.3.1.4 Ch对急性高糖孵育主动脉舒张功能的影响 选择内皮完整血管进行实验,分为正常糖浓度组(NG, 11 mmol·L-1Glu)、高糖实验组(HG, 44 mmol·L-1Glu)、Ch急性给药组(HG+Ch, 44 mmol·L-1Glu+chrysin 1.0 μmol·L-1),Ch在孵育结束前30 min加入。各组分别在相应孵育液中孵育4 h,然后向浴管中加入PE,使其终浓度为1.0 μmol·L-1,待血管收缩达到峰值并且稳定后,分别累积加入ACh(0.001~10 μmol·L-1),检测各组的主动脉对ACh的内皮依赖舒张反应。
1.3.2 Ch对高糖损伤HUVEC的保护作用
1.3.2.1 人脐静脉内皮细胞培养 HUVEC细胞用DMEM低糖培养液(含10%胎牛血清)培养,细胞形态呈单层铺路石样排列。在无菌条件下按照文献[12]进行操作,取处于对数生长期的HUVEC接种于96孔板,接种数为5 000/孔,每孔加入培养液180 μL。待细胞贴壁生长达60%时,随机分为正常糖浓度组(NG, 5.5 mmol·L-1Glu)、高糖实验组(HG, 33.3 mmol·L-1Glu)、甘露醇对照组(M, 5.5 mmol·L-1Glu+27.8 mmol·L-1Man)以及不同浓度Ch处理组(Ch 25、50 μmol·L-1),每组设5个复孔。白杨素各浓度组在高糖处理前2 h加入,继续培养48 h,然后进行相应指标测定。
1.3.2.2 Ch对高糖损伤HUVEC细胞存活率的影响 根据文献[13]方法,细胞存活率采用MTT比色法检测。各组分别处理48 h, 在离培养终点前4 h,各孔加入20 μL MTT(5 g·L-1) ,然后继续培养4 h,待培养时间终止后,倒掉原有培养液,加入DMSO,酶标仪于570 nm处测吸光度(A)值,计算细胞的存活率。细胞存活率=处理组OD值/NG组OD值(设定NG组细胞存活率为100%)。
1.3.2.3 Ch对高糖损伤HUVEC NO释放量的影响 根据NO试剂盒说明书方法,应用NO标准品配制不同浓度(60、40、20、10、5、2、1、0 μmol·L-1)NO标准品,530 nm检测吸光度值,绘制标准曲线。细胞处理48 h后,各组分别取上清液50 μL到一新96孔板,并加入50 μL NO试剂盒检测试剂Ⅰ和试剂Ⅱ,检测吸光度(A)值,计算细胞NO释放量。
2 结果
2.1 Ch对血管主动脉环的舒张作用
2.1.1 Ch对PE预收缩正常大鼠主动脉的舒张作用 在正常糖浓度时,Ch (1.0、3.0、10、30、100 μmol·L-1)能浓度依赖性地舒张PE(1.0 μmol·L-1)预收缩大鼠主动脉血管环,其Emax与EC50值分别为(58.94±9.61)%、51.9 μmol·L-1,与正常对照组相比差异有显著性(P<0.01,Fig 1)。
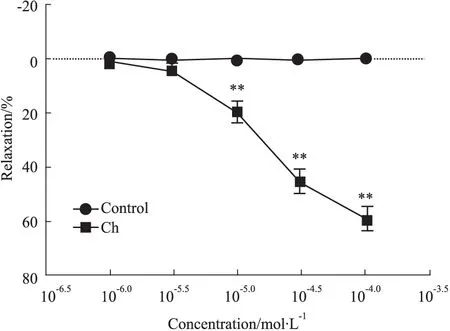
Fig 1 Chrysin-induced vasorelaxation in rat
Responses were represented as percentage of maximum contraction induced by phenylephrine(1.0 μmol·L-1).**P<0.01vscontrol group
2.1.2 急性高糖孵育下ACh和SNP诱导的主动脉的舒张功能 SD大鼠的主动脉血管环在11 mmol·L-1K-H液中孵育4 h后,ACh (0.001~10 μmol·L-1)能浓度依赖性地舒张血管环,其Emax与EC50值分别为(79.48±6.16)%、0.276 μmol·L-1;而高糖(44 mmol·L-1)孵育4 h后,明显地降低了ACh诱发的内皮依赖性的血管舒张反应,其Emax与EC50值分别下降至(32.12±3.92)%、78.0 μmol·L-1,与正常糖浓度组相比,差异有显著性(P<0.01,Fig 2A);甘露醇对照组孵育4 h后,对ACh诱发的内皮依赖性的血管舒张反应与正常对照组相比,差异没有显著性,其Emax与EC50值分别(82.33±11.92)%、0.182 μmol·L-1(P>0.05,Fig 2A);3组血管环对SNP (0.000 1~10 μmol·L-1)诱导的非内皮依赖性舒张反应差异没有显著性(P>0.05,Fig 2B)。
2.1.3 Ch对急性高糖孵育主动脉舒张功能的影响 与高糖实验组(HG)相比,Ch急性给药组(HG+Ch)明显减弱了高浓度葡萄糖诱导的内皮依赖性的血管舒张功能的下降,其Emax与EC50值分别为(70.7±3.87)%、0.852 μmol·L-1,差异有显著性(P<0.01,Fig 3)。
2.2 Ch对高糖损伤HUVEC保护作用
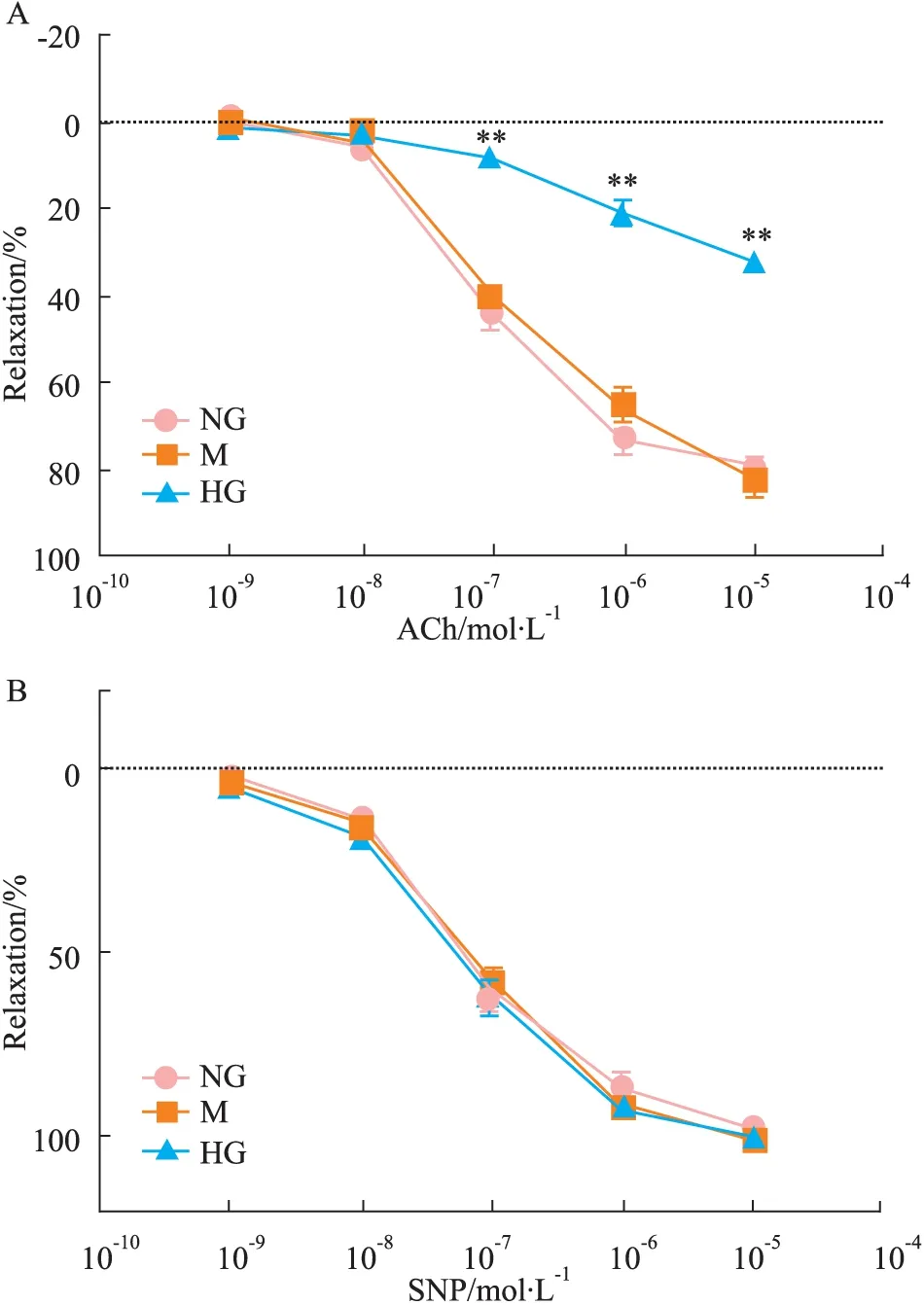
Fig 2 Effect of acute high glucose on ACh(A) or
Responses were represented as percentage of maximum contraction induced by phenylephrine(1.0 μmol·L-1).**P<0.01vsNG group
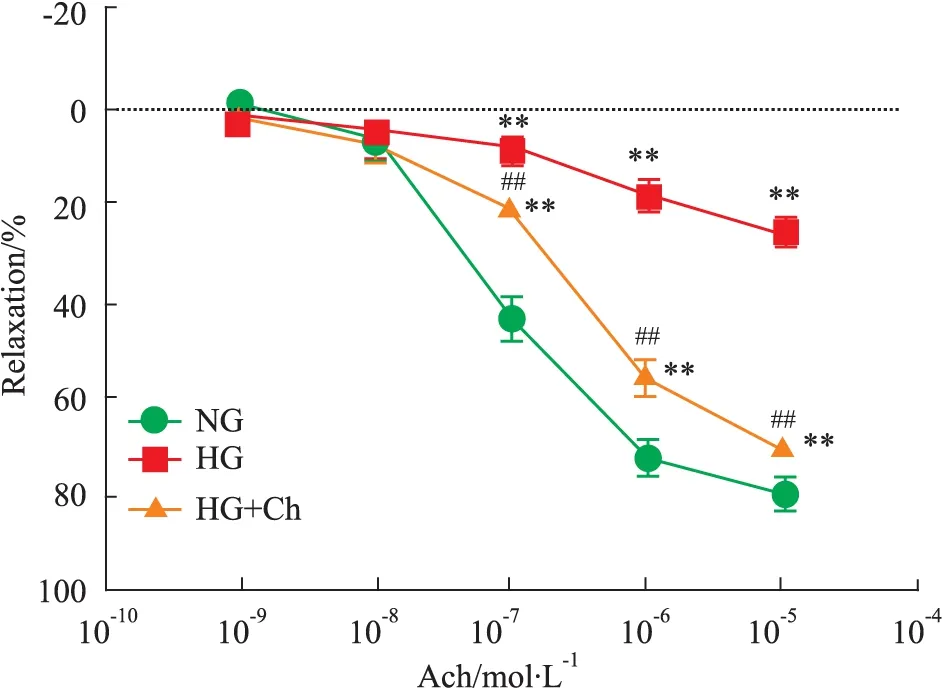
Responses were represented as percentage of maximum contraction induced by phenylephrine(1.0 μmol·L-1).##P<0.01vsHG group;**P<0.01vsNG group
2.2.1 Ch对高糖损伤HUVEC细胞存活率的影响 与正常糖浓度组相比,高糖实验组细胞存活率明显下降,存活率为(82.56±3.97)%,差异有显著性(P<0.01)。而甘露醇对照组细胞存活率与正常糖浓度组相比差异没有显著性(P>0.05),存活率为(100.5±4.12)%。不同浓度Ch (25、50 μmol·L-1)提前2 h处理后,细胞存活率与高糖组相比明显升高,分别为(103.4±4.78)%和(107.6±11.58)%(P<0.05)。见Fig 4。
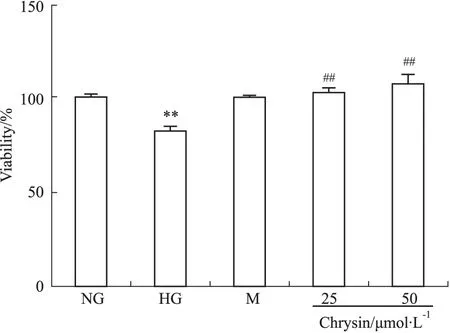
Fig 4 Effect of chrysin on HUVECs viability
The cell viability was tested with MTT assay.##P<0.01vsHG group;**P<0.01vsNG group
2.2.2 Ch对高糖损伤HUVEC NO释放量的影响 如Fig 5所示,细胞培养48 h后,正常糖浓度组NO释放量为(4.43±0.92)μmol·L-1。高糖处理后,细胞NO释放量明显下降,释放量降为(2.63±0.38)μmol·L-1(P<0.05)。而甘露醇对照组与正常对照组相比差异没有显著性(P>0.05),释放量为(4.31±1.26)μmol·L-1。不同浓度Ch (25、50 μmol·L-1)提前2 h处理后,NO释放量与高糖组相比明显升高,分别为(3.50±0.81)μmol·L-1、(4.03±0.69)μmol·L-1(P<0.05)。
#P<0.05vsHG group;*P<0.05vsNG group
3 讨论
实验结果显示,正常糖浓度时,Ch可以浓度依赖性地舒张离体大鼠主动脉;急性高糖孵育后,Ch可以减轻血管内皮舒张功能损伤,增加内皮细胞的细胞存活率和NO的释放。初步证明Ch对高糖损伤血管内皮具有保护作用。
糖尿病是一种以代谢紊乱为特征的综合性疾病,其特点是由于胰岛素缺乏以及胰岛素抵抗所引起的高血糖症和糖耐量降低。本实验采用急性高糖孵育模型模拟糖尿病高血糖状态。实验结果发现,高糖孵育后,ACh诱导的大鼠离体主动脉内皮依赖性舒张功能减弱,但SNP诱导的非内皮依赖性舒张反应差异没有显著性,证实高糖损伤血管主要引起血管内皮的损伤,而对平滑肌功能无明显影响;高糖孵育后ACh诱导的内皮依赖性舒张中甘露醇对照组并不影响其舒张反应,细胞存活率和NO释放率与正常对照组相比差异也没有显著性,证明急性高糖对血管内皮的影响并非通过高渗作用。糖尿病发生时,细胞内出现高糖状态。葡萄糖通过多元醇通路转化为多元醇山梨糖醇,同时,降低胞内抗氧化剂NADPH和GSH浓度,诱导O2-产生过剩,ROS积累,抑制葡萄糖-6-磷酸脱氢酶,放大氧化应激,减少eNOS磷酸化,减少NO释放[14-15]。
El-Bassossy等[6]证明Ch能改善DM大鼠模型内皮依赖性舒张功能损伤,减少脂质过氧化物产生,具有抗氧化应激的作用。本实验在组织、细胞水平发现,Ch能减轻血管内皮舒张功能损伤,增加内皮细胞的存活率和NO的释放,明确Ch在离体水平的急性治疗和整体水平的慢性治疗中具有相似的血管内皮改善作用,为糖尿病并发症等一系列血管性疾病的用药治疗提供一定参考。相关文献[16]证明,高糖损伤血管内皮主要是由于过氧化物、超氧阴离子等氧化应激相关分子的累积增加,与糖尿病引起内皮舒张功能损伤机制具有共通之处,因此,研究急性高糖损伤下Ch对血管内皮的保护作用具有一定实际意义。但是,糖尿病发病过程中血管内皮损伤是一个长期的慢性的过程,Ch对其是否有确切的治疗保护作用,还需要在在体水平深层次、多方面探讨。综上所述,Ch在组织、细胞层面可以减轻血管内皮损伤,并增加NO释放。
(致谢: 本实验在山西医科大学基础医学院药理教研室完成。在此对参与实验人员表示感谢。)
[1] Jaacks L M, Siegel K R, Gujral U P, et al. Type 2 diabetes: a 21st century epidemic[J].BestPractResClinEndocrinolMetab, 2016, 30(3): 331-43.
[2] Rehman M U, Tahir M, Khan A Q, et al. Chrysin suppresses renal carcinogenesis via amelioration of hyperproliferation, oxidative stress and inflammation: plausible role of NF-kappaB[J].ToxicolLett, 2013, 216(2-3): 146-58.
[3] Ahad A, Ganai A A, Mujeeb M, et al. Chrysin, an anti-inflammatory molecule, abrogates renal dysfunction in type 2 diabetic rats[J].ToxicolApplPharmacol, 2014, 279(1): 1-7.
[4] Khanna S, Singh G B, Khullar M. Nitric oxide synthases and diabetic cardiomyopathy[J].NitricOxide, 2014, 43: 29-34.
[5] Suresh Babu K, Hari Babu T, Srinivas P V, et al. Synthesis and biological evaluation of novel C (7) modified chrysin analogues as antibacterial agents[J].BioorgMedChemLett, 2006, 16(1): 221-4.
[6] El-Bassossy H M, Abo-Warda S M, Fahmy A. Chrysin and luteolin attenuate diabetes-induced impairment in endothelial-dependent relaxation: effect on lipid profile, AGEs and NO generation[J].PhytotherRes, 2013, 27(11): 1678-84.
[7] Li X W, Wang X M, Li S, et al. Effects of chrysin (5,7-dihydroxyflavone) on vascular remodeling in hypoxia-induced pulmonary hypertension in rats[J].ChinMed, 2015, 10(1): 4-10.
[8] Premratanachai P, Chanchao C. Review of the anticancer activities of bee products[J].AsianPacJTropBiomed, 2014, 4(5): 337-44.
[9] 田晴晴, 罗 乐, 张夏丽, 等. 白杨素对大鼠主动脉舒张作用的影响[J]. 中国病理生理杂志, 2016, 32(4): 618-22.
[9] Tian Q Q, Luo L, Zhang X L, et al. Effect of chrysin on relaxation of isolated rat aortic ring[J].ChinJPathophysiol, 2016, 32(4): 618-22.
[10] 闵 清,白育庭,刘 晶,等. 山楂叶总黄酮对大鼠血管环的作用及其机制探讨[J]. 中国药理学通报, 2011, 27(4): 585-6.
[10] Min Q, Bai Y T, Liu J, et al. Effects and mechanisms of hawthorn leaf flavonoids on isolated rat thoracic aorta[J].ChinPharmacolBull, 2011,27(4): 585-6.
[11] 房龙梅,侯晓敏,杨 蓉,等. 阿魏酸对离体大鼠冠状动脉的舒张作用及机制探讨[J]. 中国药理学通报, 2016, 32(4): 554-8.
[11] Fang L M, Hou X M, Yang R, et al. Vasodilatory effect of ferulic acid oninvitrorat coronary artery[J].ChinPharmacolBull, 2016, 32(4): 554-8.
[12] 崔迎红,孙姝雯,邹 辉,等. 8-溴-7-甲氧基白杨素抑制肝癌相关星状细胞诱导内皮细胞管结构形成.[J]. 中国药理学通报, 2016, 32(7): 1035-6.
[12] Cui Y H, Sun S W, Zou H, et al. 8-bromo-7-methoxychrysin inhibits tube formation of endothelial cells induced by liver cancer-associated stellate cells[J].ChinPharmacolBull, 2016, 32(7): 1035-6.
[13] Zhao J, Wang D, Li L, et al. Protective effects of humanin on okadaic acid-induced neurotoxicities in cultured cortical neurons[J].NeurochemRes, 2014, 39(11): 2150-9.
[14] Fiorentino T V, Prioletta A, Zuo P, et al. Hyperglycemia-induced oxidative stress and its role in diabetes mellitus related cardiovascular diseases[J].CurPharmDes, 2013, 19(32): 5695-703.
[15] Wang L, Wu B, Sun Y, et al. Translocation of protein kinase C isoforms is involved in propofol-induced endothelial nitric oxide synthase activation[J].BrJAnaesth, 2010, 104(5): 606-12.
[16] Ramasarma T, Rafi M. A glucose-centric perspective of hyperglycemia[J].IndianJExpBiol, 2016, 54(2): 83-99.
Effects of chrysin on impaired vascular endothelial function induced by high glucose
ZHANG Xia-li1,HAN Si-jia1, LUO Le1, CHEN Min1, LI Jie1,TIAN Qing-qing1, GAO Xue-mei2,ZHANG Xuan-ping1
(1.DeptofPharmacology,ShanxiMedicalUniversity,Taiyuan030001,China; 2.DeptofPhysiology,ShanxiMedicalCollegeforContinuingEducation,Taiyuan030001,China)
Aim To explore the effects of chrysin on endothelial dysfunction induced by acute high glucose. Methods ① The effects of chrysin on normal isolated aortic at contraction induced by PE and on endothelial dysfunction induced by high glucose were tested in the following medium: normal group, chrysin group; normal-glucose group: glucose 11mmol·L-1in Krebs’ solution; high-glucose group: glucose 44 mmol·L-1in Krebs’ solution; mannitol group: mannitol 33 mmol·L-1in Krebs’ solution and chrysin group: 44 mmol·L-1Glu+chrysin 1.0 μmol·L-1in Krebs’ solution. ② The effects of chrysin on HUVEC cell viability after incubated in high glucose were observed in the following groups: normal-glucose group: glucose 5.5 mmol·L-1in culture solution; high-glucose group: glucose 33.3 mmol·L-1in culture solution; mannitol group: mannitol 27.8 mmol·L-1in culture solution and chrysin group: chrysin (25,50 μmol·L-1) in culture solution. And the NO release was also testd in these groups. Results ① Chrysin could induce vaso-dilation in a dose-dependent manner at normal glucose. The Emaxwas(58.94±9.61)%,and the EC50value was 51.9 μmol·L-1. After incubating the aortic rings with high glucose (44 mmol·L-1) for 4 h, there were significant differences in ACh-induced vascular relaxation between the normal glucose group and the high glucose group. The Emaxwas (32.12±3.92)% and the EC50value was 78.0 μmol·L-1of high glucose group (P<0.01). The endothelium-independent relaxation induced by SNP was not significantly different between the two groups. And chrysin (1.0 μmol·L-1) could reverse the decline of ACh-induced vasorelaxation response induced by high glucose (44 mmol·L-1). The Emaxwas (70.7±3.87)% and the EC50value was 0.852 μmol·L-1. ② The cell viability of HUVEC was depressed after incubated in high glucose, and chrysin could reverse the decline in a concentration-dependent way. And chrysin in defferent concentrations could increase the cell NO release. Conclusion Chrysin could prevent the acute high glucose-induced vascular endothelial dysfunction and could increase the NO release.
rat aorta; vascular rings; chrysin; acute high glucose; HUVEC; NO
2017-01-15,
2017-02-25
山西省卫生科研资助项目(No 2015109)
张夏丽(1992-),女,硕士生,研究方向:心血管药理学,E-mail:1107227536@qq.com; 张轩萍(1969-),女,博士,教授,硕士生导师,研究方向:心血管药理学,通讯作者,Tel: 0351-4135423, E-mail: yaolizxp@163.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.046.html
10.3969/j.issn.1001-1978.2017.05.023
A
1001-1978(2017)05-0707-06
R-332;R282.71;R322.121;R331.32;R587.1
