芍药苷对AGEs刺激下RAW264.7巨噬细胞TLR2/4通路的影响
2017-05-17刘超然邵云侠徐兴欣吴永贵
刘超然,邵云侠,徐兴欣,王 坤,吴永贵
(安徽医科大学第一附属医院肾内科,安徽 合肥 230022)
芍药苷对AGEs刺激下RAW264.7巨噬细胞TLR2/4通路的影响
刘超然,邵云侠,徐兴欣,王 坤,吴永贵
(安徽医科大学第一附属医院肾内科,安徽 合肥 230022)
目的 探讨芍药苷(paeoniflorin,PF)对晚期糖基化终末产物(advanced glycation end products,AGEs)刺激下RAW264.7巨噬细胞TLR2/4通路的影响。方法 AGEs在不同时间点刺激RAW264.7巨噬细胞,使用不同浓度的PF预先孵育细胞干预刺激,以优化实验条件;后将巨噬细胞随机分为对照组(DMEM培养基)、牛血清白蛋白(BSA)组(200 mg·L-1BSA)、AGEs组(200 mg·L-1AGEs)、PF组(200 mg·L-1AGEs+10-5mol·L-1PF)及TLR2/4抑制剂组(200 mg·L-1AGEs+30 mg·L-1人氧化磷脂)。Western blot检测各组TLR2、TLR4、髓样分化因子(MyD88)、p-IRAK1、β干扰素TIR结构域衔接蛋白(TRIF)、干扰素调节因子3(IRF3)、p-IRF3、NF-κB p-p65、NF-κB p65、iNOS、TNF-α、IL-1β和MCP-1蛋白表达,RT-PCR检测各组TLR2和TLR4 mRNA表达,ELISA法测定各组细胞上清液中TNF-α、IL-1β及MCP-1水平。结果 与对照组相比,AGEs能明显上调TLR2、TLR4、MyD88、p-IRAK1、TRIF、IRF3、p-IRF3、NF-κB p-p65、NF-κB p65、iNOS、TNF-α、IL-1β、MCP-1蛋白表达(P<0.01)及TLR2、TLR4 mRNA表达(P<0.01),增加细胞上清液中TNF-α、IL-1β、MCP-1水平(P<0.01);PF和TLR2/4抑制剂能明显下调AGEs诱导产生的效应(P<0.01)。结论 PF可通过抑制巨噬细胞TLR2/4信号通路而发挥抗炎作用,这可能为糖尿病肾病的治疗提供新的理论基础。
晚期糖基化终末产物;炎症;TLR2;TLR4;巨噬细胞;芍药苷
糖尿病肾病(diabetic nephropathy,DN)是一种慢性炎症反应性疾病[1]。目前大量研究表明,巨噬细胞是一种重要的炎症细胞,可以产生趋化因子、致炎因子、炎症介质等参与炎症反应,肾组织内巨噬细胞的浸润及活化是促进DN进程的重要原因[2]。最近研究显示,糖尿病肾组织中巨噬细胞炎性反应受到TLR2/4通路的介导和调节[3]。TLR2/4通路在糖尿病炎症过程中发挥了重要作用,可通过特异性识别多种病原相关分子模式(PAMPs),启动信号转导通路,促使巨噬细胞分泌大量细胞因子,介导炎性反应。因此,抑制TLR2/4通路信号途径,可能是干预DN进展的途径之一。芍药苷(paeoniflorin,PF)为传统中药芍药的主要成分,是一种单萜类糖苷化合物,具有抗炎、抗氧化、抗血小板聚集、免疫调节等作用[4-5]。研究证实,PF可通过抑制TLR2信号通路减少巨噬细胞的活化[6],并可抑制晚期糖基化终末产物(advanced glycation end products,AGEs)诱导的肾小球系膜细胞的氧化损伤和炎症[7]。鉴于以上认识,在本实验中,我们通过AGEs刺激巨噬细胞建立炎症模型[8],了解PF对TLR2/4信号通路及其相关炎性因子的影响,探讨PF对DN的保护作用及机制,为DN的治疗提供新思路。
1 材料与方法
1.1 材料 芍药苷(南京广润生物制品有限公司),AGEs、BSA(北京博奥森生物技术有限公司),RAW264.7巨噬细胞(上海细胞库),人氧化磷脂(TLR2/4特异性抑制剂,OxPAPC, 美国Invivogen公司),CCK-8试剂盒(南京诺唯赞生物科技有限公司),兔抗TLR4、MyD88、TRIF、iNOS多克隆抗体(美国Abcam公司),兔抗IRF3、p-IRF3、NF-κB p65、NF-κB p-p65多克隆抗体(美国Cell Signaling公司),兔抗TLR2多克隆抗体(美国EMD Millipore公司),兔抗p-IRAK1多克隆抗体(美国Santa Cruz公司),兔抗IL-1β 多克隆抗体、小鼠抗TNF-α、MCP-1、β-actin单克隆抗体、辣根酶过氧化物酶标记的山羊抗兔IgG抗体(武汉三鹰生物技术有限公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),TLR2、TLR4引物及探针(美国GeneCopoeia公司),GAPDH引物及探针(上海生工生物工程有限公司),TRIzol试剂(美国Invitrogen公司),TNF-α 和IL-1β ELISA试剂盒(美国R&D Systems 公司),MCP-1 ELISA试剂盒(北京瑞博奥生物科技有限公司)。
1.2 方法
1.2.1 RAW264.7巨噬细胞的培养 复苏后的RAW264.7巨噬细胞生长于含10%胎牛血清的DMEM培养基中,置于37℃、5% CO2饱和湿度的培养箱中培养。
1.2.2 细胞活力测定 将处于对数生长期的RAW264.7巨噬细胞置于96孔培养板中,培养基中胎牛血清含量为3%,调整每孔细胞数为5×104,孵育24 h使细胞同步化,预先1 h给予不同浓度的芍药苷处理细胞后,分别将其置于含200 mg·L-1的AGEs的培养基中孵育24 h,然后每孔加入10 μL CCK-8孵育4 h。使用波长为490 nm的酶标仪测定每孔的吸光度值。
1.2.3 实验条件的优化 采取同一浓度AGEs刺激RAW264.7巨噬细胞,选取不同时间点收集细胞,提取总蛋白,观察TLR2/4、iNOS蛋白表达,以确定AGEs刺激最佳时间。使用不同浓度PF 预先1 h干预巨噬细胞,AGEs刺激24 h后收集细胞,提取总蛋白,选取TLR2/4、iNOS蛋白表达抑制最明显的PF干预浓度,作为后期实验分组中的PF干预浓度。
1.2.4 实验分组 将RAW264.7巨噬细胞随机分为对照组(DMEM培养基孵育)、BSA组(200 mg·L-1BSA孵育)、AGEs组(200 mg·L-1AGEs)、PF组(200 mg·L-1AGEs+10-5mol·L-1PF)和TLR2/4抑制剂组(200 mg·L-1AGEs+30 mg·L-1OxPAPC),各组处理完毕后收集细胞。
1.2.5 Western blot检测各组细胞蛋白表达 收集接种于6孔板中的RAW264.7巨噬细胞,加入RIPA裂解液,离心取上清液,BCA法测定各组蛋白含量。加入5×上样缓冲液,100℃水浴变性提取蛋白,并在SDS-聚丙烯酰胺凝胶中进行电泳,经转膜仪将蛋白转移至硝酸纤维素膜(NC)后,经5%脱脂奶粉室温封闭2 h。分别加入TLR2抗体(1 ∶800)、TLR4抗体(1 ∶500)、MyD88抗体(1 ∶500)、p-IRAK1抗体(1 ∶1 000)、TRIF抗体(1 ∶1 000)、IRF3抗体(1 ∶1 000)、p-IRF3抗体(1 ∶1 000)、NF-κB p-p65抗体(1 ∶1 000)、NF-κB p65抗体(1 ∶1 000)、iNOS抗体(1 ∶1 000)、TNF-α 抗体(1 ∶500)、IL-1β 抗体(1 ∶500)、MCP-1抗体(1 ∶500)和 β-actin抗体(1 ∶35 000)4℃过夜,次日使用PBST洗膜后,加入辣根酶过氧化物酶标记的二抗(1 ∶8 000)室温孵育1 h,再次洗膜。将NC膜放入暗室滴加ECL发光剂,曝光并显影,在IQTL8.1软件系统中测定条带光密度值。
1.2.6 实时定量PCR检测各组细胞mRNA的表达 使用TRIzol试剂裂解细胞,并根据说明书提取总RNA,溶解于DEPC水中,用紫外分光光度计测定RNA的浓度和纯度,要求OD260/OD280值为1.8~2.0。使用反转录试剂盒合成cDNA。GAPDH引物由上海生工生物技术公司合成:上游5′-ACCCCAGCAAGGACACTGAGCAAG-3′,下游5′-GGCCCCTCCTGTTATTATGGGGGT-3′。下列引物GeneCopoeia公司合成:TLR2:货号MQP030650;TLR4:货号MQP032465,以此为模版,进行PCR扩增。GAPDH作为校正内参照,根据2-ΔΔct方法测定目标基因mRNA转录水平。
1.2.7 ELISA法检测细胞因子的水平 收集细胞培养上清液,依据ELISA试剂盒说明书进行操作,所有实验标本及标准品做复孔检测,使用酶标仪测量450 nm的吸光度值,绘制标准曲线,通过样本的OD值,从标准曲线上得到TNF-α、IL-1β、MCP-1的浓度。
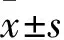
2 结果
2.1 PF对AGEs刺激下RAW264.7巨噬细胞活性的影响 选取10-8~10-3mol·L-1范围内的6种PF浓度,如Fig 1所示,当PF浓度在10-8~10-4mol·L-1时,对AGEs刺激下RAW264.7巨噬细胞的活性无明显影响(P>0.05),PF浓度为10-3mol·L-1时,对细胞的活性有影响(P<0.05)。
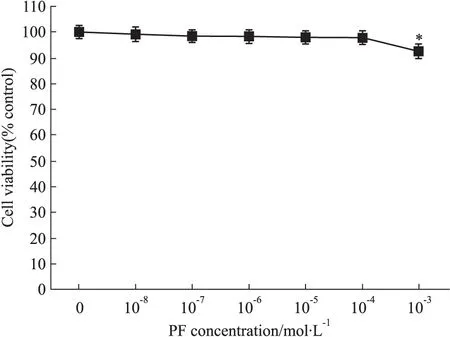
Fig 1 Viability analysis of RAW264.7 cells after treatment with paeoniflorin(10-8~10-3mol·L-1)in AGEs-induced RAW264.7 macrophages
*P<0.05vscontrol group(0 mol·L-1)
2.2 AGEs对巨噬细胞TLR2、TLR4及iNOS蛋白表达的影响 Western blot结果显示,TLR2于4 h后表达增强,24 h达高峰;TLR4于12 h后表达增强,24 h达高峰;iNOS于4 h后表达增强,24 h达高峰,与0 h时间点相比差异均有统计学意义(P<0.01),见Fig 2。故明确最合适的培养时间为24 h。
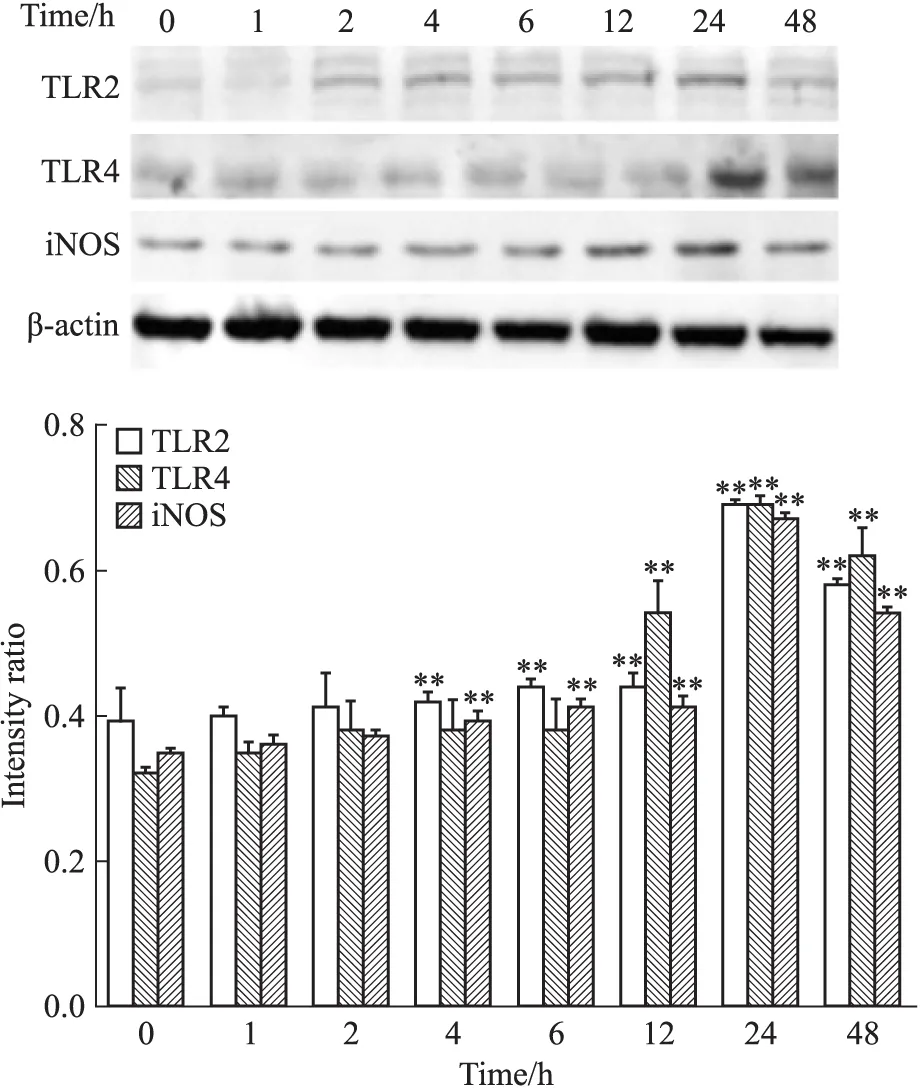
Fig 2 Effects of AGEs on TLR2,TLR4 and iNOS protein in RAW264.7 macrophages determined by Western blot
**P<0.01vscontrol group(0 h)
2.3 PF对AGEs刺激下巨噬细胞TLR2、TLR4及iNOS蛋白表达的影响 Western blot结果显示,AGEs作用24 h后,巨噬细胞 TLR2、TLR4及iNOS蛋白的表达均明显增加(P<0.01);PF可抑制TLR2、TLR4及iNOS的表达,且抑制的程度与剂量相关,在实验选取的4个浓度(10-8~10-5mol·L-1)中,PF浓度在10-5mol·L-1时,对AGEs刺激下TLR2、TLR4及iNOS表达抑制作用最为明显,与AGEs刺激组比较差异有统计学意义(P<0.01)。见Fig 3,故选择最合适的PF浓度为10-5mol·L-1。
2.4 各组巨噬细胞TLR2、TLR4、MyD88、p-IRAK1、TRIF、IRF3、p-IRF3、NF-κB p-p65、NF-κB p65、iNOS、TNF-α、IL-1β和MCP-1蛋白的表达变化 Western blot结果显示,AGEs组TLR2、TLR4、MyD88、p-IRAK1、TRIF、IRF3、p-IRF3、NF-κB p-p65、NF-κB p65、iNOS、TNF-α、IL-1β和MCP-1蛋白的表达均明显高于对照组(P<0.01),表明AGEs可上调上述巨噬细胞炎症因子的表达;与AGEs组相比,PF组和TLR2/4抑制剂组上述蛋白的表达均有所下降(P<0.01),提示PF和TLR2/4抑制剂均可抑制AGEs刺激的上述巨噬细胞炎症因子的表达。见Fig 4。
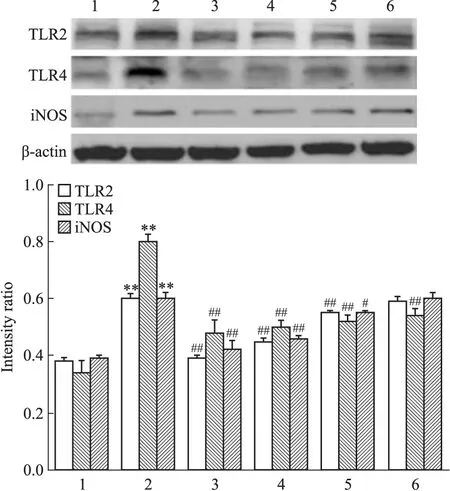
Fig 3 Effects of PF on TLR2,TLR4 and iNOS protein in AGEs-induced RAW264.7 macrophages determined by Western blot
1:Negative control;2:AGEs(200 mg·L-1);3:AGEs+PF(10-5mol·L-1);4: AGEs+PF(10-6mol·L-1);5:AGEs+PF(10-7mol·L-1);6:AGEs+PF(10-8mol·L-1).**P<0.01vscontrol group;#P<0.05,##P<0.01vsAGEs group
2.5 各组巨噬细胞TLR2和TLR4 mRNA的转录水平 实时荧光定量PCR结果显示,与对照组相比,AGEs组TLR2和TLR4 mRNA的表达明显增加(P<0.01);与AGEs组相比,PF组和TLR2/4抑制剂组TLR2 和TLR4 mRNA的表达均明显降低(P<0.01),见Fig 5。
2.6 各组巨噬细胞上清液中TNF-α、IL-1β及MCP-1的水平 ELISA结果显示,AGEs组TNF-α、IL-1β及MCP-1的水平明显高于对照组(P<0.01),PF组和TLR2/4抑制剂组TNF-α,IL-1β及MCP-1的水平均明显低于AGEs组(P<0.01),见Fig 6。
3 讨论
近年来,DN已成为终末期肾病的主要原因之一。DN临床和实验研究均提示巨噬细胞参与介导肾组织的炎症,且巨噬细胞在肾组织的浸润数量与肾损伤的严重性密切相关[9-10]。AGEs是一种蛋白质、脂质、核酸等大分子非酶糖化反应而形成的复杂化合物,在长期高血糖状态下,AGEs可大量生成[11],并激活巨噬细胞内的MAPK、TLR4、NF-κB等多种信号通路,分泌IL-6、TNF-α等多种细胞因子,参与炎症反应,导致肾小球肥大、基底膜增厚等病理改变,进而加重肾功能的损害[12]。本实验采用AGEs刺激RAW264.7巨噬细胞,观察TLR2/4信号通路及相应炎症因子的表达。结果表明,与对照组相比,AGEs刺激后,RAW264.7巨噬细胞TLR2/4、其下游信号通路MyD88、p-IRAK1、TRIF、IRF3、p-IRF3、NF-κB p-p65、NF-κB p65、iNOS及促炎因子TNF-α、IL-1β、MCP-1的表达明显上调,也证实了AGEs可激活RAW264.7巨噬细胞介导炎症反应。
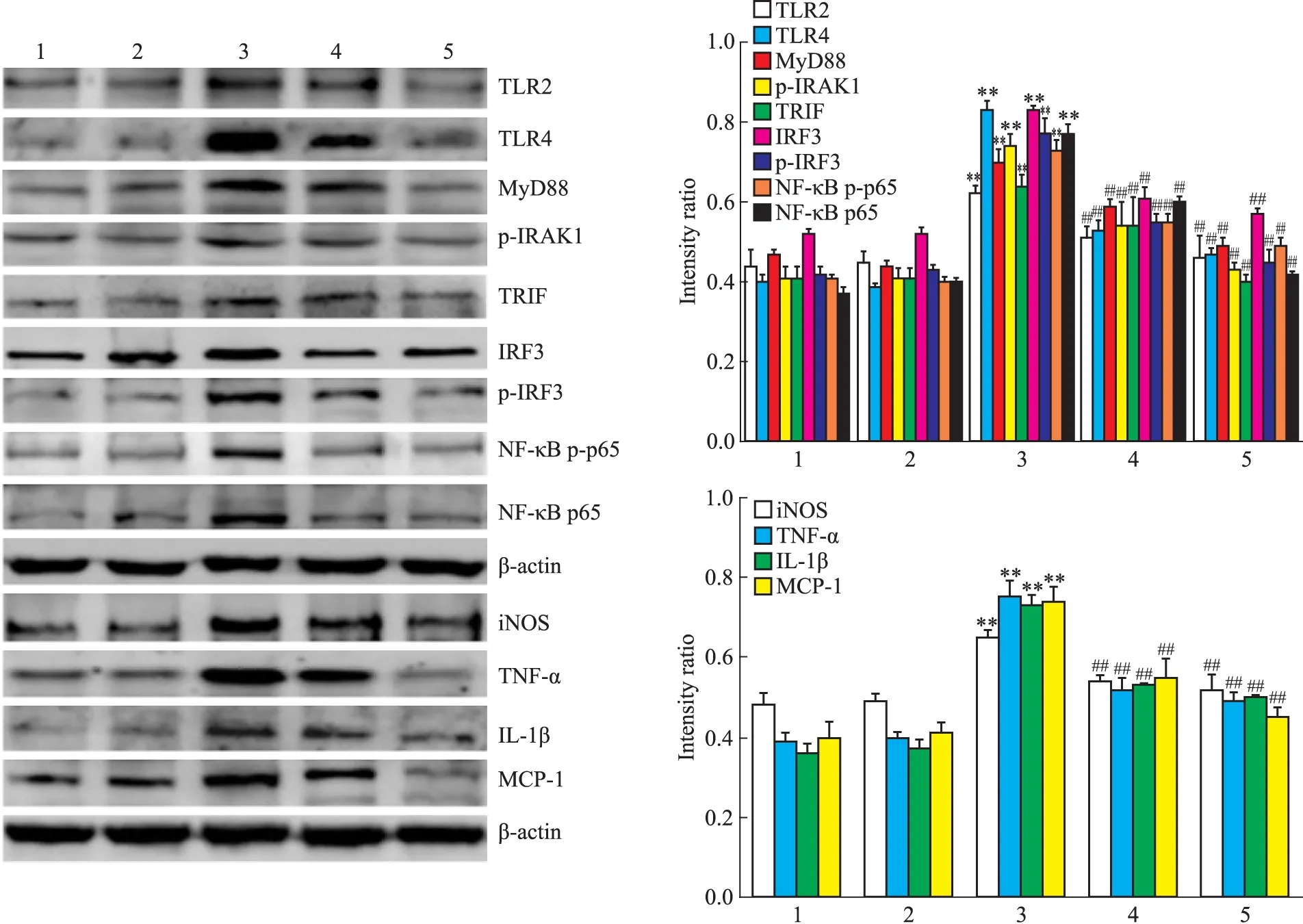
Fig 4 Expression of TLR2,TLR4,MyD88,p-IRAK1,TRIF,IRF3,p-IRF3,NF-κB p-p65,NF-κB p65,iNOS,TNF-α,IL-1β and MCP-1 protein determined by Western blot in RAW264.7 macrophages
1:Control;2:BSA(200 mg·L-1);3:AGEs(200 mg·L-1);4:PF(200 mg·L-1AGEs+10-5mol·L-1PF);5:TLR2/4 inhibitor(200 mg·L-1AGEs+30 mg·L-1OxPAPC).**P<0.01vscontrol group;##P<0.01vsAGEs group
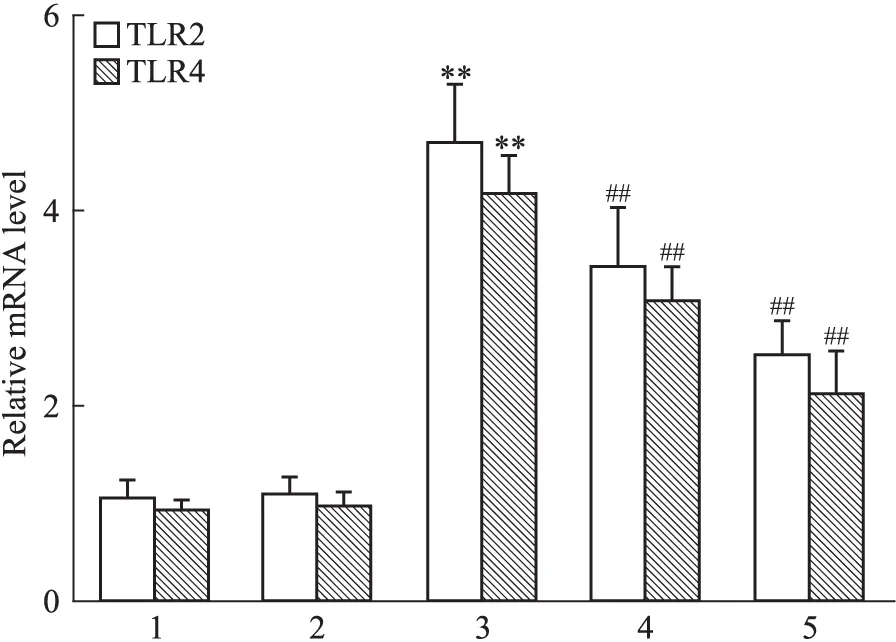
Fig 5 Expression of TLR2 and TLR4 mRNA determined by real-time PCR in RAW264.7 macrophages
1:Control;2:BSA(200 mg·L-1);3:AGEs(200 mg·L-1);4:PF(200 mg·L-1AGEs+10-5mol·L-1PF);5:TLR2/4 inhibitor(200 mg·L-1AGEs+30 mg·L-1OxPAPC).**P<0.01vscontrol group;##P<0.01vsAGEs group
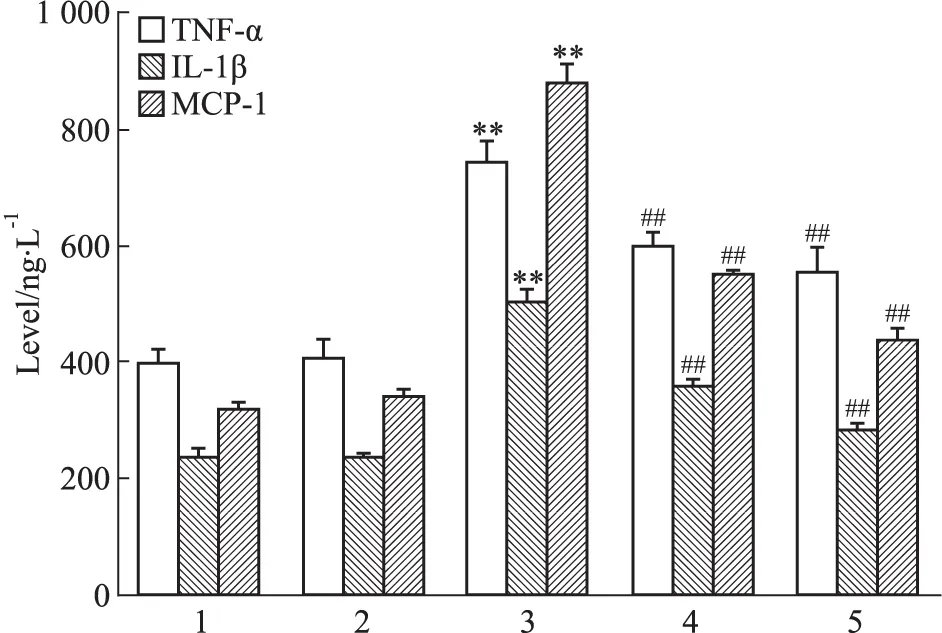
Fig 6 Level of TNF-α,IL-1β and MCP-1 measured by ELISA in cell supernatant
1:Control;2:BSA(200 mg·L-1);3:AGEs(200 mg·L-1);4:PF(200 mg·L-1AGEs+10-5mol·L-1PF);5:TLR2/4 inhibitor(200 mg·L-1AGEs+30 mg·L-1OxPAPC).**P<0.01vscontrol group;##P<0.01vsAGEs group
TLR2和TLR4均属于Toll样受体,是I型跨膜受体蛋白,主要表达于抗原提呈细胞上,激活后可启动MyD88依赖途径,招募IRAKs家族与TRAF6相互结合,并活化NF-κB。NF-κB为Rel家族的转录因子,通常是指p50、p65组成的异源二聚体,静息时与抑制蛋白IκB结合存在于细胞质中,当受到外界刺激时,与IκB解离进入细胞核内,引起一些促炎细胞因子,如IL-1β、TNF-α及MCP-1的释放。此外,TLR4还可通过TRIF途径激活IRF3,从而进行信号传导,启动炎症反应[13-15]。Li 等[16]研究表明,糖尿病大鼠肾组织中TLR2、NF-κB等表达明显增加,并伴有巨噬细胞的大量浸润。另有报道证实[17],在STZ诱导的TLR4-/-小鼠与野生型(WT)小鼠糖尿病模型中, 发现WT小鼠肾组织中TLR4、IL-6及TNF-α等细胞因子表达明显高于TLR4-/-小鼠,与WT小鼠相比,TLR4-/-小鼠的蛋白尿、肾小球硬化以及肾小管的损伤明显减少。本实验中,我们采用TLR2/4抑制剂OxPAPC预处理AGEs刺激下的RAW264.7巨噬细胞后,与AGEs组相比,可见TLR2/4通路及相应炎症因子的表达明显降低,进一步表明TLR2/4可通过调节其下游信号通路参与RAW264.7巨噬细胞的激活。因此,抑制TLR2/4信号分子的传递,可能对DN的防治有着重要意义。
PF具有多种生物学作用,包括神经保护、促进肝细胞再生、诱导肿瘤细胞凋亡、抗风湿等,因其毒副作用小而被临床广泛应用[18-20]。已有研究表明,PF可降低糖尿病大鼠尿白蛋白排泄率,减少其肾组织巨噬细胞的浸润,并抑制ICAM-1、TGF-β及NF-κB的高表达,从而发挥抗炎作用,保护DN[21]。我们先前的实验也证实白芍总苷(PF是白芍总苷主要活性成分)对糖尿病大鼠的肾脏有一定的保护作用,这可能与抑制TLR2/4信号通路及相应炎症因子的高表达相关[22]。本实验中,我们预先给予不同浓度的PF处理细胞,然后采用AGEs作为刺激因素诱导RAW264.7巨噬细胞活化,CCK-8细胞活性实验表明,当PF浓度小于10-4mol·L-1孵育时,几乎不影响AGEs刺激下的RAW264.7巨噬细胞生长。在优化实验条件时,通过观察同一浓度AGEs不同时间点的TLR2/4、iNOS蛋白表达,明确AGEs刺激最佳时间为24 h,且在安全剂量范围内使用不同浓度PF预先干预AGEs刺激下的RAW264.7巨噬细胞,我们发现最合适的PF干预浓度为10-5mol·L-1,故以此作为后续实验中的PF干预浓度,并使用TLR2/4抑制剂作为阳性对照。进一步研究发现,与AGEs组相比,PF明显抑制TLR2/4信号通路的激活及相应炎症因子的表达,提示PF可能通过干预TLR2/4信号通路,抑制RAW264.7巨噬细胞激活,进而保护DN。
综上所述,本研究结果初步证实AGEs能诱导RAW264.7巨噬细胞活化,而PF可明显下调AGEs诱导产生的效应,其机制可能与抑制TLR2/4信号通路有关,这为DN的治疗提供理论基础。但PF的抗炎作用除抑制TLR2/4通路外,还可能与其影响其他调控炎症因子表达的途径有关,这些炎症通路间是否有一定的交互调控,仍待进一步的实验探究。
(致谢:本实验于安徽医科大学第一附属医院肾内科实验室完成,实验过程中孟晓明教授给予悉心指导与大力支持,在此表示衷心的感谢。)
[1] Lim A K, Tesch G H. Inflammation in diabetic nephropathy[J].MediatorsInflamm, 2012, 2012: 146154.
[2] Awad A S, You H, Gao T, et al. Macrophage-derived tumor necrosis factor-α mediates diabetic renal injury[J].KidneyInt, 2015, 88(4): 722-33.
[3] Mudaliar H, Pollock C, Panchapakesan U. Role of Toll-like receptors in diabetic nephropathy[J].ClinSci(Lond),2014,126(10): 685-94.
[4] Jia Z,He J. Paeoniflorin ameliorates rheumatoid arthritis in rat models through oxidative stress, inflammation and cyclooxygenase 2[J].ExpTherMed, 2016, 11(2): 655-9.
[5] Zhang J, Li H, Huo R, et al. Paeoniflorin selectively inhibits LPS-provoked B-cell function[J].JPharmacolSci, 2015, 128(1): 8-16.
[6] Shao Y X, Xu X X, Li Y Y, et al. Paeoniflorin inhibits high glucose-induced macrophage activation through TLR2-dependent signal pathways[J].JEthnopharmacol, 2016, 193: 377-86.
[7] Zhang M H, Feng L, Zhu M M, et al. Antioxidative and anti-inflammatory activities of paeoniflorin and oxypaeoniflora on AGEs-induced mesangial cell damage[J].PlantaMed, 2013, 79(14): 1319-23.
[8] Pertyńska-Marczewska M, Kiriakidis S, Wait R, et al. Advanced glycation end products upregulate angiogenic and pro-inflammatory cytokine production in human monocyte/macrophages[J].Cytokine, 2004, 28(1): 35-47.
[9] Nguyen D, Ping F, Mu W, et al. Macrophage accumulation in human progressive diabetic nephropathy[J].Nephrology(Carlton), 2006, 11(3): 226-31.
[10]Chow F Y, Nikolic-Paterson D J, Atkins R C, et al. Macrophages in streptozotocin-induced diabetic nephropathy: potential role in renal fibrosis[J].NephrolDialTransplant, 2004, 19(12): 2987-96.
[11]Singh V P, Bali A, Singh N, et al. Advanced glycation end products and diabetic complications[J].KoreanJPhysiolPharmacol, 2014, 18(1): 1-14.
[12]Xu X, Qi X, Shao Y, et al. Blockade of TGF-β-activated kinase 1 prevents advanced glycation end products-induced inflammatory response in macrophages[J].Cytokine, 2016, 78: 62-8.
[13]Ntoufa S, Vilia M G, Stamatopoulos K, et al. Toll-like receptors signaling:a complex network for NF-κB activation in B-cell lymphoid malignancies[J].SeminCancerBiol, 2016, 39:15-25.
[14]García Bueno B, Caso J R, Madrigal J L, et al. Innate immune receptor Toll-like receptor 4 signalling in neuropsychiatric diseases[J].NeurosciBiobehavRev, 2016, 64:134-47.
[15]Karampitsakos T, Woolard T, Bouros D,et al. Toll-like receptors in the pathogenesis of pulmonary fibrosis[J].EurJPharmacol, 2016,pii:S0014-2999(16)30404-6.
[16]Li F, Yang N, Zhang L,et al. Increased expression of toll-like receptor 2 in rat diabetic nephropathy[J].AmJNephrol, 2010, 32(2): 179-86.
[17]Ma J, Chadban S J, Zhao C Y, et al. TLR4 activation promotes podocyte injury and interstitial fibrosis in diabetic nephropathy[J].PLoSOne, 2014, 9(5): e97985.
[18]王国峰, 尹鲁平, 赵 霞, 等. 胆碱能M受体信号通路在芍药苷抗脑缺血神经保护中的作用[J]. 中国药理学通报, 2012, 28(3): 311-6.
[18]Wang G F, Yi L P, Zhao X, et al. Neuroprotection induced by paeoniflorin against cerebral ischemia through mediating muscarinic receptor signaling pathway[J].ChinPharmacolBull, 2012, 28(3): 311-6.
[19]Wu Q, Chen G L, Li Y J, et al. Paeoniflorin inhibits macrophage-mediated lung cancer metastasis[J].ChinJNatMed, 2015, 13(12): 925-32.
[20]Zhai J, Guo Y. Paeoniflorin attenuates cardiac dysfunction in endotoxemic mice via the inhibition of nuclear factor-B[J].BiomedPharmacother, 2016, 80: 200-6.
[21]Fu J, Li Y, Wang L, et al. Paeoniflorin prevents diabetic nephropathy in rats[J].CompMed, 2009, 59(6): 557-66.
[22]Xu X X, Qi X M, Zhang W, et al. Effects of total glucosides of paeony on immune regulatory toll-like receptors TLR2 and 4 in the kidney from diabetic rats[J].Phytomedicine, 2014, 21(6): 815-23.
Effect of paeoniflorin on TLR2/4 pathway in AGEs-induced RAW264.7 macrophages
LIU Chao-ran, SHAO Yun-xia, XU Xing-xin, WANG Kun, WU Yong-gui
(DeptofNephropathy,theFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022,China)
Aim To investigate the effect of paeoniflorin(PF) on TLR2/4 pathway in AGEs-induced RAW264.7 macrophages.Methods RAW264.7 macrophages were incubated at different time points in AGEs stimulation, as well as different concentrations of PF, to optimize experimental conditions. RAW264.7 macrophages were randomly divided into five groups: control group(DMEM), bull serum albumin(BSA) group(200 mg·L-1BSA), AGEs group(200 mg·L-1AGEs), paeoniflorin group(200 mg·L-1AGEs+10-5mol·L-1PF) and TLR2/4 inhibitor group(200 mg·L-1AGEs+30 mg·L-1OxPAPC). The expression of Toll-like receptor 2(TLR2), Toll-like receptor 4(TLR4), myeloid differentiation factor 88(MyD88), p-IRAK1, TIR-domain containing adaptor protein-inducing IFN-β(TRIF), interferon regulatory factor 3(IRF3), p-IRF3, NF-κB p-p65, NF-κB p65, inducible nitric oxide synthase(iNOS), tumor necrosis factor-α(TNF-α), interleukin-l β(IL-1β) and monocyte chemotactic protein-1(MCP-1) were measured by Western blot. Real-time PCR was used to detect the expression of TLR2 and TLR4 mRNA, while TNF-α, IL-1β and MCP-1 levels in cell supernatant were measured by ELISA.Results Compared with control group, AGEs significantly increased the expression of TLR2, TLR4, MyD88, p-IRAK1, TRIF, IRF3, p-IRF3, NF-κB p-p65, NF-κB p65, iNOS, TNF-α, IL-1β and MCP-1 proteins(P<0.01), as well as TLR2 and TLR4 mRNA(P<0.01). TNF-α, IL-1β and MCP-1 contents were also elevated in cell supernatant(P<0.01). The effects induced by AGEs were decreased significantly in PF and TLR2/4 inhibitor group(P<0.01).Conclusion PF plays an anti-inflammatory effect via inhibiting TLR2/4 pathway on macrophages, which may provide a new theoretical basis for the treatment of diabetic nephropathy.
advanced glycation end products; inflammation; TLR2; TLR4; macrophage; paeoniflorin
2017-01-12,
2017-02-17
国家自然科学基金资助项目(No 81374034)
刘超然(1993-),女,硕士生,研究方向:糖尿病肾病分子发病机制与干预,E-mail:1016391620@qq.com; 吴永贵(1966-),男,博士,教授,博士生导师,研究方向:糖尿病肾病分子发病机制与干预,通讯作者,E-mail:wuyonggui@medmail.com.cn
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.034.html
10.3969/j.issn.1001-1978.2017.05.017
A
1001-1978(2017)05-0675-06
R284.1;R329.24;R364.5;R392.11;R587.2;R692.39
