多巴胺对大鼠胰岛素分泌的影响及机制研究
2017-05-17钟向琴丁亚琴任乐乐刘萌萌刘云峰
钟向琴,丁亚琴,任乐乐,白 涛,,刘萌萌,刘云峰,章 毅
(山西医科大学 1.基础医学院药理学教研室、2.第一医院内分泌科,山西 太原 030001)
多巴胺对大鼠胰岛素分泌的影响及机制研究
钟向琴1,丁亚琴1,任乐乐1,白 涛1,2,刘萌萌1,刘云峰2,章 毅1
(山西医科大学 1.基础医学院药理学教研室、2.第一医院内分泌科,山西 太原 030001)
目的 研究多巴胺(dopamine,DA)对大鼠胰岛素分泌的影响及可能机制。方法 ♂ SD大鼠的胰腺经过胶原酶P消化、Histopaque 1077梯度离心后得到纯化的胰岛,Dispase Ⅱ将胰岛消化为单个细胞。应用胰岛素分泌实验来验证DA对胰岛素分泌的作用,通过膜片钳技术和钙成像技术记录β细胞内向性钙电流、动作电位时程和细胞内Ca2+浓度,研究DA对大鼠胰岛素分泌的作用机制。结果 在2.8 mmol·L-1的葡萄糖中,DA对胰岛素的分泌没有产生明显的影响;在16.7 mmol·L-1的葡萄糖中,DA呈浓度依赖性抑制胰岛素的分泌。DA干预后,抑制了胰岛β细胞上内向性钙电流,缩短动作电位时程,减少了细胞内Ca2+浓度。结论 DA通过抑制β细胞上内向性钙电流,进而缩短了动作电位的时程,降低细胞内Ca2+浓度,最终抑制胰岛素的分泌。
多巴胺;胰岛β细胞;胰岛素分泌;电压门控性Ca2+通道;动作电位;钙成像
多巴胺(dopamine,DA)是一种主要由大脑分泌的神经传递物质,负责控制人的运动、情绪与感觉,并将兴奋信息上传,与精神和神经系统方面的疾病密切相关[1]。研究表明[2],在外周组织如肾脏、胰腺和上消化道中也可以合成并释放多巴胺,调节非神经系统的功能。由于外周多巴胺无法穿过血脑屏障,不会影响到神经系统的功能,但是它可以在其合成的组织中发挥着旁分泌的作用。近年来,多巴胺与胰岛素之间的关系受到越来越多的关注。临床发现长期使用多巴胺的前体左旋多巴治疗帕金森疾病,这些病人通过口服糖耐量实验发现糖的耐受力明显下降,这种现象在帕金森患病人群中高达50%~80%[3]。多巴胺被认为可以影响胰岛素的分泌[4],然而其作用机制尚不明晰。本研究拟通过胰岛素分泌实验以及膜片钳、钙成像技术,探究多巴胺对胰岛素分泌的作用及可能机制。
1 材料与方法
1.1 实验动物 SD大鼠,♂,由中国人民解放军军事医学科学院实验动物中心提供,体质量180~250 g。生产许可证号:SCXK-(军)2012-0004。
1.2 试剂 Dopamine hydrochloride(美国Sigma,批号:BCBG8676V);胶原酶P(瑞士Roche,批号:11104222);BSA(北京索莱宝,批号:83100513);RPMI 1640培养基(上海生工,批号:C518FA0002);胎牛血清(上海生工,批号:B326FA0092);青、链霉素(北京索莱宝,批号:20150909);HEPES(北京索莱宝,批号:710B048);Histopaque 1077(美国Sigma,批号:RNBF1783);Dispase II(美国Amresco,批号:10888700); D-葡萄糖(北京索莱宝,批号:405A0918);胰岛素检测试剂盒(北京北方生物技术研究所,批号:20160320)。
1.3 仪器 电子天平(上海精密仪器,型号:GB/T26497);体式显微镜(上海中恒仪器,型号:SM262);倒置显微镜(日本OLYMPUS, 型号:AE-2000);台式离心机(长沙湘仪仪器, 型号:SC-3610);细胞培养箱(北京博奥恒信生物科技, 型号:HF100);Narishige MODEL PP-830电极拉制仪(日本Narishige, 型号:PP-830);MIRO FORGE MF-830抛光仪(日本Narishige, 型号:MF-200);EPC10全自动膜片钳(德国HEKA, 型号:MP-285);钙成像(北京MDE, 型号:LAMBDA 10-B)。
1.4 方法
1.4.1 大鼠胰岛、胰岛细胞的分离与培养 ♂ SD大鼠断头处死后,将1 g·L-1胶原酶P溶液(RPMI 1640培养基溶解)缓慢注入到胆总管中,分离的胰腺经37℃水浴消化、Histopaque 1077梯度离心得到单个胰岛,并放于37℃、5% CO2的细胞培养箱中培养。分离胰岛细胞时,使用5 g·L-1的Dispase Ⅱ酶液消化胰岛,将细胞悬液均匀地接种在经细胞黏附剂处理过的玻片上,加入培养液后放于细胞培养箱中培养[5]。
1.4.2 胰岛素释放实验 分得的单个胰岛经过夜修复后备用,每组7管,每管中放入5个胰岛。首先,使用2.8 mmol·L-1葡萄糖孵育液37℃孵育30 min,弃除上清;然后,分别加入2.8 mmol·L-1和16.7 mmol·L-1葡萄糖孵育液以及含有不同浓度的DA孵育30 min,收集上清液,采用放免法测得胰岛素含量;最后,加入乙醇粉碎胰岛,测得胰岛素的总含量。
1.4.3 膜片钳实验 将分离的胰岛细胞置于倒置显微镜下,细胞膜电容>7 pF的为β细胞。记录电极经PP-830电极拉制仪两步法拉制,充满电极内液后电阻为4~7 MΩ,当电极尖端与细胞膜之间形成高阻封接(≥1 GΩ)后,负压破膜,使电极内液与细胞内液相通,形成全细胞记录模式。记录电压门控性钙电流时,在-70 mV钳制电压下给予-50 mV~30 mV的电压刺激,记录50 ms内每次递增10 mV的钙电流。记录动作电位采用电流钳模式,封接破膜后,给予150 pA、4 ms的电流注入,计算从去极化开始到复极化于静息电位之上10 mV的时程为动作电位时程[6]。
1.4.4 钙成像实验 细胞在37℃的环境下用2 μmol·L-1的Fura-2AM荧光探针染料染色约30 min。然后将细胞放置于激光共聚焦显微镜上,设定激发波长为340 nm/380 nm,发射波长为510 nm。以持续灌流的方式给予2.8 mmol·L-1葡萄糖(2.8 G)、16.7 mmol·L-1葡萄糖(16.7 G)和10 μmol·L-1DA(以16.7 G溶解),F340/F380的比值反映灌流液体对细胞内钙离子浓度的影响。该实验在30℃环境中进行。
2 结果
2.1 DA对大鼠胰岛素分泌的影响 在2.8 mmol·L-1葡萄糖(2.8 G)和16.7 mmol·L-1葡萄糖(16.7 G)的基础上分别加入不同浓度的DA(0、1、10 mmol·L-1),孵育30 min后,检测上清液中胰岛素的含量。Tab 1结果显示,在2.8 G的条件下,DA对胰岛素的分泌没有产生明显的影响;在16.7 G的条件下,DA呈浓度依赖性抑制胰岛素的分泌(P<0.01)。
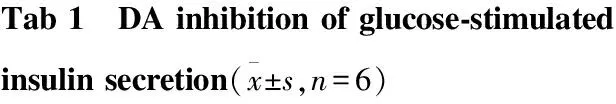
Glucoseconcen⁃tration/mmol·L-1Dopamine/μmol·L-101102.8G12.498±3.05614.184±2.5489.042±1.18116.7G158.588±9.721##91.154±5.528∗45.930±6.706∗∗
##P<0.01vs2.8 G(DA 0 μmol·L-1);*P<0.05,**P<0.01vs16.7 G(DA 0 μmol·L-1)
2.2 DA对胰岛β细胞电压门控性钙通道的影响 通过电压钳技术,在-70 mV的钳制电压下给予-50 mV~30 mV的电压刺激50 ms,每次递增10 mV检测胰岛β细胞上钙电流。与对照组相比,DA(10 μmol·L-1)明显地抑制了钙电流[0 mV时,对照组(-3.963±0.406) pA/pF,DA组(-2.344±0.429) pA/pF,P<0.01]。见Fig 1。
2.3 DA对胰岛β细胞动作电位时程的影响 通过电流钳技术,给予细胞150 pA、4 ms的电流注入,检测给药前后动作电位时程的变化。与对照组相比,DA(10 μmol·L-1)明显地缩短了动作电位的时程(P<0.01)。见Tab 2。
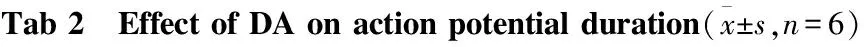

GroupActionpotentialduration/msControl59.578±4.493TreatmentwithDA32.968±3.166∗∗
**P<0.01vscontrol
2.4 DA对胰岛β细胞内Ca2+浓度的影响 细胞在37℃的环境下使用2 μmol·L-1的Fura-2AM孵育约30 min,然后放置于340 nm/380 nm激发波长,510 nm发射波长下,测得DA对细胞内Ca2+浓度的影响。Fig 2结果显示,DA使细胞内Ca2+浓度减少。以灌流初始值(F0)标化后结果如下:2.8 G(0.036±0.001),8.3 G(0.631±0.033),DA(0.482±0.034)。
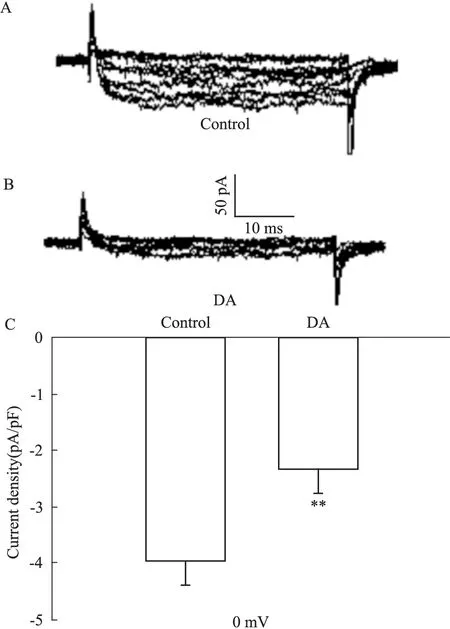
Fig 1 Effect of DA on voltage-gated calcium channels
A,B:Representative current traces recorded under the different treatment as indicated;C:Summary of the mean current density of Ca2+currents at 0 mV(n=6).**P<0.01vscontrol
3 讨论
在生理条件下,葡萄糖是影响胰岛素释放最主要的因素。葡萄糖通过主动转运的方式进入细胞内部后,经过糖酵解和氧化磷酸化生成ATP,ATP使细胞膜上的ATP敏感性钾通道(KATP)关闭,细胞膜去极化,达到一定程度后,电压依赖性钙通道开放,外钙内流,细胞内钙离子浓度升高,使成熟的分泌囊泡附着于微管微丝上,并通过两者的相互作用促进囊泡膜与细胞膜融合,最终诱导胰岛素的释放[7-8]。除此之外,外周的多种配体也发挥着重要的调节作用,如血管活性肠肽(VIP)、胰高血糖素样肽(GLP-1)、乙酰胆碱(Ach)等。有数据显示,多巴胺作为一个生理因子可以与β细胞上的多巴胺受体结合调节细胞的分泌活动[2,7,9],外周多巴胺的异常会影响胰岛素的正常调节。帕金森患者在治疗过程中,通常使用左旋多巴和苄丝肼以提高中枢神经系统中多巴胺的浓度,并阻止外周左旋多巴转换为多巴胺给机体带来负面影响[10],但在这一过程中仍然会有部分的多巴胺进入到外周[2],抑制葡萄糖刺激胰岛素的分泌活动,给胰岛功能造成慢性的压力,使得帕金森患者中糖耐量异常现象较为普遍[3,10]。因此,了解外周配体,尤其是多巴胺对于调节胰岛素释放的机制变得越来越重要。现今的文献报道中,关于多巴胺对胰岛素分泌的影响存在着争议,有部分学者认为多巴胺及其类似物可以抑制葡萄糖刺激胰岛素分泌,而少部分认为急性多巴胺的大量累积可以促进胰岛素的分泌[9]。在本实验中,我们发现DA在16.7 G的基础上明显地抑制了胰岛素的分泌,而在2.8 G的基础上对胰岛素的分泌活动影响较小。电压-电流曲线关系表明,DA抑制了电压门控性钙通道的开放,减小了钙电流。通过给予150 pA、4 ms的电流注入,观察细胞动作电位时程的变化,结果表明,DA通过抑制钙电流,加快动作电位的复极化,明显缩短了动作电位的时程。DA干预后,细胞内钙离子浓度降低,这可能与电压门控性钙通道被抑制有关。
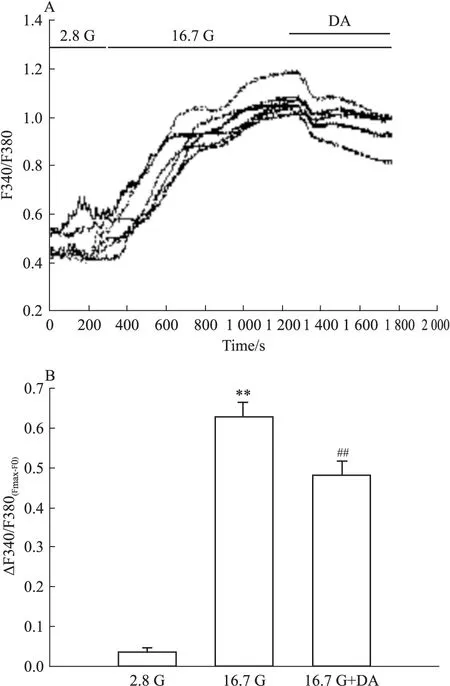
Fig 2 Effect of DA on level of intracellular Ca2+ concentration
A: The trace shows the changes of intracellular Ca2+concentration in a representative cell perfused with 2.8,16.7 and 16.7 G+DA(10 μmol·L-1);B:The mean value of ΔF340/F380(Fmax-F0)in response to different treatments as indicated(n=6).##P<0.01vs16.7G;**P<0.01vs2.8G. The change of intracellular calcium[ΔF340/F380(Fmax-F0)] was determined by subtracting the initial F340/F380 ratio from the maximum F340/F380 for each treatment
我们推测,DA可能是通过抑制了钙通道影响了胰岛素的分泌。由于β细胞的动作电位主要是由Ca2+通道和K+通道来产生的,是动作电位去极化和复极化的主要离子通道,而动作电位又可以直接调节胰岛素的分泌活动。本次实验证实了DA抑制了电压门控性Ca2+通道,使得动作电位去极化幅度降低,复极增快,动作电位时程缩短,细胞的兴奋性下降;同时也使细胞内Ca2+浓度下降,分泌囊泡与细胞膜融合缺乏动力,影响了囊泡的胞吐活动,最终抑制了胰岛素的分泌活动。但关于K+通道是否也参与其中仍待进一步的研究。
(致谢:本文实验在山西医科大学药理教研室章毅实验室完成,在此对实验人员表示感谢。)
[1] Tritsch N X,Sabatini B L. Dopaminergic modulation of synaptic transmission in cortex and striatum[J].Neuron,2012,76(1):33-50.
[2] Ustione A,Piston D W,Harris P E. Minireview: dopaminergic regulation of insulin secretion from the pancreatic islet[J].MolEndocrinol,2013,27(8):1198-207.
[3] Sandyk R.The relationship between diabetes mellitus and Parkinson’s disease[J].IntJNeurosci,1993,69(1-4):125-30.
[4] Lopez Vicchi F, Luque G M,Brie B,et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis[J].PharmacolRes,2016,109:74-80.
[5] 章 毅,刘云峰,高璟英,等. 染料木黄酮对大鼠胰岛素分泌的调控作用[J].中国药理学通报, 2015,31(5): 737-8.
[5] Zhang Y,Liu Y F,Gao J Y,et al. Regulatory effects of genistein on insulin secretion from rat pancreatic cells[J].ChinPharmacolBull, 2015, 31(5):737-8.
[6] Collier J J,White S M,Dick G M,et al. Phosphatidylinositol 3-kinase inhibitors reveal a unique mechanism of enhancing insulin secretion in 832/13 rat insulinoma cells[J].BiochemBiophysResCommun,2004,324(3):1018-23.
[7] Rubi B,Ljubicic S,Pournourmohammadi S,et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion[J].JBiolChem,2005,280(44):36824-32.
[8] 赵艳丽,丁亚琴,王 慧,等. 1-磷酸鞘氨醇促进胰岛素分泌及可能机制研究[J].中国药理学通报,2016,32(11):1516-20.
[8] Zhao Y L,Ding Y Q,Wang H,et al. Effects and possible mechanism of sphingosine-1-phosphate-stimulated insulin secretion from rat islets[J].ChinPharmacolBull,2016,32(11):1516-20.
[9] Garcia Barrado M J,Iglesias Osma M C,Blanco E J,et al. Dopamine modulates insulin release and is involved in the survival of rat pancreatic beta cells[J].PLoSOne,2015,10(4):e0123197.
[10]Ustione A,Piston D W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca2+] oscillations[J].MolEndocrinol,2012,26(11):1928-40.
Effect of DA on insulin secretion from rat pancreatic cells and possible mechanism
ZHONG Xiang-qin1, DING Ya-qin1, REN Le-le1, BAI Tao1,2, LIU Meng-meng1, LIU Yun-feng2, ZHANG Yi1
(1.DeptofPharmacology,2.DeptofEndocrinologyoftheFirstHospital,ShanxiMedicalUniversity,Taiyuan030001,China)
Aim To investigate the effects of dopamine(DA) on insulin secretion from rat islets and the possible mechanism.Methods Pancreatic islets were obtained from the pancreatic of male SD rats by collagenase P digestion and histopaque-1077 density gradient separation. Insulin secretion experiment was used to observe the change of insulin release after DA treatments. As to study the potential mechanisms of the effects of DA, patch-clamp experiment and calcuim image technique were applied to test the depolarization-evoked Ca2+currents, action potential duration and intracellular Ca2+concentration.Results In 2.8 mmol·L-1glucose, DA had no effect on insulin secretion; in 16.7 mmol·L-1glucose, dopamine inhibited insulin secretion in a dose-dependent manner. DA inhibited the inward calcium current, shorten the action potential duration, and reduced the intracellular Ca2+concentration.Conclusion DA inhibits insulin secretion maybe by decreasing the inward calcium current leading to shorten the action potential duration and reduce the intracellular Ca2+concentration.
dopamine hydrochloride; islet β cell; insulin secretion; voltage-gated calcium channels; action potential; calcuim image technique
2016-12-11,
2017-01-20
国家自然科学基金资助项目(No 81670710,81373464,81273564,81270882);山西省留学回国人员科技活动项目择优资助(No 2016-97);山西省自然科学基金资助项目(No 2013011047-3)
钟向琴(1992-),女,硕士生,研究方向:内分泌药理学,E-mail:1246131750@qq.com; 章 毅(1971-),男, 博士,教授,博士生导师,研究方向:内分泌药理学,通讯作者,E-mail: yizhang313@163.com; 刘云峰(1973-),女, 博士,副主任医师,硕士生导师,研究方向:糖尿病的治疗及发病机制,通讯作者,E-mail: nectarliu@163.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.026.html
10.3969/j.issn.1001-1978.2017.05.013
A
1001-1978(2017)05-0653-04
R-332;R322.57;R347.8;R348.1;R971.93
