八肋游仆虫胞质核糖体蛋白基因序列特征分析
2017-05-16王软林赵雪梅张志云梁爱华
王软林 赵雪梅 张志云 梁爱华
(山西大学生物技术研究所化学生物学与分子工程教育部重点实验室, 太原 030006)
八肋游仆虫胞质核糖体蛋白基因序列特征分析
王软林 赵雪梅 张志云 梁爱华
(山西大学生物技术研究所化学生物学与分子工程教育部重点实验室, 太原 030006)
为了探讨八肋游仆虫(Euplotes octocarinatus)核糖体蛋白基因的数目及其结构的特殊性, 研究通过生物信息学方法, 对八肋游仆虫胞质核糖体蛋白进行了系统的分析。共鉴定得到98个基因编码78种不同的胞质核糖体蛋白。其中19种胞质核糖体蛋白基因发生了复制, 尽管都是有功能的, 但其中一个基因的表达受到限制。通过与高等真核生物比较, 我们发现: 八肋游仆虫核糖体蛋白eS30缺失了N端的类泛素结构域, eL6缺失了N端的Ribosomal_L6e_N结构域。另外, 不同于其他高等真核生物, 八肋游仆虫酸性核糖体磷酸化蛋白uL10为碱性蛋白。研究为进一步探讨低等真核生物核糖体的组装及功能奠定了基础。
八肋游仆虫; 核糖体蛋白; 序列分析
核糖体是最古老也是最普遍的生命复合体, 它能够将遗传信息(mRNA)转化为执行各种生命功能的蛋白质, 是细胞中催化蛋白质合成的重要细胞器。虽然进化程度越高, 生物的核糖体越复杂, 但其结构和功能在进化上是保守的[1]。所有的核糖体都由一组核糖体蛋白(Ribosomal protein, RP)围绕着催化活性中心核糖体RNA(rRNA)组成。真核生物胞质核糖体位于内质网及细胞质基质中, 负责翻译核基因产生的所有mRNA。它由4种不同的rRNA分子及78—80种胞质核糖体蛋白(Cytoplasmic ribosomal proteins, CRPs)组成。其中, 大亚基含有28S rRNA、5.8S rRNA、5S rRNA及47种RPs, 小亚基含有18S rRNA和32种RPs[2]。
1979年, Wool[3]首次对大鼠(Rat)的CRPs进行了分离和性质描述。随后, 人们陆续对人(Homo sapiens)[4,5]、酿酒酵母(Saccharomyces cerevisiae)[6]、拟南芥(Arabidopsis thaliana)[7]及黑腹果蝇(Drosophila melanogaster)[1]等多种生物的全部核糖体蛋白基因(Ribosomal protein genes, RPGs)进行了系统分析。目前, 核糖体蛋白基因数据库 (Ribosomal protein gene database)中已收录39种真核生物, 4种古细菌, 4种真细菌的全部CRPs基因序列信息[8]。
八肋游仆虫(Euplotes octocarinatus)是一种淡水纤毛虫, 体内含有一个大核和一个小核[9]。除了其特殊核结构外, 在基因表达调控方面游仆虫也有特殊之处。在游仆虫中存在终止密码子重新分配的现象, 即UAA和UAG作为终止密码子, 而UGA编码半胱氨酸[10]或硒代半胱氨酸[11]; 此外游仆虫中还存在高频率的编程性核糖体移码现象[12,13]。游仆虫中这些特殊现象均与蛋白质合成过程相关, 而核糖体又是细胞内蛋白质合成的场所, RPs作为核糖体的重要组成部分, 在游仆虫中是否具有特殊性呢?
本研究利用实验室前期测得的八肋游仆虫基因组和转录组数据, 通过同源序列比对, 共鉴定得到98条RPGs序列, 对应于78种RPs。此外, 对其结构域、理论等电点及分子量进行了分析, 并与高等真核生物进行比较。为进一步探讨游仆虫RPs结构的特殊性, 对比分析高等真核生物、低等真核生物、原核生物RPs的基因结构及三者之间的分子进化关系提供数据支持。
1 材料与方法
1.1 数据来源
八肋游仆虫基因组数据, 转录组数据及蛋白质谱数据由本实验室前期测得[12,13]。嗜热四膜虫(Tetrahymena thermophile) RPs序列下载自TGD (http:// ciliate.org/index.php/home/welcome), 三棱尖毛虫(Oxytricha trifallax)RPs序列下载自OxyDB (http:// oxy.ciliate.org/index.php/home/welcome/), 第四双小核草履虫(Paramecium tetraurelia) RPs序列下载自ParameciumDB (http://paramecium.cgm.cnrs-gif.fr/),浮萍棘尾虫(Stylonychia lemnae) RPs序列下载自StyloDB (http://stylo.ciliate.org/index.php/home/welcome), 多子小瓜虫(Ichthyophthirius multifiliis) RPs序列下载自IchDB (http://ich.ciliate.org/index. php/home/welcome); 人及其他物种的RPs序列均下载自核糖体蛋白数据库(Ribosomal protein gene database: http://ribosome.med.miyazaki-u.ac.jp/)。
本研究涉及的生物学软件有: 本地化的BLAST软件[14], EMBOSS软件包中的GetOrf程序[15], Web-Logo[16]及MEGA5.1[17]。
1.2 八肋游仆虫胞质核糖体蛋白基因的鉴定
为了尽可能找出基因组中所包含的全部CRPs基因序列, 我们对八肋游仆虫基因组及转录组数据库进行了一系列的BLAST搜索。首先利用人的CRPs序列作为queries对八肋游仆虫基因组数据库进行tblastn搜索, 考虑到二者之间进化差异较大, 我们将E值设置为0.1。接着将鉴定得到的八肋游仆虫微染色体序列作为queries, 对NCBI的非冗余蛋白数据库进行blastx搜索, 检查每条序列blastx结果的前20条匹配项是否为核糖体蛋白, 最终鉴定得到110条可能编码CRPs基因的微染色体。为了排除其中可能的假基因, 对八肋游仆虫转录组数据库进行blastn搜索, 最终有98条微染色体找到了对应的转录本。
1.3 生物信息学分析
利用EMBOSS软件包中的GetOrf程序预测RPs的氨基酸长度, 利用ExPASy (http://web.expasy. org/compute_pi/)在线预测游仆虫RPs理论等电点及分子量, 利用Pfam[18](http://pfam.xfam.org/)在线预测游仆虫RPs所含结构域。
1.4 八肋游仆虫核糖体蛋白eS30及eL6基因系统进化树的构建
利用软件MEGA5.1进行多重序列比对, 比对结果进行了核对并通过手工进行了相应的校正。序列一部分代表了纤毛虫, 一部分代表模式动物、植物、真菌和寄生虫。用MEGA5.1软件构建系统进化树, 方法为最大似然法, 并进行1000次自展(Bootstrap)检验来评估进化树分支可信度。
2 结果
2.1 八肋游仆虫CRPs基因的鉴定
以人的CRPs序列作为参考, 通过一系列的BLAST搜索, 最终从八肋游仆虫基因组中鉴定得到98条CRPs基因序列, 对应于78种CRPs(32种小亚基核糖体蛋白和46种大亚基核糖体蛋白), 仅eL41没有找到(表 1)。考虑到eL41较短(仅75 bp), 可能在建库过程丢失, 我们设计了简并性引物进行PCR扩增,也未能获取该蛋白的DNA序列信息。在嗜热四膜虫和尖毛虫两种亲缘关系较近的纤毛虫基因组中存在编码该蛋白的基因, 所以推测八肋游仆虫中应该含有eL41。这98条微染色体均含有两端端粒, 所以可以排除线粒体核糖体蛋白基因的污染。我们对每一条RP基因序列的内含子个数、氨基酸长度、理论等电点、分子量以及所包含的结构域进行了预测(表 1)。
八肋游仆虫RPs基因根据2014年Nenad Ban等[19]提出的新的核糖体蛋白基因命名系统进行命名。Blastx结果显示Contig5394与其他生物的核糖体蛋白uS9基因同源性较高, 其C端含有保守的Ribosomal_S9结构域, 但其开放阅读框较长(共编码874个氨基酸), 跟其他生物胞质核糖体蛋白uS9相差较大, 我们将其命名为uS9-like基因。
2.2 八肋游仆虫中19种CRPs基因含有两个亚型
在八肋游仆虫78种不同的CRPs中, 有19种是由两个不同的基因编码的(表 2), 我们分别在基因名后添加后缀 “A”或者“B”来加以区分。其中 5对基因编码小亚基核糖体蛋白, 另外14对基因编码大亚基核糖体蛋白。分析这38条CRPs基因序列, 发现其蛋白编码区均不含有无义突变。转录组数据表明这些基因均具有转录活性, 部分基因有蛋白质谱数据支持, 表明这些基因能够产生蛋白产物(表2)。这些证据表明这19对核糖体蛋白基因均是有功能的, 不是假基因。基因组中CRPs基因的复制现象在其他真核生物中也有报道。如在黑腹果蝇的79种CRPs中, 有9种是由两个不同的基因编码的[1], 而在酿酒酵母中, 有59种CRPs是由两个不同的基因编码的[20]。
在19对CRPs基因中, 氨基酸序列完全一致的有7对(eS17、eS28、uL1、uL2、eL13、uL14及eL39),氨基酸序列相似度大于90%的有6对(eS6、eS7、uL15、eL21、eL33及eL34), 氨基酸序列相似度低于90%的有6对(uS11、uS19、eL24、eL29、uL30及P1), 其中eL24A与eL24B的氨基酸序列相似度最低,仅15.9%, 但二者均含有保守的Ribosomal_L24e结构域。而uL30A与uL30B的氨基酸序列相似度仅为26.2%, 其中uL30B未能检测到保守的结构域, 暗示其可能具有较高的物种特异性。

表 1 八肋游仆虫胞质核糖体蛋白基因Tab. 1 The cytoplasmic ribosomal protein genes of E. octocarinatus

续表1

续表1
此外, 我们还对这19对CRPs基因的RPKM (Reads per kilobases per millionreads)值进行了分析, 结果显示除个别基因对外, 大部分基因对中两个亚型的RPKM值有明显差异, 表明其mRNA水平明显不同。
2.3 八肋游仆虫胞质核糖体蛋白的保守性与特殊性
核糖体蛋白是一类进化上高度保守的蛋白, 某些核糖体蛋白在从低等的细菌到高等的哺乳动物中均高度保守。将八肋游仆虫与人的CRPs基因进行比较分析, 结果显示八肋游仆虫核糖体蛋白既具有高度的保守性, 同时又存在着自身的特殊性。
内含子 与高等真核生物相比, 纤毛虫基因组中内含子数目较少, 且长度较短[21]。分析八肋游仆虫CRPs基因发现, 有41个核糖体蛋白基因含有1—3个内含子, 最短的内含子仅25 bp, 最长的342 bp。内含子平均GC含量(25%)低于编码区(39%)。我们截取每条内含子5′端及3′端10 bp的序列, 分析其保守性。分析发现, 除Contig20753的第二个内含子外(其5′端剪切边界为GC), 其他内含子序列拥有统一的剪切型内含子边界(5′-GT…AG-3′), 并且在5′端含有同高等真核生物内含子一致的相似序列GTAAG。
结构域 在高等真核生物中, 有两种泛素融合核糖体蛋白(eS31和eL40)。此外, 小亚基核糖体蛋白eS30的N端融合有一个由74个氨基酸组成的类泛素(Ubiquitin-like, FUb)结构域。在八肋游仆虫中, 胞质核糖体蛋白eS31和eL40的N端含有泛素(Ubiquitin, Ub)结构域。但其eS30的N端缺失了类泛素结构域(图 1A)。之前有报道称, 在酵母, 拟南芥及顶复门的弓形虫和疟原虫中, 核糖体蛋白eS30的N端也缺失了该类泛素结构域[22]。我们进而分析了嗜热四膜虫(Tetrahymena thermophile)、浮萍棘尾虫(Stylonychia lemnae)、三棱尖毛虫(Oxytricha trifallax)、多子小瓜虫(Ichthyophthirius multifiliis)和第四双小核草履虫(Paramecium tetraurelia)的eS30序列, 发现所有纤毛虫核糖体蛋白eS30均不含有融合的类泛素结构域(图 1A)。
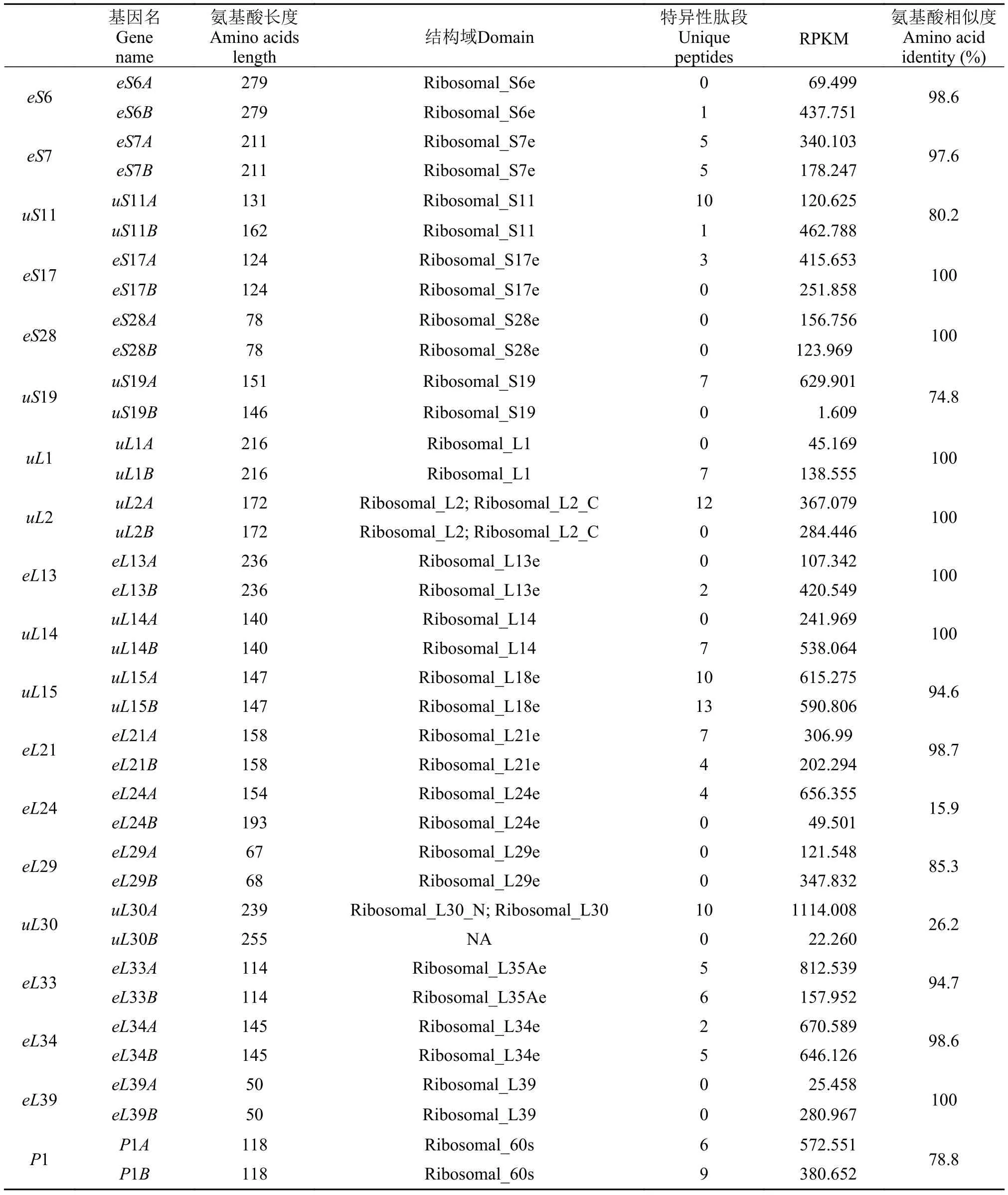
表 2 胞质核糖体蛋白基因亚型分析Tab. 2 Analysis of duplicate CRP genes
此外, 我们发现所有原生动物及部分真菌的核糖体蛋白eL6均缺少N端的Ribosomal_L6e_N结构域(图 1B)。由于目前关于核糖体蛋白eL6的研究较少, 所以对于低等真核生物中eL6N端缺失Ribosomal_L6e_N结构域可能的作用及影响尚不清楚。

图 1 不同物种核糖体蛋白eS30(A)和eL6(B)基因结构域分析Fig. 1 Domain analysis of ribosomal protein eS30 (A) and eL6 (B) genes in various species系统发育树是利用不同物种的eS30和eL6蛋白采用最大似然法构建的, 自展值以百分比的形式列于每一个节点, 各物种核糖体蛋白所包含的结构域列在右侧The domains of eS30 and eL6 are mapped onto the maximum likelihood phylogenetic tree. Bootstrap values are displayed as percentages at each tree node. The domains of ribosomal protein are shown on the right
等电点 八肋游仆虫CRPs基因的理论等电点及分子量与高等真核生物非常相似。跟人及其他生物一样, 八肋游仆虫中酸性的胞质核糖体蛋白很少: 仅有5个蛋白(uS2、eS12、P1A、P1B及P2)的等电点小于pH 7.0。与高等真核生物不同的是,真核生物酸性核糖体磷酸化蛋白uL10在八肋游仆虫中是碱性的(表 3)。进一步研究表明纤毛虫的uL10均为碱性, 而隶属于顶复门的弓形虫及疟原虫,其uL10蛋白为酸性(表 3)。这一结果与前期嗜热四膜虫中关于uL10蛋白的研究结果一致[23]。实验室前期工作表明八肋游仆虫酸性核糖体磷酸化蛋白P1A与P1B有相互作用, 但与P2均无相互作用[24], 那么特殊的uL10是否在核糖体柄状结构五聚体的形成过程中发挥重要作用, 尚需后续实验验证。

表 3 不同物种核糖体蛋白uL10的理论等电点Tab. 3 The theoretical isoelectric point of ribosomal protein uL10 in various species
3 讨论
在本研究中, 我们得到了除eL41外所有的八肋游仆虫CRPs基因的序列信息, 这是迄今为止纤毛虫中第一个对单一物种所有CRPs基因的全面分析。在八肋游仆虫基因组中, 我们预测得到98个CRPs基因序列, 对应于78个核糖体蛋白基因家族。有19种CRPs基因有两种亚型, 且两种亚型的mRNA水平有明显差异。通过与人等高等真核生物比较, 我们发现八肋游仆虫CRPs在进化上高度保守, 但某些蛋白也具有物种特异性。其中核糖体蛋白eS30缺少N端的类泛素结构域, 核糖体蛋白eL6缺少N端的Ribosomal_L6e_N结构域。另外, 八肋游仆虫的酸性核糖体磷酸化蛋白uL10不同于其他真核生物, 为碱性蛋白。
基因复制(Gene duplication)是产生新的基因的主要途径[25]。八肋游仆虫中有19种CRPs发生了复制, 这为我们后续研究基因复制后功能的分化提供了机会。尽管转录组数据表明这19对基因中两个亚型的mRNA水平差异较大, 但造成这种差异的原因及其生物学意义目前尚不清楚。在酵母中, 大部分CRPs基因都发生了复制。虽然这些CRPs蛋白序列相似度很高(~95%), 但敲除后表现出不同的表型, 暗示这些复制的核糖体蛋白基因(duplicated RPGs, dRPGs)的功能可能发生了特化[26]。dRPGs功能的差异是通过基因表达形式的变化形成的。分析无内含子的RPs基因的序列及表达模式发现,每一个dRPG的表达水平都受到特定调控序列的调控, 以此来应对变化的生长条件。dRPGs序列的均一化(Homogenization)虽然并不改变表达的基因的数量, 但降低了细胞的耐压能力。所以, 在酵母中,复制基因提供了一种调控核糖体蛋白响应压力表达的方式[27]。在黑腹果蝇中, 不同的核糖体蛋白亚型具有组织表达特异性, 如RpS5b、RpS19b及RpL10Aa仅在果蝇的生殖细胞中富集表达[1]。在后续实验中, 我们可通过检测不同时期(生长时期、饥饿时期、接合生殖时期)及不同外界压力(如热激处理, 高盐浓度处理)下dRPGs的mRNA水平, 比较分析dRPGs不同亚型启动子的强弱, 来深入研究游仆虫中dRPGs不同亚型之间的分工及生物学意义。
核糖体蛋白在进化上高度保守, 这使得我们可以利用高等真核生物的RPs序列通过同源比对, 鉴定出低等真核生物八肋游仆虫的全部RPs基因。分析结果显示八肋游仆虫RPs既具有高度的保守性,又存在着自身的特殊性。八肋游仆虫核糖体蛋白eS30和eL6N端结构域发生缺失。在高等真核生物,如人、小鼠、果蝇及线虫中, 核糖体蛋白eS30的N端含有FUb结构域, 研究显示, 在这些生物中, 存在相应的蛋白酶能够将FUb结构域切除, 所以在成熟的核糖体中, 核糖体蛋白eS30并不包含FUb结构域[28]。那么FUb结构域有何功能呢?研究人员推测FUb结构域可能在eS30的合成过程中扮演分子伴侣的角色, 以达到提高核糖体蛋白产量的目的[22,29]。核糖体蛋白除了参与核糖体组装外, 还具有重要的核糖体外功能。核糖体蛋白eL6跟人类疾病努南综合征(Noonan syndrome)有关[30]。对几种哺乳动物核糖体蛋白eL6氨基酸序列进行比对, 发现该蛋白N端部分序列差异较大, 本研究结果显示, 不同生物的核糖体蛋白eL6的N端序列明显不同, 原生动物及酵母的eL6N端缺失了Ribosomal_L6e_N结构域。由于目前关于eL6基因N端结构域功能的研究较少, 所以低等真核生物中缺失Ribosomal_L6e_N结构域的影响尚不清楚。分析八肋游仆虫和人核糖体蛋白基因eS30和eL6的基因结构(图 2)发现, 在紧挨Ribosomal_S30结构域和Ribosomal_L6e结构域的上游都有一个内含子存在, 我们推测这两个融合基因是通过外显子改组(Exon shuffling)进化而来的。
总之, 对八肋游仆虫全部CRPs基因的鉴定, 以及对它们的序列结构和基本特征的研究, 为我们深入探讨其生物学功能、核糖体的结构模型奠定了基础。

图 2 游仆虫和人核糖体蛋白基因eS30(A)和eL6(B)基因结构Fig. 2 Structures of the Euplotes and human eS30 (A) and eL6 (B) genes黑色方框代表外显子及侧翼DNA, 细线代表内含子。基因按相同比例绘制, 除了人的核糖体蛋白基因的内含子按比例缩小了一半Exons and flanking DNA are shown as black boxes, introns as fine lines. Genes are drawn to the same scale except that introns of human ribosomal protein genes are half-scale
[1]Marygold S J, Roote J, Reuter G, et al. The ribosomal protein genes and Minute loci of Drosophila melanogaster [J]. Genome Biology, 2007, 8(10): 15—26
[2]Korobeinikova A V, Garber M B, Gongadze G M. Ribosomal proteins: structure, function, and evolution [J]. Biochemistry, 2012, 77(6): 562—574
[3]Wool I G. The structure and function of eukaryotic ribosomes [J]. Annual Review of Biochemistry, 1979, (48): 719—754
[4]Kenmochi N, Kawaguchi T, Rozen S, et al. A map of 75 human ribosomal protein genes [J]. Genome Research, 1998, 8(5): 509—523
[5]Uechi T, Tanaka T, Kenmochi N. A complete map of the human ribosomal protein genes: Assignment of 80 genes to the cytogenetic map and implications for human disorders [J]. Genomics, 2001, 72(3): 223—230
[6]Planta R J, Mager W H. The list of cytoplasmic ribosomal proteins of Saccharomyces cerevisiae [J]. Yeast, 1998, 14(5): 471—477
[7]Barakat A, Szick-Miranda K, Chang I F, et al. The organization of cytoplasmic ribosomal protein genes in the Arabidopsis genome [J]. Plant Physiology, 2001, 127(2): 398—415
[8]Nakao A, Yoshihama M, Kenmochi N. RPG: the ribosomal protein gene database [J]. Nucleic Acids Research, 2004, 32(Database issue): 168—170
[9]Tan M, Brünen-Nieweler C, Heckmann K. Isolation of micronuclei from Euplotes octocarinatus and identification of an internal eliminated sequence in the micronuclear gene encoding gamma -tubulin 2 [J]. European Journal of Protistology, 1999, 35(2): 208—216
[10]Meyer F, Schmidt H J, Plümper E, et al. UGA is translated as cysteine in pheromone 3 of Euplotes octocarinatus [J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(9): 3758—3761
[11]Turanov A A, Lobanov A V, Fomenko D E, et al. Genetic code supports targeted insertion of two amino acids by one codon [J]. Science, 2009, 323(5911): 259—261
[12]Wang R, Xiong J, Wang W, et al. High frequency of +1 programmed ribosomal frameshifting in Euplotes octocarinatus [J]. Scientific Reports, 2016, (6): 21139
[13]Wang R, Zhang Z, Du J, et al. Large-scale mass spectrometry-based analysis of Euplotes octocarinatus supports the high frequency of +1 programmed ribosomal frameshift [J]. Scientific Reports, 2016, (6): 33020
[14]Altschul S F, Madden T L, Schäffer A A, et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs [J]. Nucleic Acids Research, 1997, 25(17): 3389—3402
[15]Rice P, Longden I, Bleasby A. EMBOSS: The European molecular biology open software suite [J]. Trends in Genetics Tig, 2000, 16(6): 276—277
[16]Crooks G E, Hon G, Chandonia J M, et al. WebLogo: a sequence logo generator [J]. Genome Research, 2004, 14(6): 1188—1190
[17]Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Molecular Biology & Evolution, 2011, 28(10): 2731—2739
[18]Heger A. The Pfam protein families database [J]. Nucleic Acids Research, 2012, 40(Database issue): D290—D301
[19]Ban N, Beckmann R, Cate J H, et al. A new system for naming ribosomal proteins [J]. Current Opinion in Structural Biology, 2014, 24(1): 165—169
[20]Warner J R. The economics of ribosome biosynthesis in yeast [J]. Trends in Biochemical Sciences, 1999, 24(11): 437—440
[21]Bondarenko V S, Gelfand M S. Evolution of the exon-intron structure in ciliate genomes [J]. PloS One, 2016, 11(9): e0161476
[22]Baker R T, Williamson N A, Wettenhall R E. The yeast homolog of mammalian ribosomal protein S30 is expressed from a duplicated gene without a ubiquitin-like protein fusion sequence. Evolutionary implications [J]. Journal of Biological Chemistry, 1996, 271(23): 13549—13555
[23]Pagano G J, King R S, Martin L M, et al. The unique N-terminal insert in the ribosomal protein, phosphoproteinP0, of Tetrahymena thermophila: Bioinformatic evidence for an interaction with 26S rRNA [J]. Proteins Structure Function & Bioinformatics, 2015, 83(6): 1078—1090
[24]She M, Wang R L, Zhang Z Y, et al. Ciliates Euplotes octocarinatus expresses two different sub-forms of acidic ribosomal protein P1 [J]. Chinese Journal of Biochemistry and Molecular Biology, 2015, 31(10): 1092—1101 [佘梅,王软林, 张志云, 等. 八肋游仆虫酸性核糖体磷酸化蛋白P1有2个亚型. 中国生物化学与分子生物学报, 2015, 31(10): 1092—1101]
[25]Marques A C, Vinckenbosch N, Brawand D, et al. Functional diversification of duplicate genes through subcellular adaptation of encoded proteins [J]. Genome Biology, 2008, 9(3): 1—12
[26]Komili S, Farny NG, Roth FP, et al. Functional specificity among ribosomal proteins regulates gene expression [J]. Cell, 2007, 131(3): 557—571
[27]Parenteau J, Lavoie M, Catala M, et al. Preservation of gene duplication increases the regulatory Spectrum of ribosomal protein genes and enhances growth under stress [J]. Cell Reports, 2015, 13(11): 101—123
[28]Olvera J, Wool I G. The carboxyl extension of a ubiquitin-like protein is rat ribosomal protein S30 [J]. Journal of Biological Chemistry, 1993, 268(24): 17967—17974
[29]Finley D, Bartel B, Varshavsky A. The tails of ubiquitin precursors are ribosomal proteins whose fusion to ubiquitin facilitates ribosome biogenesis [J]. Nature, 1989, 338(6214): 394—401
[30]Kenmochi N, Yoshihama M, Higa S, et al. The human ribosomal protein L6 gene in a critical region for Noonan syndrome [J]. Journal of Human Genetics, 2000, 45(5): 290—293
THE CHARACTERIZATION OF CYTOPLASMIC RIBOSOMAL PROTEIN GENES IN EUPLOTES OCTOCARINATUS
WANG Ruan-Lin, ZHAO Xue-Mei, ZHANG Zhi-Yun and LIANG Ai-Hua
(Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
Ribosome is a ribonucleoprotein complex that is composed of rRNAs and proteins, and is responsible for the synthesis of polypeptide chains in all living cells. Euplotes octocarinatus is a freshwater ciliate which possesses unique regulation of gene expression. The study of the unique features of E. octocarinatus ribosomal proteins has been hampered by the lack of available information. In this study, we performed bioinformatic approach to conduct a systematic analysis of the CRPs of E. octocarinatus. We identified 98 genes encoding 78 different CRPs. Interestingly, 19 CRP genes are present as duplicates and, while all appear to be functional, one member of each gene pair has relatively limited expression. Compared with higher eukaryotic organisms, the ribosomal proteins eS30 and eL6 of E. octocarinatus lost ubiquitin-like domain and Ribosomal_L6e_N domain, respectively. Furthermore, the uL10 of E. octocarinatus is a basic protein. Our study lay a foundation for the future understanding of the assembling and function of ribosome in lower eukaryotic organisms.
Euplotes octocarinatus; Ribosomal protein; Sequence characterization
Q344+.1
A
1000-3207(2017)03-0661-10
10.7541/2017.84
2016-10-19;
2016-12-29
国家自然科学基金(31071924和31372199)资助 [Supported by the National Natural Science Foundation of China (31071924, 31372199)]
王软林(1989—), 男, 山西临汾人; 在读博士; 主要研究方向为原生动物分子生物学。E-mail: swangrl@163.com
梁爱华(1957—), 女, 山西榆社人; 教授, 博士; 主要研究方向为分子生物学。E-mail: aliang@sxu.edu.cn
