溢流式溶出法评价药物体外缓释性能的可行性研究Δ
2017-05-16王富平吴欣桐陈忠敏重庆理工大学药学与生物工程学院重庆400054
蔡 丽,王富平,梁 敏,吴欣桐,陈忠敏(重庆理工大学药学与生物工程学院,重庆 400054)
溢流式溶出法评价药物体外缓释性能的可行性研究Δ
蔡 丽*,王富平#,梁 敏,吴欣桐,陈忠敏(重庆理工大学药学与生物工程学院,重庆 400054)
目的:研究溢流式溶出法用于评价药物体外缓释性能的可行性。方法:模拟体内药物的消除过程建立溢流式溶出法,以两个不同厂家的硝苯地平缓释片(Ⅰ)作为模型药物A、B,考察在溶出介质3种不同溢流速度(0、1.50、3.00m L/min)下模型药物在释放池中的药-时曲线、累积释放度-时间曲线和释放速度-时间曲线。结果:溶出介质溢流速度为0时,药物的累积溶出度与常规溶出法结果一致;随着溢流速度增加,释放池中药物A、B的cmax均降低[A:(8.89±0.20)、(5.21±0.04)、(3.51±0.03)µg/m L;B:(7.62±0.05)、(4.80±0.09)、(2.89±0.04)µg/m L],累积释放度均增加[A:(85.47±2.45)%、(94.29±2.44)%、(96.04±2.56)%;B:(73.28±1.13)%、(78.46±1.94)%、(82.50±1.69)%],tmax均提前(A:1.5、1.0、0.5 h;B:2.0、1.0、0.5 h)。结论:溢流式溶出法避免了释放池中药物浓度过大对药物释放的抑制,使药物释放更完全,可更准确地评价制剂的体外缓释性能。
缓释制剂;溶出法;溢流式溶出法;体外评价
缓释制剂系指用药后能在较长时间内持续释药以达到长效作用的制剂。其特点在于降低血药浓度“峰谷”波动,减轻药物对胃肠道的刺激,增加患者的依从性。缓释制剂释放遵循一级速度释放过程,即药物在体内的释放速率与该部位的血药浓度的一次方成正比。2015年版《中国药典》规定,缓释制剂释放度体外评价采用与普通制剂评价方法相同的溶出法,检测药物在缓释时间的累积溶出度[1]。该溶出体系中药物浓度随释放时间延长逐渐增加,但在药物释放后期释放速度会受到拮抗[2-3]。国际上评价缓释制剂常采用流通池法[4-5],其可分为两种:(1)循环式流通池法,该体系中药物浓度逐渐升高,溶出介质无增无减,与2015年版《中国药典》中检测药物溶出度方法结果无明显差别[6]。(2)开放式流通池法,其采用大量新鲜的溶出介质不断接触被测样品,使药物随时与新鲜溶出介质接触至溶尽为止。该释放体系中药物浓度极低,与人体内环境存在明显差异,且因加速释放药物,故难以区别同一药物不同缓释制剂的缓释性能差别[7-8]。缓释制剂维持有效浓度的持续时间与药物的吸收及消除速率息息相关,因此,建立一种高效且能反映药物在体内消除的方法,对药物进行体外释放度评价、确保缓释制剂质量具有重要意义。
本文以临床治疗高血压的代表药物硝苯地平缓释片(Ⅰ)为模型药物,基于溢流式溶出法搭建相应实验装置,采用蠕动泵控制释放池溶出介质溢流速度,检测释放池在不同时间点的药物浓度,建立释放池中药-时曲线、药物累积释放度-时间曲线、药物释放速度-时间曲线,分析模型药物缓释性能,研究溢流式溶出法用于评价药物缓释性能的可行性。
1 材料
1.1 仪器
TU-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);PJ-3片剂四用测定仪(天津市国铭医药设备有限公司);0.22µm微孔滤膜、JJ-1精密增力电动搅拌器(常州普天仪器制造有限公司);BT100-1L蠕动泵(保定兰格恒流泵有限公司)。
1.2 药品与试剂
硝苯地平对照品(中国食品药品检定研究院,批号:100338-201404,纯度:99.99%);硝苯地平缓释片(Ⅰ)(模型药物A,广东环球制药有限公司,批号:140803;模型药物B,浙江昂利康制药有限公司,批号:4T1B23;A、B规格均为10mg/片);浓盐酸、无水乙醇均为分析纯;水为一级水。
2 方法
2.1 硝苯地平的含量测定
参照2015年版《中国药典》(二部)硝苯地平片的含量测定方法[1],采用高效液相色谱法,用十八烷基硅烷键合硅胶为填充剂,甲醇-水(60∶40,V/V)为流动相,检测波长为237 nm,进样量为20µL,分别对模型药物A、B进行含量测定。
2.2 溢流式溶出法测定模型药物的释放性能
2.2.1 试验装置 参照国家食品药品监督管理局国家药品标准WS1-(X-056)-2004Z[9]对硝苯地平缓释片(Ⅰ)释放度的测定要求,设计基于溢流原理的释放度检测试验装置,示意图见图1。

图1 基于溢流原理的释放度检测装置Fig 1 Detection device for the release rate based on overflow princip le
由图1可见,以带有上、下出口的抽滤瓶为释放池,通过蠕动泵从下口添加溶出介质;释放池内配有搅拌装置,通过蠕动泵将溶出介质泵入释放池;释放过程中,已溶解药物随溶出介质从释放池的上出口溢出,可检测不同时间点释放池中的药物浓度以评价药物的释放性能。
2.2.2 检测方法 以0.1mol/L盐酸溶液900m L为溶出介质,转速为50 r/min,温度为(37±0.5)℃,结合体内血液循环特点设计溶出介质溢流流速为0、1.50、3.00 m L/m in,采用“2.2.1”项下装置进行试验,分别于0、0.25、0.5、1、1.5、2、3、4、5、6、7、8、9、10、11、12 h各取样10m L(溢流速度为0时取样后补加等量溶出介质,其余2个溢流速度取样后不补加溶出介质),取样溶液经0.22µm微孔滤膜过滤。取续滤液,以溶出介质为空白,照2015年版《中国药典》(四部)中紫外-可见分光光度法[1]在237 nm波长处测定吸光度。同一溢流流速下同种药物均取6片做平行试验,检测各取样时间点释放池中的药物浓度、累积释放度和释放速度(单位时间释放量),绘制上述指标与取样时间的曲线图,分析不同溢流条件下样品的释放特性。
2.2.3 数据处理相关公式 药物累积释放度(Q)和释放速度(v)的计算公式如下:

公式(1)中,Q:药物累积释放度(%);cn:第n次取样时间时释放池中的药物质量浓度(µg/m L);L:模型药物标示量(本文为10 mg);V1:各时间点固定取样体积(m L);V2:溶出介质体积(m L)。

公式(2)中,vn:第n-1次至第n次取样时的平均药物释放速度(µg/m in);tn:第n次取样的时间(min);tn-1:第n-1次取样的时间(min)。

公式(3)中,Mn:第n次取样时释放池中药物的质量(mg)。

公式(4)中,M溢n:第n次取样时溢流药量总质量(mg);Mi:第i次取样时溢流药物质量(mg);M回n:第n次取样时回收池中药物质量(mg);ci:第i次取样时释放池中的药物质量浓度(µg/m L);c回n:第n次取样时回收池中的药物质量浓度(µg/m L);V回n:第n次取样时回收池中药物体积(m L)。
3 结果
3.1 模型药物A、B的含量
模型药物A、B的标示量均为10mg,经检测其中硝苯地平含量分别为标示量的(105.05±0.28)%和(87.59±1.83)%(n=6)。
3.2 释放池中药-时曲线
结果显示,溢流速度为0时由于释放池始终处于封闭状态,与常规溶出度法相同,模型药物A、B释放7 h后释放池中的药物浓度分别为(8.42±0.25)、(7.46±0.04)µg/m L,此后增加缓慢,直到药物释放完全,tmax分别为11、10 h,cmax分别为(8.89±0.20)、(7.62±0.05)µg/m L。随着溶出介质溢流速度的增加,释放池中药-时曲线峰形变窄,释放池中药物的cmax降低,模型药物A、B在1.50m L/m in下cmax分别为(5.21±0.04)、(4.80±0.09)µg/m L,3.00 m L/m in下cmax分别为(3.51±0.03)、(2.89±0.04)µg/m L;相同时刻同一药物在释放池中的药物浓度相应减小,使释放池药-时曲线呈先上升后下降趋势(峰形),此曲线与硝苯地平在体内的药物代谢曲线形状[10]相似,能更准确地揭示药物的体内释放特性。不同溢流速度下模型药物在释放池中的药-时曲线见图2。

图2 不同溢流速度下模型药物在释放池中的药-时曲线(n=6)Fig 2 Concentration-tim e curves ofm odel drug at differentoverflow velocity in release pool(n=6)
3.3 累积释放度-时间曲线
结果显示,溢流速度为0时模型药物A、B的累积释放度分别为(85.47±2.45)%、(73.28±1.13)%,与常规溶出法测得的结果[11]相当。当溢流速度增加为1.50 m L/m in时,药物A、B的累积释放度分别为(94.29± 2.44)%、(78.46±1.94)%;溢流速度增加为3.00m L/m in时,累积释放度分别为(96.04±2.56)%、(82.50± 1.69)%。与溢流速度为0比较,溶出介质的溢流速度增加可使药物累积释放度明显增加(P<0.05)。由此可见,常规溶出法评价药物释放性能时,药物的后期释放受到了溶出介质中累积的高药物浓度的抑制。而溢流式溶出法通过溢流使释放池中药物浓度降低,可提高药物的累积释放度,更加符合机体内药物的代谢过程。不同溢流速度下模型药物的累积释放度-时间曲线见图3。

图3 不同溢流速度下模型药物的累积释放度-时间曲线(n=6)Fig 3 Cumulative release rate-time curves of model drug atdifferentoverflow velocity(n=6)
3.4 释放速度-时间曲线
结果显示,随着溶出介质溢流速度的增加,药物释放速度的达峰时间提前,在0、1.50、3.00m L/min下模型药物A的tmax分别为1.5、1.0、0.5 h,释放速度峰值分别为(33.37±2.52)、(38.04±2.08)、(38.73±1.60)µg/m in;模型药物B的tmax分别为2.0、1.0、0.5 h,释放速度峰值分别为(36.52±2.69)、(38.18±2.46)、(57.55±3.07)µg/m in。此外,随着溢流速度的增加,曲线峰形变窄,表明溶出介质的溢流速度增加可加速药物溶出,使药物在释放初期快速释放达到有效浓度,更能模拟血液循环对药物释放的影响。不同溢流速度下模型药物的释放速度-时间曲线见图4。
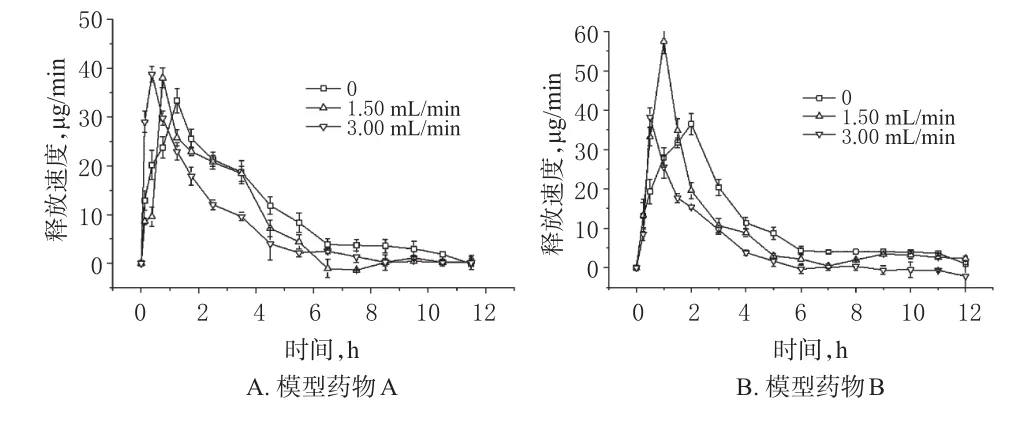
图4 不同溢流速度下模型药物的释放速度-时间曲线(n=6)Fig 4 Release speed-time curves ofmodel drug at differentoverflow velocity(n=6)
4 讨论
药物缓释制剂要求在药物释放初期尽快达到有效血药浓度,此后释放总量趋于稳定,即药物有效作用时间长。在药物释放初期,药片表面存在包衣结构阻碍;随后由于包衣结构的破坏,药物与释放环境接触面积增大,药物释放速度会迅速提高;而药片溶解到后期,药片体积与释放环境接触面积越来越小,释放速度将越来越小。
根据Noyes-Whitney方程,固体药物的溶出速度主要受扩散控制,用溶出法评价药物释放时,在药物释放后期,释放池因药物浓度的升高而限制药物扩散,会影响后期药物溶出,这一点在溢流式溶出法中得以证明。另外,在药物释放前期,体系浓度较低,应接近漏槽条件,不会影响药物释放。但是在溢流式溶出法中,随溢流速度的增加,释放速度曲线达峰时间却在提前;而溢流速度增加,释放池中药物浓度下降。这表明溶出法中,在释放初期同样存在药物释放抑制,这可能与释放池主体浓度变化快、固体表面饱和层可较快扩散到释放池主体中有关。
在具有一定溢流速度的溢流式溶出法中,溢流带走部分药物,类似于人体药物消除;药-时曲线呈峰形,与人体血药浓度变化相似。与常规溶出法相比,溢流式溶出法的累积释放度和药物释放速度及达峰时间更接近于体内释放环境;与流通池法相比,本文检测装置药物释放处于一定的药物浓度条件下,而非完全漏槽条件,更接近体内生理环境。因此,溢流式溶出法用于评价缓释制剂体外释放更准确。
[1] 国家药典委员会.中华人民共和国药典:二部[S].2015年版.北京:中国医药科技出版社,2015:38-39、1286-1287.
[2] ShergillM,PatalM,Khan S,etal.Developmentand characterisation of sustained release solid dispersion oral tablets containing the poorly water soluble drug disulfiram[J]. Int JPharm,2016,497(1/2):3-11.
[3] Gao Y,Gao Y,Yin F,etal.Preparation and pharmacokinetics study on gastro-floating sustained-release tablets of troxipide[J].Drug Dev Ind Pharm,2015,41(9):1443-1451.
[4] 李茜茜,邹玲玲,黄雪丽,等.流通池法测定替硝唑阴道泡腾片的溶出度[J].中国药房,2014,25(32):3059-3063.
[5] Dorozynski PP,Kulinowski P,Mendy A,etal.Novel application of MRI technique combined w ith flow-through cell dissolution apparatus as supportive discrim inatory test for evaluation of controlled release formulations[J].AAPS PharmSciTech,2010,11(2):588-597.
[6] Medina JR,Padilla AR,Hurtado M,etal.In vitro release of ketoprofen suppositories using the USP basket and the flow-through cell dissolution methods[J].Pak J Pharm Sci,2014,27(3):453-458.
[7] Medina JR,Salazar DK,Hurtado M,etal.Comparative in vitro dissolution study of carbamazepine immediate-release products using the USP paddles method and the flow-through cellsystem[J].SaudiPharm J,2014,22(2):141-147.
[8] Seidlitz A,WeitschiesW.In-vitro dissolutionmethods for controlled release parenterals and their applicability to drug-eluting stent testing[J].JPharm Pharmacol,2012,64(7):969-985.
[9] 国家食品药品监督管理局.硝苯地平缓释片(Ⅰ)WS1-(X-056)-2004Z[S].2005-06-06.
[10] Ilic M,Kovacevic I,Parojcic J.Deciphering nifedipine in vivo delivery from modified release dosage forms:identification of food effect[J].Acta Pharm,2015,65(4):427-441.
[11] 叶俊鹏,吴爱琴,黄培良,等.硝苯地平缓释片及控释片的体外释放度试验[J].广东药学,2003,13(5):25-26.
Study on the Feasibility of Evaluating Drug in vitro Sustained Release Performance by Overflow Dissolution M ethod
CAI Li,WANG Fuping,LIANG M in,WU Xintong,CHEN Zhongm in(School of Pharmacy and Biological Engineering,Chongqing University of Technology,Chongqing 400054,China)
OBJECTIVE:To study the feasibility of overflow dissolution method for evaluating the drug in vitro sustained release performance.METHODS:Overflow dissolution method was established by simulating the drugs elimination in vivo.Using Nifedipine sustained-elease tablets(Ⅰ)from 2 differentmanufacturers asmodel drug A,B,concentration-time curve,cumulative release rate-time curve,release velocity-time curve of model drugs in release pool at 3 different overflow speed(0,1.50,3.00 m L/m in)were investigated.RESULTS:When overflow speed was 0,the cumulative dissolution was consistentw ith that of the conventional dissolution method.As the overflow speed increased,cmaxof drug A,B was decreased[A:(8.89±0.20),(5.21±0.04),(3.51±0.03)µg/m L;B:(7.62±0.05),(4.80±0.09),(2.89±0.04)µg/m L];cumulative release rate was increased[A:(85.47± 2.45)%,(94.29±2.44)%,(96.04±2.56)%;B:(73.28±1.13)%,(78.46±1.94)%,(82.50±1.69)%];tmaxwas ahead(A:1.5,1.0,0.5 h;B:2.0,1.0,0.5 h).CONCLUSIONS:Overflow dissolution method has avoided the inhibition of too large drug concentration on drug release,making complete drug release and more accurate evaluation of in vivo sustained release performance of the preparation.
Sustained-release preparation;Dissolutionmethod;Overflow dissolutionmethod;in vitro evaluation
R969
A
1001-0408(2017)13-1827-04
2016-08-08
2016-12-08)
(编辑:邹丽娟)
重庆市教委科学技术研究项目(No.KJ1400916);重庆市基础与前沿研究计划项目(No.csct2014jcyja10018)
*硕士研究生。研究方向:药物设计与合成。E-mail:851702462 @qq.com
#通信作者:讲师,博士。研究方向:生物材料。E-mail:wangfp2013@cqut.edu.cn
DOI10.6039/j.issn.1001-0408.2017.13.28
