借鉴电子通信行业经验探讨制药行业专利标准化的实施路径Δ
2017-05-16陈晓雨李莹辉李红玉兰州大学药学院兰州730000兰州大学生物医药知识产权研究中心兰州730000
陈晓雨,李 洋,李莹辉,赵 晶,李红玉#(1.兰州大学药学院,兰州 730000;2.兰州大学生物医药知识产权研究中心,兰州 730000)
·药业专论·
借鉴电子通信行业经验探讨制药行业专利标准化的实施路径Δ
陈晓雨1,2*,李 洋1,2,李莹辉1,2,赵 晶1,2,李红玉1,2#(1.兰州大学药学院,兰州 730000;2.兰州大学生物医药知识产权研究中心,兰州 730000)
目的:为制定制药行业专利标准化实施路径提供参考。方法:针对制药行业专利标准化尚处于探索阶段、缺乏可行经验的现状,借鉴电子通信行业中专利领先于标准制定、权威组织帮助实施专利标准化、行业联盟推动专利标准化发展等经验,结合标准的发展周期,尝试制定出符合制药行业特点的专利标准化实施路径。结果与结论:制药行业的专利标准化实施路径分为标准形成、推广、升级阶段,各阶段的主要路径分别为由专利开始至药品注册标准正式形成、以国家食品药品监督管理总局的政策法规为导向通过药品仿制进行标准推广、通过专利替换来升级药品标准。
制药行业;电子通信行业;专利标准化;实施路径
在技术密集型的高新技术行业中,技术成果的转化路径可总结为“技术专利化,专利标准化,标准许可化”[1]。其中,“技术专利化”是基础,即将技术创新成果通过专利申请的方式进行保护;“专利标准化”是过程,指将专利技术嵌入标准;“标准许可化”是目的,即对嵌入标准的专利进行许可。专利标准化对于技术密集型的高新技术行业而言是一条必经之路。在制药行业实施专利标准化是否更有利于促进行业发展,同时,在我国制药行业的标准制定遵循严格的行政审批制度的前提下[2],如何将专利融入到标准中,既通过专利保护给研发企业带来收益,提升企业技术创新的积极性,又通过标准的制定提升药品质量与安全性,以更大范围地惠及患者,是一个值得深思的问题。
在专利标准化方面走在前列的是电子通信行业。早在20世纪90年代,电子通信行业就已出现标准技术涉及专利的情况,专利的融入对提升标准技术质量意义重大,如何实施专利标准化成为众多学者的研究重点[3]。发展至今,该行业已积累了丰富经验。由于制药行业与电子通信行业在高技术含量与产品标准上具有相通性,对电子通信行业专利标准化经验的研究借鉴,有助于制药行业找到适合自身的实施路径。因此,本文针对制药行业专利标准化尚处于探索阶段、缺乏可行经验的现状,借鉴电子通信行业专利标准化的经验,结合标准的发展周期,尝试制定出符合制药行业特点的专利标准化实施路径,为制定制药行业专利标准化实施路径提供参考。
1 制药行业实施专利标准化的重要意义
根据《药品注册管理办法》第一百三十六条的规定:国家药品标准是指国家食品药品监督管理总局(以下简称“药监局”)颁布的《中华人民共和国药典》(以下简称《药典》)、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。其中,《药典》是由国家药典委员会根据《中华人民共和国药品管理法》的规定组织编纂的法定的国家药品标准;药品注册标准是指药监局批准给申请人特定药品的标准,生产该药品的药品生产企业必须执行该注册标准;而其他药品标准一般主要指《中华人民共和国卫生部药品标准》,由药监局编纂并颁布实施的,过去被称为“部颁药品标准”[4]。
专利标准化即将专利技术嵌入标准,其是实现“技术专利化”到“标准许可化”的桥梁[5],在制药行业的实际应用中具有重要意义。首先,实施药品专利标准化可以维持企业的垄断利润。不包含专利的药品标准不具有排他性和限制性,当其他企业对该类药品进行仿制生产时,会分割原研企业的市场,威胁原研企业的垄断利润[6]。将专利融入标准,是原研企业保护创新成果、维护自身利益的重要手段。同时,由于药品标准只能由原始标准的制定企业进行修改或提升,因此,企业可以通过将后续改进的专利技术融入到药品标准中的方式提升标准的质量,进一步帮助企业掌握产品研发的主动权,限制竞争对手,获取持续收益。其次,实施药品专利标准化可有效延长药品专利的保护期限,为企业获取长期利润。在制药行业中,由于新药的研发和行政审批时间长达5~12年,因此当药品的核心专利过期失效,而外围专利又不足以保证制药企业的垄断地位时,会导致药品研发企业落入“专利悬崖”困境之中[7],使收益大幅度地减少。如果能通过专利标准化的方式将药品的外围专利引入到药品生产的强制标准中,就能延长药品的专利保护期,保证制药企业的长期收益。
2 制药行业实施专利标准化的困境
尽管在制药行业推行专利标准化前景广阔,但现实的实施过程并不顺利。目前药品专利的标准化仍处于摸索阶段,究其原因,主要有以下两方面:(1)制药行业作为民生行业,兼具传统与高新两方面特质。尽管技术密集,但大多数制药企业仍将技术秘密和专利作为保护知识产权的主要方式,对专利标准化这种新兴的知识产权保护方式并不熟悉,也对专利和标准融合后可能带来的垄断收益缺乏认识,因此对推行专利标准化并无主观意愿。(2)由于专利标准化在制药行业的发展还处于萌芽阶段,制药企业缺乏可借鉴的经验和操作流程。即使有企业遇到专利和标准融合的问题,也没有前例可循,专利标准化缺乏实际操作性,仅停留在理论层面,不能为制药企业所接受。
这些问题产生的根本原因是企业缺乏符合制药企业专利标准化的实施路径,如果单纯依靠企业自身的摸索,收效甚微。电子通信行业作为全面、系统地实施专利标准化的技术密集型行业,其经验对制药行业走出专利标准化实施力不足的困境具有重要借鉴意义。
3 电子通信行业专利标准化的经验借鉴
3.1 专利领先于标准制定
技术领先于标准即通过技术领先优势拉高标准的门槛。其中,技术的领先性主要通过专利来体现。
传统的技术标准由于包含的专利技术较少,通常主张“产品制定”的策略[8],即在产品较为成熟之后才制定标准。电子通信行业作为技术密集型行业,其技术发展一般要领先于标准制定。在产品成熟之前,企业首先布局大量专利,再以此为基础制定标准,大幅度提升标准中的技术含量。这一举措不仅提升了技术门槛,也掌握了行业的主动权。
对于制药企业而言,“专利先行”的策略同样具备优势。药品有着严格的行政审批制度,根据《新药审批办法》规定,新药经批准后,其质量标准为试行标准。批准为试生产的新药,其标准试行期为3年,其他新药的标准试行期为2年。试行期满前3个月,生产单位需要提出转正申请,经有关部门审查批准后,转为正式标准,正式标准适用于所有生产同一类药品的制药企业。在上述质量标准的制定过程中,就可以将企业专利融入标准,实施专利标准化。先专利后标准的技术流程同样适用于制药行业,并且,由于药品的质量标准只能由新药注册企业提出变更,因此,注册企业可以在基本专利的基础上,进一步布局后续专利,并通过将后续专利融入标准的方式以升级标准,获得更长的市场独占期。
3.2 权威组织帮助实施专利标准化
权威组织即指与本行业有关的具有权威性的组织机构,通过这些机构的法规制定、政策导向,可以从不同方面帮助专利标准化实施。
对于电子通信行业而言,权威组织的作用主要在于规定标准的强制性,从而帮助推行含有专利的标准。由于专利具有垄断的特性,企业往往对含有专利的标准持排斥态度,如果仅仅通过标准制定者自己推行专利标准化,则很难获得其他企业的接受和认可;但是,如果标准申请人与权威机构进行沟通,以获取这些机构对标准的认可,就可凭借国家标准的强制性推行其技术标准。例如,中国信息产业部要求从2007年6月14日起强制性使用手机充电器强制标准“YD/T 1591-2006”[9]。
对于制药行业而言,由于药品标准均属强制性标准,因此,权威组织的作用与电子通信行业有所区别,主要体现在指导企业如何制定包含专利的标准。药监局作为制药行业最主要的权威组织,负责所有上市药品的申请审批和质量标准审批。药监局通过为标准必要专利的引入提供指导原则来帮助企业制定含有专利的药品标准,这些政策主要体现在《药品注册管理办法》(以下简称《办法》)第十八条和第十九条。《办法》第十八条主要确定了专利充分公开原则和药监局不介入专利纠纷的原则;《办法》第十九条则确定了专利期满前2年,药监局可以就非专利权人的注册申请进行行政审批。可以看出,作为权威组织的药监局对企业在标准制定中可能遇到的专利问题进行了明确规定,而企业通过研究上述法规可以更有针对性地进行专利标准化工作。
3.3 行业联盟推动专利标准化发展
行业联盟是由同一行业不同企业组成的利益共同体,对于技术存在交叉性的行业而言意义重大,通过联盟的共同推行,专利标准化的实施力更强。
对于电子通信行业而言,基于标准的行业联盟是较为常见的组织。电子通信行业技术密集,不同技术之间相互关联,如果企业独立运作,非常容易发生专利纠纷,引发专利大战;如果企业将自有专利汇集成专利池,并据此结为行业联盟[10],根据专利池制定行业标准,则可以化劣势为优势,对内交叉许可,对外授权许可,实现利益最大化。
而在制药行业中,由于药品的特殊性质,决定制药行业无法就药品标准形成行业联盟。首先,制药行业不同于电子通信行业,一家制药企业只要掌握保护药品结构、组成和应用的基本专利,即可控制该药品的整个生产销售环节,产业联盟的形成反而会分散企业的独占收益;其次,根据我国的标准分类,药品标准均属于强制性标准,标准的制定权掌握在一家或几家参与药品注册的企业手中,其他企业是没有机会参与到标准制定环节中,因此不存在形成标准联盟的可能性。因此,企业必须凭借自身的力量实施药品专利的标准化。
4 制药行业实施专利标准化的路径
通过上述分析可以看出,电子通信行业在实施专利标准化方面的经验可以为制药行业提供一定借鉴。将这些经验与制药行业专利标准化的步骤相结合,尝试制定出符合制药行业特点的专利标准化实施路径,见图1。
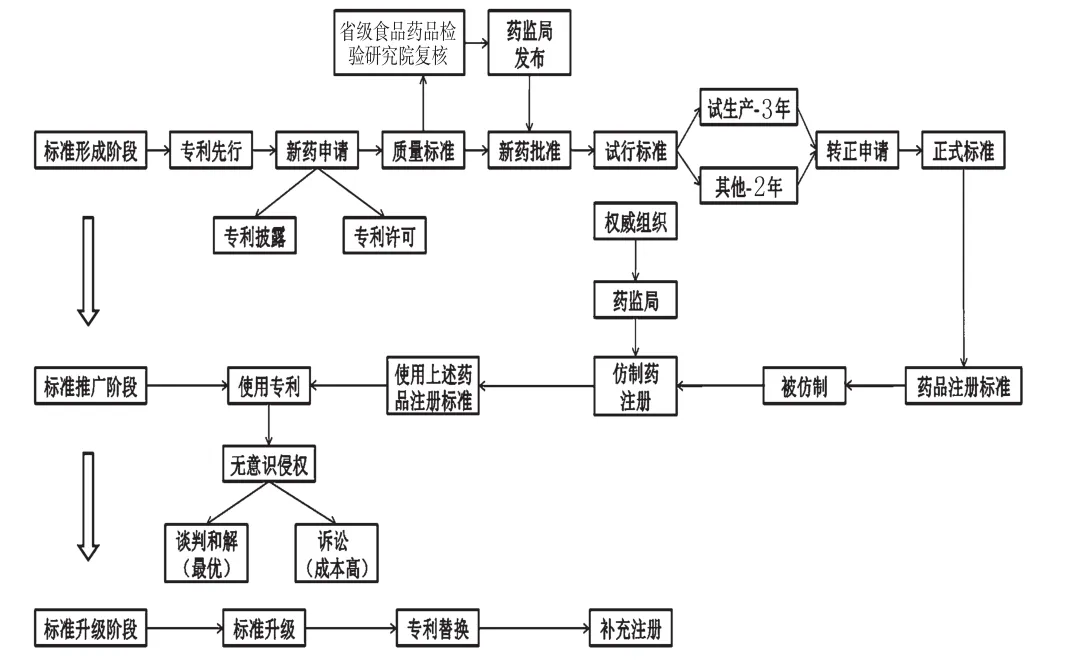
图1 制药行业专利标准化实施路径Fig 1 The im plementation path of patent standardization in the pharmaceutical industry
根据标准的发展周期,将制药行业的专利标准化实施路径分为3个阶段,分别为标准形成阶段、标准推广阶段、标准升级阶段。
4.1 标准形成阶段
以“专利先行”为基础,这一阶段的专利标准化路径由专利开始,至药品注册标准正式形成。
企业实施专利标准化的第一步是“技术专利化”,即拥有自己的专利,因此“专利先行”是制药企业实施专利标准化的基础。备选专利可涉及质量指标、检验方法、生产工艺等,还可包括药品标准物质,如标准品、对照品、对照药材等。第二步是“专利标准化”,即注册包含专利的药品注册标准。根据《办法》规定:药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请,其中,新标准的形成主要通过新药注册申请实现。首先,制药企业需要根据申报新药的要求提交药品质量标准,由企业所在省级食品药品检验研究院对申报新药的质量标准(草案)进行技术复核修订,合格者由药监局进行公布,获得新药批准。该新药质量标准即成为试行标准,其中,批准为试生产的新药,其标准试行期为3年,其他新药的标准试行期为2年。生产单位必须在新药的试行质量标准期满前3个月,向省级食品药品监督管理局药品注册处提出转正申请,新药质量标准转正技术审查工作由国家药典委员会负责,实验室技术复核由省级食品药品检验研究院负责。最后,转正后的药品质量标准即成为药品注册标准,由药监局予以公布,标准正式形成[11]。
在标准形成阶段,专利标准化的主要手段是由标准申请人将专利融入质量标准并获得批准。其中涉及到最主要的问题是专利披露,标准申请人需要在药品注册申请中写明该专利,并公开其内容;同时,使用这些被披露的专利应该获得专利权人的许可,即不存在专利侵权风险。因此,制药企业应掌握《国家标准涉及专利的管理规定》对专利实施许可声明的相关规定,专利权人或者专利申请人同意在公平、合理、无歧视基础上,免费许可或者收费许可组织或者个人在实施该国家标准时实施其专利[12]。因此,药品标准的标准申请人应当与药品专利的专利权人进行沟通,获得相关专利的专利实施许可声明。
4.2 标准推广阶段
以药监局的政策法规为导向,这一阶段的专利标准化路径为通过药品仿制进行标准推广。
新药上市进入销售阶段,会陆续出现仿制企业。企业进行仿制药的生产销售同样需要向药监局递交药品注册申请,由于生产同一药品的企业必须使用统一的药品质量标准,该药品标准即可通过仿制药生产进行推广应用[13]。在这一步骤中,应充分掌握药监局的政策法规,根据现行《办法》,申请人需要对药品质量标准涉及的专利进行全面披露。同时,由于药监局对标准中涉及的专利仅进行公开监督,不对其涉及的纠纷进行调解,因此,仿制药企业在申请含有专利的标准时,就会面临专利侵权的问题[14]。
目前,解决标准专利侵权纠纷主要有和解和诉讼两条途径。①和解:如果仿制药企业的药品注册尚未通过,则被侵权的原研药企业可能向药监局提起申请,申请驳回仿制药企业的药品注册。此时,仿制药企业可通过与原研药企业进行谈判,达成许可。②诉讼:被侵权的原研药企业也可能直接向法院提起侵权诉讼。相较而言,和解花费的时间成本和经济成本远低于诉讼。因此,仿制药企业应争取同原研药企业达成和解,获得专利许可。
4.3 标准升级阶段
这一阶段的专利标准化路径为通过专利替换来升级药品标准。
当标准专利即将到期或者专利技术已经落后时,制药企业可以采用替换专利的方式来提升标准,此阶段仍然是以“专利先行”为基础,通过专利技术升级实现药品标准的升级。
根据我国药品管理的相关办法,只有制定标准的制药企业才有资格改变、增加或者取消原批准事项或者内容的注册申请[15]。标准升级可以延长标准执行的期限。制药企业可以在保证标准主体不变的情况下,通过对其中涉及的专利技术进行升级,用新专利替代旧专利,借此提高标准门槛,保证制药企业获得长期利润。
5 结语
专利标准化是专利与标准相结合的产物,其弥补了标准化实施过程中企业因对知识产权保护不当造成的损失,在给企业带来收益的同时,还可激发其研发动力,促进技术创新。制药行业作为民生行业,其发展与民生健康息息相关,需要更加严格、规范的运行机制。在制药行业推行专利标准化,既可以通过专利保护给研发企业带来收益,提升企业技术创新的积极性,又可以通过标准的制定提升药品质量与安全性,以更大范围地惠及患者,是一项双赢的举措。
[1] 孙伟超.专利与技术标准融合中的反垄断问题研究[D].大连:大连海事大学,2010.
[2] 彭军.我国药品标准管理现状研究[J].医药卫生(文摘版),2016(13):176.
[3] 周丽惠.我国通信技术标准化中的专利权问题研究:以标准与专利的冲突为视角[D].武汉:华中科技大学,2012.
[4] 于娜,邵蓉.我国药品标准管理研究现状分析[J].西北药学杂志,2010,25(2):139-140.
[5] 泮通天.标准组织知识产权策略分析:必要专利和技术标准的均衡[J].中国科技资源导刊,2016,48(2):21-26、43.
[6] 陈敬,史录文.与药品有关的超出《与贸易有关的知识产权协议》保护条款的介绍与反思[J].中国药房,2017,28(4):442-445.
[7] 刘友华,隆瑾,徐敏.“专利悬崖”背景下制药业的危机及我国的应对[J].湘潭大学学报(哲学社会科学版),2015,39(6):80-84.
[8] 陈江红.浅谈企业如何挖掘专利和进行专利布局[J].科研,2015(12):20-21.
[9] 王加莹.专利布局和标准运营:全球化环境下企业的创新突围之道[M].北京:知识产权出版社,2014:132-133.
[10] 姚远.技术标准下的专利联盟形成机理研究[D].合肥:中国科学技术大学,2010.
[11] 董浩,梁毅.我国小核酸药物研发与注册的相关问题研究[J].中国药房,2016,27(7):876-878.
[12] 尹秀峰,王东.议专利保护双轨制与专利行政管理定位[J].科研,2015(10):142-143.
[13] 孟欣,宋跃晋.我国仿制药发展的SWOT分析[J].中国药房,2016,27(28):3889-3892.
[14] 张崖冰,胡善联,彭颖,等.国内专利后原研药及其仿制药的现状研究[J].中国卫生经济,2013,32(6):21-23.
[15] 田洁,张哲峰.补充申请修订药品注册标准常见问题分析[J].中国新药杂志,2014,23(10):1118-1121.
Exploration of the Im plementation Path of Patent Standardization in Pharmaceutical Industry by Learning from the Experience of Electronic Communication Industry
CHEN Xiaoyu1,2,LIYang1,2,LIYinghui1,2,ZHAO Jing1,2,LIHongyu1,2(1.School of Pharmacy,Lanzhou University,Lanzhou 730000,China;2.Intellectual Property Research Center of Biological Medicine,Lanzhou University,Lanzhou 730000,China)
OBJECTIVE:To provide reference for developing the implementation path of patent standardization for pharmaceutical industry.METHODS:For the situation that pharmaceutical industry is still in the exploratory stage and lacks of viable experience,the mature experiences of electronic communication industry in patent leading standardization implementation,authoritative organizations helping implementing patent standardization and industry alliance to promote the development of patent standardization were used as reference,combining w ith standard development cycle,trying to develop the implementation path of patent standardization thatmet characteristics of pharmaceutical industry.RESULTS&CONCLUSIONS:The implementation path of patent standardization for pharmaceutical industry was divided into standard formation stage,promotion stage and upgrade stage.Themain path in each stage was from patent to registration standards officially formed,guiding by policies and regulations of Food and Drug Administration to conduct standard promote by drug generation,and upgrading the drug standard by patent replacement.
Pharmaceutical industry;Electronic communication industry;Patent standardization;Implementation path
R95
A
1001-0408(2017)13-1729-04
2016-08-04
2017-03-29)
(编辑:余庆华)
工业和信息化部知识产权推进计划(No. 2014020001)
*硕士。研究方向:药物知识产权。E-mail:1126487342@qq.com
#通信作者:教授,博士生导师,博士。研究方向:生物医药及其知识产权。E-mail:lihy@lzu.edu.cn
DOI10.6039/j.issn.1001-0408.2017.13.01
