丹参酮对人工关节无菌性松动小鼠气囊模型中炎症反应的影响
2017-05-16赖笑雨陈金财刘训志赣南医学院第一附属医院骨科江西赣州34000赣南医学院江西赣州34000
赖笑雨,陈金财,刘训志,高 辉,何 澄#(.赣南医学院第一附属医院骨科,江西赣州 34000;.赣南医学院,江西赣州 34000)
丹参酮对人工关节无菌性松动小鼠气囊模型中炎症反应的影响
赖笑雨1*,陈金财2,刘训志1,高 辉1,何 澄1#(1.赣南医学院第一附属医院骨科,江西赣州 341000;2.赣南医学院,江西赣州 341000)
目的:研究丹参酮对人工关节无菌性松动小鼠气囊模型中炎症反应的影响。方法:将小鼠随机分为空白对照组(生理盐水)、钛颗粒组(生理盐水)和丹参酮低、中、高剂量组(50、100、200mg/kg),每组10只。所有小鼠建立气囊模型,除空白对照组小鼠气囊内注入0.5m L生理盐水外,其余各组小鼠气囊内均注入0.5m L钛颗粒悬液(10mg/m L),24 h后按0.1m L/10 g连续ig相应药物14 d。末次给药24 h后收集气囊,肉眼和苏木精-伊红染色显微镜观察气囊炎症情况,计算炎症细胞密度;实时定量聚合酶链式反应法检测气囊组织中肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)mRNA表达量;酶联免疫吸附法检测气囊组织中TNF-α、IL-1β蛋白表达量。结果:与空白对照组比较,钛颗粒组小鼠气囊红肿明显,可见较多渗出及新生血管,炎症反应严重,炎症细胞密度明显增加(P<0.05);TNF-α、IL-1βmRNA及蛋白表达明显增强(P<0.05)。与钛颗粒组比较,丹参酮各剂量组小鼠气囊红肿减轻,渗出及新生血管减少,炎症反应减轻,炎症细胞密度明显减小(P<0.05);TNF-α、IL-1βmRNA及蛋白表达明显减弱(P<0.05),且呈剂量依赖性。结论:丹参酮可有效抑制人工关节无菌性松动小鼠气囊模型中的无菌性炎症反应。
丹参酮;无菌性松动;气囊模型;炎性因子;小鼠
人工关节置换术是治疗各种终末期关节病变的最后保障,其能有效减轻患者疼痛,维持关节功能。然而,随着使用年限的增加,人工关节的磨损颗粒会释放进入关节腔隙及周围滑膜组织,可引起无菌性炎症和骨溶解,最终导致假体松动[1]。丹参酮是一种治疗冠心病的药物,能通过抑制炎症因子的释放有效缓解心绞痛[2]。除此之外,丹参酮还能促进成骨细胞增殖、提高骨密度来抑制骨吸收[3]。因此,本文研究了丹参酮对人工关节无菌性松动小鼠气囊(Air-pouch)模型中炎症反应的影响,以期为其用于改善人工关节无菌性松动提供参考。
1 材料
1.1 仪器与软件
Aiprism 7300型定量聚合酶链式反应(RT-PCR)仪(美国ABI公司);TGL-16M型离心机(金坛市恒丰仪器厂);光学显微镜(日本Olympus公司);Simple PCI6.0图像分析软件(美国C-imaging公司)。
1.2 药品与试剂
丹参酮对照品(中国食品药品检定研究院,批号:110867-200406,纯度:99.5%);内毒素定量检测试剂盒(厦门鲎试剂有限公司,批号:CE32545);钛颗粒(美国Zimmer公司,批号:YFM 11-U1);肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)酶联免疫吸附(ELISA)试剂盒(上海船夫生物科技有限公司);Trizol试剂(美国Invitrogen公司);反转录试剂盒(美国Fermentas公司);DNA marker(北京天为时代科技有限公司);Taq DNA聚合酶、脱氧核苷酸三磷酸(dNTPs)和引物(上海生物工程有限公司)。
1.3 动物
50只清洁级昆明种小鼠,♂,10~12周龄,体质量25~30 g,由赣南医学院提供,购于湖南中医药大学,动物许可证号:SCXK(湘)2015-0002,饲养于赣南医学院实验动物中心。对动物的所有处置均符合2006年科学技术部发布的《关于善待实验动物的指导性意见》相关要求。
2 方法
2.1 钛颗粒悬液的制备
将钛颗粒置于干燥箱中,180℃下干燥6 h,加入75%乙醇浸泡过夜,6 000 r/m in(离心半径15 cm)离心2 min,弃去上层,再用生理盐水反复冲洗、离心(离心条件同上)3次,采用内毒素定量检测试剂盒检测钛颗粒中内毒素指标合格(<0.1 EU/m L)后,制备成10mg/m L钛颗粒悬液,备用。
2.2 小鼠气囊模型的建立
取小鼠,选背部正中线上离尾巴根部2 cm处为进针点,消毒后sc 3m L无菌空气建立初始气囊,然后每隔1 d sc 1m L无菌空气至第5天,第6天观察注射部位若无炎症反应,即表示气囊模型建立成功。
2.3 分组与给药
将小鼠随机分为空白对照组(生理盐水)、钛颗粒组(生理盐水)和丹参酮低、中、高剂量组(50、100、200 mg/kg),每组10只。所有小鼠建立气囊模型,除空白对照组小鼠气囊内注入0.5m L生理盐水外,其余各组小鼠气囊内均注入3m L钛颗粒悬液,24 h后按0.1m L/10 g连续ig相应药物14 d。由于人工关节无菌性松动的病理过程与骨质丢失有关,因此给药剂量参考文献[4]中的剂量设立。
2.4 指标检测
2.4.1 肉眼观察气囊 末次给药24 h后,切开小鼠背部皮肤,观察气囊周围结缔组织变化情况,如有无红肿及血管增生等情况。
2.4.2 苏木精-伊红(HE)染色后显微镜观察气囊 取出气囊的一半固定于4%多聚甲醛溶液中,经脱水、透明、浸蜡、包埋及修块、脱蜡、HE染色,最后脱水、透明、封片,置于显微镜下观察。每个标本在400倍视野下,随机选取12点方位视野采用Simple PCI6.0图像分析软件测量细胞核的数目并计算平均值即为炎症细胞密度。
2.4.3 RT-PCR法检测气囊组织中TNF-α、IL-1βmRNA表达 取出气囊,制成组织匀浆后,取上清液提取总RNA,经反转录合成cDNA。PCR条件为:94℃预变性3m in,94℃变性30 s,58~59℃退火1m in,72℃延伸5 min,经过35个循环得出荧光信号达到设定的阈值所经历的循环数(ct)。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,根据2-ΔΔct法计算目的基因TNF-α、IL-1βmRNA的相对表达量,Δct=目的基因ct-内参基因ct。引物序列见表1。
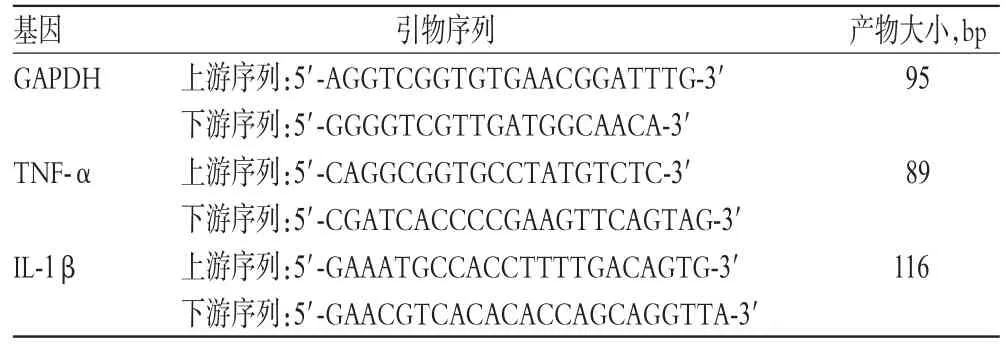
表1 RT-PCR的引物序列Tab 1 RT-PCR p rimer sequences
2.4.4 ELISA法检测气囊组织中TNF-α、IL-1β蛋白表达量 取气囊组织匀浆,12 000 r/min(离心半径15 cm)离心10m in,取含有蛋白质的上清液,按照ELISA试剂盒说明书操作检测,根据样品的吸光度计算出TNF-α、IL-1β的蛋白表达量。
2.5 统计学方法
3 结果
3.1 气囊肉眼观察结果
经肉眼观察可见,空白对照组小鼠气囊轻度红肿,少见新生血管。肽颗粒组小鼠气囊红肿明显,可见较多渗出及新生血管。丹参酮各剂量组小鼠气囊红肿和新生血管情况介于空白对照组与肽颗粒组之间,效果呈剂量依赖性。各组小鼠气囊囊壁的肉眼观察结果见图1。

图1 各组小鼠气囊囊壁的肉眼观察结果Fig 1 Observation results of air-pouch wall of m ice by eyes in each group
3.2 气囊HE染色后显微镜观察结果
空白对照组小鼠气囊囊壁炎症反应轻,周围软组织中以成纤维细胞为主,炎性细胞密度为(2 909.53± 264.57)个/mm2。与空白对照组比较,钛颗粒组小鼠气囊囊壁炎性反应明显,可见大量炎症细胞及注入的磨损颗粒,炎症细胞密度明显增加[(5 324.34±323.74)个/mm2,P<0.05)。丹参酮各剂量组小鼠气囊囊壁炎症反应介于空白对照组和钛颗粒组之间。与钛颗粒组比较,丹参酮低、中、高剂量组小鼠气囊中炎症细胞密度明显减小[(4 563.35±313.43)、(4 117.08±297.47)、(3 783.07± 289.46)个/mm2,P<0.05],其中高剂量组较低、中剂量组减小更明显(P<0.05)。各组小鼠气囊囊壁的组织切片图见图2。

图2 各组小鼠气囊囊壁的组织切片图(HE,×400)Fig 2 Tissue slices of air-pouch wall of m ice in each group(HE,×400)
3.3 气囊组织中TNF-α、IL-1βm RNA及蛋白的表达
与空白对照组比较,钛颗粒组和丹参酮各剂量组小鼠气囊组织中TNF-α、IL-1βmRNA及蛋白表达均增强(P<0.05);与钛颗粒组比较,丹参酮各剂量组小鼠气囊组织中TNF-α、IL-1βmRNA及蛋白表达均减弱(P<0.05),其中高剂量组较低、中剂量组降低更明显(P<0.05)。各组小鼠气囊组织中TNF-α、IL-1βmRNA及蛋白的表达量见表2。
表2 各组小鼠气囊组织中TNF-α、IL-1βm RNA及蛋白的表达量(±s,n=10)Tab 2 m RNA and protein expression of TNF-α,IL-1βin air-pouch tissue of m ice in each group(±s,n=10)
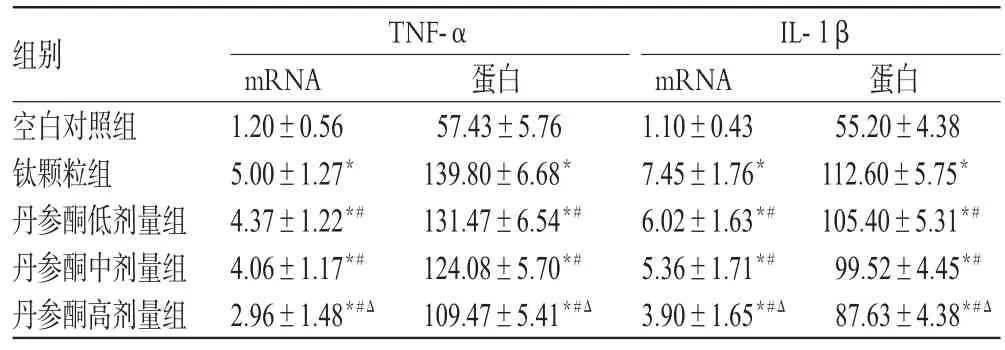
表2 各组小鼠气囊组织中TNF-α、IL-1βm RNA及蛋白的表达量(±s,n=10)Tab 2 m RNA and protein expression of TNF-α,IL-1βin air-pouch tissue of m ice in each group(±s,n=10)
注:与空白对照组比较,*P<0.05;与钛颗粒组比较,#P<0.05;与丹参酮低、中剂量组比较,ΔP<0.05Note:vs.blank control group,*P<0.05;vs.titanium particle group,#P<0.05;vs.tanshinone low-dose,medium-dose groups,ΔP<0.05
组别空白对照组钛颗粒组丹参酮低剂量组丹参酮中剂量组丹参酮高剂量组蛋白55.20±4.38 112.60±5.75*105.40±5.31*#99.52±4.45*#87.63±4.38*#ΔTNF-α mRNA 1.20±0.56 5.00±1.27*4.37±1.22*#4.06±1.17*#2.96±1.48*#Δ蛋白57.43±5.76 139.80±6.68*131.47±6.54*#124.08±5.70*#109.47±5.41*#ΔIL-1β mRNA 1.10±0.43 7.45±1.76*6.02±1.63*#5.36±1.71*#3.90±1.65*#Δ
4 讨论
本文选用的气囊模型已被证明能成功地进行磨损微粒致无菌性松动的机制分析[5]。进行实验室分析所取的气囊囊壁,内附注射的钛颗粒,能有效模拟无菌性松动造成的假体周围微环境[6]。炎症因子TNF-α、IL-1β也是公认的评价炎性反应的指标[7]。因此本实验对探讨药物改善人工关节无菌性松动的研究具有充分的可行性。
磨损产生的钛颗粒长期刺激假体周围组织,使其产生慢性肉芽肿性炎症反应。此炎症反应可使假体与骨之间形成一种炎性界膜,界膜组织中的破骨细胞、成骨细胞、巨噬细胞以及T淋巴细胞等长期受到钛颗粒的刺激,释放出大量溶骨性介质及趋化因子[8],主要包括TNF-α、IL-1β、基质金属蛋白酶9、蛋白激酶K、核因子κB(NF-κB)受体活化因子(RANK)、前列腺素等[9]。上述炎症介质释放的增加,不仅能促进破骨前体细胞分化成熟,增加破骨细胞的数量,导致骨吸收[10];还能作用于自身,使炎症细胞局部浸润性增强,通过自分泌及旁分泌作用致使更多的巨噬细胞在假体周围聚集,放大炎症反应的效果;不仅如此,这些炎性介质还能激活RANK/ RANK配体(RANKL)通路,导致更多的巨噬细胞分化为破骨细胞,进一步加剧骨吸收活性[11]。这些级联反应促成了无菌性炎症和骨溶解,最终诱发人工关节无菌性松动。目前研究证实,在髋膝关节翻修术中,因为无菌性松动导致的假体植入失败的比例已达60%左右[12],由此可见,抑制钛颗粒诱导的炎症反应已经成为预防甚至治疗人工关节无菌性松动的可行之路[13]。
丹参酮又名总丹参酮,是从中药丹参(唇形科植物丹参根)中提取出的具有抑菌作用的脂溶性菲醌化合物,是丹参的主要有效活性成分之一,具有抗血小板聚集、抗动脉硬化、抗感染和降低血脂等作用[14]。沈迎念等[15]发现,在治疗主动脉瓣钙化过程中丹参酮能有效抑制TNF-α、1L-1β的表达。BaiY等[16]证明了丹参酮能通过抑制NF-κB信号通路来治疗结肠癌。除此之外,Fan G等[17]的研究结果也表明,丹参酮能通过抑制TNF-α、IL-1β等炎症因子及NF-κB信号通路,有效抑制脂多糖诱发的炎症反应。在人工关节无菌性松动中,NF-κB信号被激活后,可引起单核巨噬细胞在假体周围广泛聚集,进一步分化成为破骨细胞,造成假体周围破骨细胞数量增加。甚至NF-κB本身也能促使破骨细胞前体向破骨细胞分化,同时具有维持破骨细胞生存的作用[18]。而丹参酮不仅能抑制TNF-α、IL-1β等炎症因子的释放,还能阻断NF-κB信号通路,这些因素的共同作用都可抑制破骨细胞激活,从而抑制假体周围骨溶解的发生,延缓人工关节无菌性松动的发生及发展。
本实验结果表明,丹参酮能有效抑制人工关节无菌性松动过程中的炎症级联反应,有效干预人工关节无菌性松动的病变过程,为将来使用药物预防假体植入失败提供了理论依据。
[1] Rao AJ,Gibon E,Ma T,etal.Revision joint replacement,wear particles,and macrophage polarization[J].Acta Biomater,2012,8(7):2815-2823.
[2] 李彩蓉,甘受益,黄红霞,等.丹参酮ⅡA磺酸钠治疗急性冠脉综合征的疗效及对炎症因子的影响[J].现代中西医结合杂志,2015,24(21):2284-2286.
[3] 张晓,张国庆,顾伯林,等.丹参及其有效成分对骨代谢影响的实验研究进展[J].中国骨质疏松杂志,2015,21(1):112-116.
[4] 张晓燕,崔燎,吴铁,等.丹参酮对去卵巢大鼠牙槽骨丢失的抑制作用[J].中国老年学杂志,2012,32(1):113-114.
[5] 陈明,雷宇,董启榕,等.以air pouch模型大鼠进行磨损微粒造成无菌性松动机制分析的可行性[J].中国组织工程研究与临床康复,2009,13(26):5023-5026.
[6] Sonntag R,Reinders J,Kretzer JP.What’s next?A lternativematerials for articulation in total joint replacement[J]. Acta Biomater,2012,8(7):2434-2441.
[7] 吕厚山.现代人工关节外科学[M].北京:人民卫生出版社,2006:108.
[8] Athanasou NA.The pathobiology and pathology of aseptic implant failure[J].Bone JointRes,2016,5(5):162-168.
[9]How ie DW,Neale SD,Haynes DR,et al.Periprosthetic osteolysis after total hip replacement:molecular pathology and clinical management[J].Inflammopharmacology,2013,21(6):389-396.
[10] Guo H,Zhang J,Hao S,et al.Adenovirus-mediated small interfering RNA targeting tumor necrosis factor-αinhibits titanium particle-induced osteoclastogenesis and bone resorption[J].Int JMolMed,2013,32(2):296-306.
[11]AtkinsGJ,Haynes DR,How ie DW,etal.Role of polyethylene particles in peri-prosthetic osteolysis:a review[J]. World JOrthop,2011,2(10):93-101.
[12] Sundfeldt M,Carlsson LV,Johansson CB,et al.Aseptic loosening,not only a question of wear:a review of different theorie[J].Acta Orthop,2006,77(2):177-197.
[13] Maruotti N,Corrado A,Neve A,et al.Bisphosphonates:effects on osteoblast[J].Eur JClin Pharmacol,2012,68(7):1013-1018.
[14] 马丙祥,董宠凯.丹参的药理作用研究新进展[J].中国药房,2014,25(7):663-665.
[15] 沈迎念,胡伟林,陈正平,等.丹参酮ⅡA抑制主动脉瓣成肌纤维细胞向成骨细胞样表型转化的机制[J].中国中药杂志,2015,40(18):3636-3643.
[16] Bai Y,Zhang L,Fang X,et al.TanshinoneⅡAenhances chemosensitivity of colon cancer cells by suppressing nuclear factor-κB[J].Exp TherMed,2016,11(3):1085-1089.
[17] Fan G,Jiang X,Wu X,etal.Anti-inflammatory activity of tanshinoneⅡAin lps-stimulated RAW 264.7 macrophages viamiRNAsand TLR4-NF-κB pathway[J].Inflammation,2016,39(1):375-384.
[18] Cildir G,Low KC,Tergaonkar V.Noncanonical NF-κB signaling in health and disease[J].Trends MolMed,2016,22(5):414-429.
(编辑:邹丽娟)
Effect of Tanshinone on Inflammatory Response in Air-pouch M odel M ice w ith Artificial Joint Aseptic Loosening
LAIXiaoyu1,CHEN Jincai2,LIU Xunzhi1,GAO Hui1,HE Cheng1(1.Dept.of Orthopedics,First Affiliated Hospital of Gannan Medical University,Jiangxi Ganzhou 341000,China;2.Gannan Medical University,Jiangxi Ganzhou 341000,China)
Tanshinone;Aseptic loosening;Air-pouchmodel;Inflammatory factor;M ice
R687
A
1001-0408(2017)13-1780-04
2016-08-09
2016-10-24)
*主治医师,硕士。研究方向:人工关节无菌性松动。电话:0797-8266017。E-mail:562213821@qq.com
#通信作者:副主任医师。研究方向:人工关节无菌性松动。电话:0797-8269507。E-mail:jxgzhecheng@163.com
DOI10.6039/j.issn.1001-0408.2017.13.15
ABSTRACTOBJECTIVE:To study the effect of tanshinone on inflammatory response in air-pouch model mice w ith artificial joint aseptic loosening.METHODS:M ice were random ly divided into blank control group(normal saline),titanium particle group(normal saline),tanshinone low-dose,medium-dose,high-dose groups(50,100,200 mg/kg),10 in each group.Air-pouch modelswere induced.Except thatmice were injected 0.5 m L normal saline into air-pouch in blank control group,other groups were injected 0.5 m L Titanium particle suspension(10 mg/m L)into air-pouch,continuously administrated medicines by 0.1 m L/10 g after 24 h,ig,for 14 d.After 24 h of last administration,the air-pouch was collected,air-pouch inflammation was observed by eyes and by m icroscopy after hematoxylin-eosin staining,and inflammatory cell density was calculated.Real-time quantitative polymerase chain reactionmethod was conducted to detect the tumor necrosis factorα(TNF-α),interleukin 1β(IL-1β)mRNA expression;enzyme-linked immunosorbentmethod was used to detect the TNF-α,IL-1βprotein expression.RESULTS:Compared w ith blank control group,air-pouch swelling was obvious in titanium particle group,much exudation and neovascular were observed,inflammatory response was severe,inflammatory cell density was increased significantly(P<0.05);TNF-α,IL-1βmRNA and protein expression were obviously enhanced(P<0.05).Compared w ith titanium particle group,air-pouch swelling was relieved in tanshinone doses groups,exudation and neovascular were decreased,inflammatory response was relieved,inflammatory cell density was decreased significantly(P<0.05);TNF-α,IL-1βmRNA and protein expression were obviously decreased(P<0.05),w ith a dose-dependentmanner.CONCLUSIONS:Tanshinone can effectively inhibit the aseptic inflammatory response in air-pouch model m ice w ith artificial joint aseptic loosening.
