缺氧条件下人卵巢癌细胞对顺铂耐药与TLR9的关系研究Δ
2017-05-16幸海燕陈剑鸿第三军医大学第三附属医院药剂科重庆400042
李 玲,李 斌,幸海燕,陈剑鸿(第三军医大学第三附属医院药剂科,重庆 400042)
·实验研究·
缺氧条件下人卵巢癌细胞对顺铂耐药与TLR9的关系研究Δ
李 玲*,李 斌,幸海燕,陈剑鸿#(第三军医大学第三附属医院药剂科,重庆 400042)
目的:研究缺氧条件下人卵巢癌细胞(SKOV3)对顺铂耐药与Toll样受体9(TLR9)的关系。方法:采用免疫荧光法检测破膜和未破膜SKOV3中TLR9的表达。取SKOV3,加入TLR9特异性激动剂CpG-ODN 2006(A组)及其同型对照CpG-ODN 2006 control(B组)作用6、12、24 h后,加入顺铂,以CCK-8法检测细胞抑制率。取SKOV3或经0(未加)、1、10、102、103μmol/LTLR9特异性拮抗剂氯喹预处理3 h后的SKOV3,加入SKOV3常氧(21%O2)、缺氧(1%O2)孵育6、12、24 h的细胞上清作用24 h后,加入顺铂,检测细胞增殖抑制率,计算预处理细胞缺氧时药物抑制率的降低倍数(HICR);并采用Western blot法检测常氧24 h细胞上清(C组)、缺氧24 h细胞上清(D组)、缺氧24 h细胞上清+10μmol/L氯喹(E组)条件下SKOV3中多药耐药相关蛋白(MRP)的表达。结果:TLR9在SKOV3的细胞膜和细胞质中均有表达。与A组比较,B组细胞增殖抑制率降低(P<0.01)。与常氧细胞上清比较,缺氧细胞上清作用后细胞增殖抑制率降低(P<0.05)。与未加氯喹比较,加入10、102μmol/L氯喹能明显降低HICR(P<0.01),其中缺氧24 h细胞上清+10μmol/L氯喹降低最明显。与C组比较,D组细胞中MRP表达增强(P<0.01);与D组比较,E组细胞中MRP表达减弱(P<0.01)。结论:TLR9受体在缺氧下可被激活,并可导致SKOV3对顺铂耐药,该作用可能与上调MRP表达有关。
人卵巢细胞;缺氧;化疗敏感性;Toll样受体9;顺铂
卵巢癌是妇科常见的恶性肿瘤之一,目前除手术治疗外,顺铂是治疗卵巢癌的一线化疗药物。但卵巢癌细胞对顺铂的耐药严重影响了其治疗效果,因此,探索卵巢癌细胞耐药相关因素及机制,寻找有效逆转耐药的治疗靶点,对卵巢癌的治疗具有重要意义。
Toll样受体(Toll-like receptor,TLR)家族中的TLR9,是一种模式识别受体,可以识别微生物衍生的分子模式结构(如:m tDNA),并引起受体的结构性变化,然后通过衔接蛋白M yD88的募集反应,促进激酶类有丝分裂原激活蛋白的磷酸化,激活相应信号通路,调控相应基因的表达。最初在肺癌和乳腺癌细胞系样品中发现TLR9高表达与致癌作用相关。TLR9受到刺激后,可上调一些凋亡抑制基因,如Survivin、Bcl-xl等。另外,有研究证明,低氧可以导致实体瘤细胞对化疗药物敏感性降低,这也可能是铂类耐药的重要因素[1]。为此,本研究在观察卵巢癌细胞对顺铂耐药与TLR9受体的关系的同时,初步探究了二者在缺氧条件下的关系,以期为阐明卵巢癌细胞耐药机制以及寻找新的化疗增敏靶点提供实验依据。
1 材料
1.1 仪器
低氧恒温培养箱(赛默飞世尔科技有限公司);全波长酶标仪(美国Thermo公司);凝胶成像系统(美国Bio-Rad公司);Ⅸ2-UCB激光共聚焦显微镜与CKX41倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
顺铂(批号:MKBV3446V,纯度:≥99.9%)和氯喹(批号:085M 4098V,纯度:≥98%)均购自美国Sigma公司;TLR9特异性激动剂CpG-ODN 2006(批号:3710-61)及其同型对照CpG-ODN 2006 control(批号:3801-02T)购自美国InvivoGen公司;辣根过氧化物酶(HRP)山羊抗兔免疫球蛋白G(IgG)抗体、β-肌动蛋白(β-actin)抗体、聚乙二醇辛基苯基醚(Triton)(中国碧云天生物技术有限公司);猴抗鼠荧光二抗、猴抗兔荧光二抗(美国Thermo公司);聚偏氟乙烯(PVDF)膜(美国Bio-Rad公司);TLR9抗体、多药耐药相关蛋白(MRP)抗体(美国Abcam公司);CCK-8细胞增殖检测试剂盒(上海东仁化学科技有限公司,批号:GA611)。
1.3 细胞
人卵巢癌细胞株(SKOV3)购自American Type Culture Collection(ATCC)公司,细胞在37℃、5%CO2条件下的1640细胞培养基(高糖,含10%胎牛血清)中培养。
2 方法
2.1 细胞中TLR9的荧光表达
将SKOV3消化接种到爬片培养24 h后,磷酸盐缓冲液(PBS)洗3次,4%多聚甲醛固定,分为破膜组和未破膜组。破膜组细胞先根据蛋白定位情况加入Triton破膜20min,然后两组细胞均用PBS洗3次,血清封闭1 h;加入TLR9抗体,4℃孵育过夜,PBS洗3次,每次5min;加入带有荧光标记的二抗暗处孵育1 h,PBS洗3次,每次5m in;加入4′,6-二脒基-2-苯基吲哚(DAPI)染核15 min,PBS洗3次,封片。激光共聚焦显微镜采集图像,观察2组SKOV3中TLR9的荧光表达。
2.2 细胞对顺铂耐药与TLR9的关系
将SKOV3(5×104m L-1)培养于96孔板,细胞贴壁后,分为A组(CpG-ODN 2006)和B组(CpG-ODN 2006 control),分别加入50μg/m L的CpG-ODN 2006或CpGODN 2006 control,作用6、12、24 h,弃培养基,加入3.5 μg/m L的顺铂培养24 h,再加入用培养基配制的10% CCK-8溶液,孵育3 h。用酶标仪测定450 nm波长处光密度(OD),计算增殖抑制率,增殖抑制率=(空白孔OD值-给药孔OD值)/(空白孔OD值-对照孔OD值)× 100%。每个时间点平行3个复孔。
2.3 细胞对顺铂耐药与缺氧的关系
将SKOV3置于缺氧(1%O2)和常氧(21%O2)的培养箱中培养6、12、24 h后,收集上清,离心去除细胞残渣,用新鲜培养基稀释制成缺氧细胞上清和常氧细胞上清。然后用含80%上述细胞上清的培养基培养SKOV3,每种细胞上清平行6个复孔,培养24 h后弃培养基,按“2.1”项下方法加入顺铂后,测定OD值,计算增殖抑制率。
2.4 TLR9拮抗细胞对顺铂耐药与缺氧的关系
分别用0、1、10、102、103μmol/L的氯喹预处理SKOV3 3 h后,再用“2.3”项下含80%细胞上清(低氧、常氧下培养6、12、24 h)的培养基培养细胞,每种细胞上清平行6个复孔。培养24 h后弃培养基,按“2.1”项下方法加入顺铂后,测定OD值,计算增殖抑制率。用“缺氧时药物抑制率的降低倍数(HICR)”表示缺氧诱导的耐药性,HICR=(缺氧细胞上清的增殖抑制率-常氧细胞上清的增殖抑制率)/常氧细胞上清的增殖抑制率。
2.5 MRP表达与TLR9的关系
将SKOV3置于缺氧和常氧的培养箱中培养24 h后,制成80%的细胞上清。取SKOV3分为C组(常氧24 h细胞上清)、D组(缺氧24 h细胞上清)和E组(缺氧24 h细胞上清+10μmol/L氯喹),每组6个复孔,按相应条件加入培养基培养24 h后,采用Western blot法检测TLR9、MRP蛋白表达。先提取细胞的总蛋白,测定蛋白浓度;待聚丙烯酰氨凝胶凝固后,电泳转至PVDF膜,封闭1~2 h,加入对应的TLR9抗体(1∶500稀释)、MRP抗体(1∶500稀释)、β-actin抗体(内参,1∶1 000稀释),4℃孵育过夜,TBST缓冲液洗膜后加入相应二抗,室温孵育1 h,TBST缓冲液洗膜,曝光;Image Lab软件分析图片,以目标蛋白与内参比值评价目标蛋白的相对表达量。
2.6 统计学方法
3 结果
3.1 细胞TLR9的荧光表达
结果表明,TLR9在SKOV3的细胞膜和细胞质中均有表达。2组SKOV3中TLR9表达的荧光图见图1。
3.2 细胞对顺铂耐药与TLR9的关系
A组SKOV3在作用6、12、24 h后增殖抑制率分别为(47.97±0.49)%、(50.86±0.46)%、(53.09±0.70)%;B组分别为(51.19±0.90)%、(53.69±0.58)%、(55.13± 0.21)%(n=6)。与B组比较,A组SKOV3对应时间点的增殖抑制率明显降低(P<0.01)。
3.3 细胞对顺铂耐药与缺氧的关系
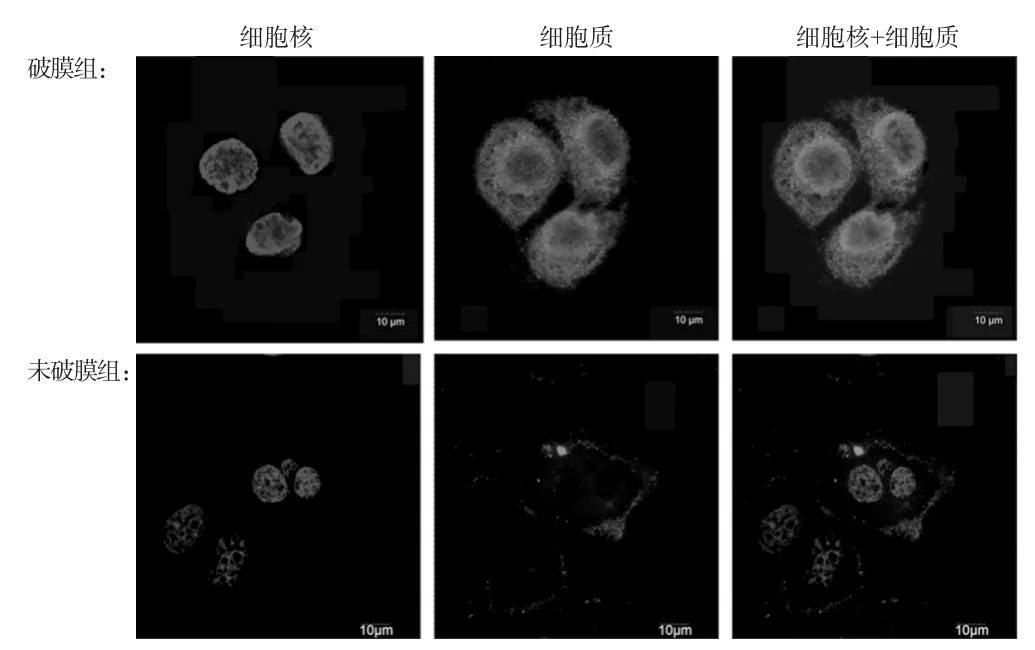
图1 2组SKOV3中TLR9表达的荧光图Fig 1 Fluorescence diagram of TLR9 expression in SKOV3 of 2 groups
常氧6、12、24 h细胞上清作用后SKOV3增殖抑制率分别为(52.89±5.11)%、(56.17±4.19)%、(53.16± 4.10)%;缺氧6、12、24 h细胞上清作用后SKOV3增殖抑制率分别为(48.77±4.76)%、(48.54±3.28)%、(45.49± 4.84)%(n=6)。与常氧细胞上清比较,相应时间点的缺氧细胞上清作用后SKOV3增殖抑制率明显降低(P<0.05)。
3.4 TLR9拮抗细胞对顺铂耐药与缺氧的关系
与未加氯喹(0μmol/L)比较,加入10、102μmol/L氯喹能明显降低HICR(P<0.01),其中缺氧24 h细胞+10 μmol/L氯喹处理后HICR降低最明显。不同浓度氯喹预处理不同时间后SKOV3的HICR测定结果见表1。
表1 不同浓度氯喹预处理不同时间后SKOV3的HICR测定结果(±s,n=6,%%)Tab 1 Determ ination results of HICR of SKOV3 after pretreated by different concentrations of ch loroquine at different tim e(±s,n=6,%%)

表1 不同浓度氯喹预处理不同时间后SKOV3的HICR测定结果(±s,n=6,%%)Tab 1 Determ ination results of HICR of SKOV3 after pretreated by different concentrations of ch loroquine at different tim e(±s,n=6,%%)
注:与未加氯喹(0μmol/L)比较,*P<0.01Note:vs.notadded chloroquine(0μmol/L),*P<0.01
24 h 5.17±0.42 5.03±0.71 1.86±0.30*2.04±0.19*5.94±0.34氯喹浓度,μmol/L 011 0 1021036 h 1.52±0.24 1.01±0.49 0.37±0.62*1.05±0.73 1.02±0.44 12 h 3.92±0.80 4.68±0.70 1.46±0.44*2.07±0.44*4.03±0.77
3.5 MRP表达与TLR9的关系
与C组比较,D组细胞中MRP表达增强(P<0.01);与D组比较,E组细胞中MRP表达减弱(P<0.01)。3组SKOV3中MRP表达的电泳图见图2,测定结果见图3。
4 讨论
TLR9受体是一种先天免疫系统的细胞DNA受体,广泛表达于各种人类癌细胞及癌组织中,包括乳腺癌、前列腺癌、胃癌、肾细胞癌、食管癌等[2-5],其表达会影响肿瘤的免疫表型及化疗,并在癌症的预后中有重要作用。本研究选用了CpG-ODN 2006[6]和氯喹[7]分别作为TLR9的特异性激动剂和拮抗剂。笔者以SKOV3为研究对象,通过免疫荧光染色直观观察发现TLR9在SKOV3的细胞膜和细胞质中均有表达,当用CpG-ODN 2006刺激SKOV3后,细胞对顺铂的敏感性降低,不仅说明TLR9表达于SKOV3中,同时提示TLR9激活在肿瘤细胞的化疗耐药方面具有重要的功能。

图2 3组SKOV3中MRP表达的电泳图Fig 2 Electrophoresis chart of MRP expression in SKOV3 of3 groups

图3 3组SKOV3中MRP表达的测定结果Fig 3 Determ ination results of MRP expression in SKOV3 of 3 groups
由于实体瘤细胞的恶性增殖速度大于血管生成速度,造成细胞缺氧,最近的研究发现,肿瘤缺氧微环境诱导的旁分泌因素是癌细胞耐药的关键因素。在肝癌细胞中,缺氧会诱导胞内转运和一些损伤相关分子(DAMPS)释放[8],进而降低细胞对环孢素和依托泊苷的敏感性[9]。因为DAMPS中的核酸类物质可以激活TLR9受体,于是本文设计了用缺氧不同时间的细胞上清刺激细胞,结果发现SKOV3对顺铂的敏感性降低,即缺氧细胞上清可以提高肿瘤细胞的耐药性,说明缺氧后细胞会释放某种物质引起细胞耐药。TLR9特异性拮抗剂氯喹能明显抑制缺氧细胞上清对顺铂耐药性的增强作用,提示卵巢癌细胞在受到类似缺氧的刺激下,会导致细胞受损,释放一些损伤相关分子,从而活化TLR9受体。
缺氧细胞上清刺激SKOV3后,在提高顺铂耐药性的同时上调了MRP蛋白的表达,而加入氯喹则削弱了这一效应,提示缺氧细胞上清对耐药蛋白的上调效应与TLR9有关。TLR9被活化可激活NF-κB、MAPK等信号通路,调控MRP蛋白的表达[10-11]。已有研究发现异长春花碱可通过降低MRP1的表达逆转人鼻咽癌细胞对顺铂的耐药[12]。所以在卵巢癌细胞对顺铂耐药过程中,TLR9可能的作用机制是其活化导致了NF-κB、MAPK信号通路的激活,从而上调了MRP蛋白的表达,促使药物外排增加,导致化疗药敏感性降低而出现耐药。本研究从TLR9的角度为阐明卵巢癌的耐药机制提供了新的依据,推测TLR9有望成为化疗增敏的一个新靶点。
[1] 郭洋,吴密璐,赵君慧,等.肺癌低氧微环境与化疗耐药相关性研究进展[J].中国肺癌杂志,2014,17(3):265-268.
[2] Sandholm J,Selander KS.Toll-like receptor 9 in breast cancer[J].Front Immunol,2014,doi:10.3389/fimmu.2014.00330.
[3] Vaisanen MR,Jukkola-Vuorinen A,Vuopala KS,etal.Expression of toll-like receptor-9 is associated w ith poor progression-free survival in prostate cancer[J].Oncol Lett,2013,5(5):1659-1663.
[4] Fernandez-Garcia B,Eiro N,Gonzalez-Reyes S,etal.Clinicalsignificance of toll-like receptor 3,4,and 9 in gastric cancer[J].J Immunother,2014,37(2):77-83.
[5] Zhang Y,Wang Q,Ma A,etal.Functionalexpression of TLR9 in esophageal cancer[J].Oncol Rep,2014,31(5):2298-2304.
[6]GurselM,Gursel I.Developmentof CpGODN based vaccine adjuvant formulations[J].Methods Mol Biol,2016,doi:10.1007/978-1-4939-3389-1_20.
[7] Tuomela J,Sandholm J,Kauppila JH,et al.Chloroquine has tumor-inhibitory and tumor-promoting effects in triple-negative breast cancer[J].Oncol Lett,2013,6(6):1665-1672.
[8]Liu Y,YanW,Tohme S,etal.Hypoxia induced HMGB1 and m itochondrial DNA interactions mediate tumor grow th in hepatocellular carcinoma through Toll-like receptor9[J].JHepatol,2015,63(1):114-121.
[9] Brahim i-Horn MC,Ben-Hail D,Ilie M,etal.Expression of a truncated active form of VDAC1 in lung cancer associates w ith hypoxic cell survival and correlates w ith progression to chemotherapy resistance[J].Cancer Res,2012,72(8):2140-2150.
[10] Zhu ZA,Zhu ZQ,CaiHX,etal.Reversion ofmultidrug resistance by SKI-Ⅱin SGC7901/DDP cells and exploration of underlying mechanisms[J].Asian Pac J Cancer Prev,2012,13(2):625-631.
[11] Kwon YS,Chun SY,Nam KS,etal.Lapatinib sensitizes quiescent MDA-MB-231 breast cancer cells to doxorubicin by inhibiting the expression ofmultidrug resistance-associated protein-1[J].OncolRep,2015,34(2):884-890.
[12] 韩建庚.异长春花碱对耐顺铂人鼻咽癌细胞多药耐药的逆转作用及其机制[J].中国药房,2014,25(1):19-21.
Study on the Relationship between Cisp latin-resistance of Human Ovarian Cancer Cell and TLR9 under Hypoxia
LI Ling,LIBin,XING Haiyan,CHEN Jianhong(Dept.of Pharmacy,the Third Affiliated Hospital,Third M ilitary Medical University,Chongqing 400042,China)
OBJECTIVE:To study the relationship between cisplatin-resistant of human ovarian cancer cells(SKOV3)and Toll-like receptor 9(TLR9)under hypoxia.METHODS:Immunofluorescence method was used to detect the TLR9 expression in rupture and intactmembranes SKOV3.SKOV3 was taken,adding cisplatin,then CCK-8 was used to detect cell inhibition rate after 6,12,24 h of added into TLR9 specific agonists CpG-ODN 2006(group A)and its isotype control CpG-ODN 2006 control(group B).SKOV3 or SKOV3 pretreated by 0(not added),1,10,102,103μmol/L TLR9 specific antagonist chloroquine for 3 h were taken,adding cisplatin,cell inhibition rate was detected after 24 h of added into SKOV3 normoxia(21%O2),hypoxia(1% O2)incubating 6,12,24 h,HICR under hypoxia in pretreatmentwas calculated.Western blotmethod was used to detect themultidrug resistance associated protein(MRP)expression in SKOV3 under the conditions of normoxia 24 h cell supernatant(group C),hypoxia 24 h cell supernatant(group D),hypoxia 24 h cell supernatant+10μmol/L chloroquine(group E).RESULTS:TLR9 was expressed in both cellmembrane and cytoplasm of SKOV3.Compared w ith group A,cell inhibition rate in group B was decreased(P<0.01).Compared w ith normoxia cell supernatant,cell inhibition rate was decreased after hypoxia cell supernatant(P<0.05). Compared w ith not added chloroquine,adding 10,102μmol/L chloroquine can obviously decrease HICR(P<0.01),and themost significant decrease was showed when using hypoxia 24 h cell supernatant+10μmol/L chloroquine.Compared w ith group C,MRP expression in group D was strengthened(P<0.01);compared w ith group D,MRP expression in group E was weakened(P<0.01).CONCLUSIONS:TLR9 receptors can be activated under hypoxia,and cause SKOV3 to cisplatin-resistance,the effectmay be related w ith up-regulating MRP expression.
Human ovarian cells;Hypoxia;Chemotherapy sensitivity;Toll-like receptor-9;Cisplatin
R361+.3
A
1001-0408(2017)13-1744-04
2017-01-13
2017-03-09)
(编辑:邹丽娟)
国家自然科学基金面上项目(No.30973493)
*硕士研究生。研究方向:肿瘤化疗耐药。电话:023-68812151。E-mail:915934926@qq.com
#通信作者:主任药师,教授,博士生导师。研究方向:肿瘤化疗耐药。电话:023-68812151。E-mail:chenjh-110@263.net
DOI10.6039/j.issn.1001-0408.2017.13.05
