系统评价万古霉素联合地塞米松鞘内注射治疗颅内感染的有效性和安全性
2017-05-16张媛媛张晓燕李凤蕾王立丹哈励逊国际和平医院药学部河北衡水053000
张媛媛,张晓燕,杜 梅,李凤蕾,王立丹(哈励逊国际和平医院药学部,河北衡水 053000)
系统评价万古霉素联合地塞米松鞘内注射治疗颅内感染的有效性和安全性
张媛媛*,张晓燕#,杜 梅,李凤蕾,王立丹(哈励逊国际和平医院药学部,河北衡水 053000)
目的:系统评价万古霉素联合地塞米松鞘内注射治疗颅内感染的临床疗效和安全性,为临床提供循证参考。方法:计算机检索PubMed、Medline、中国期刊全文数据库、中文科技期刊数据库和万方数据库,收集万古霉素联合地塞米松鞘内注射治疗颅内感染的随机对照试验(RCT)。由两位评价员独立筛选文献、提取资料并按照Cochrane系统评价员手册5.0.1版评价纳入研究的偏倚风险后,采用Rev Man 5.2统计软件进行Meta分析。结果:最终纳入8项RCT,合计543例患者。Meta分析结果显示,与头孢曲松钠或万古霉素静脉滴注相比,万古霉素联合地塞米松鞘内注射可明显提高颅内感染患者有效率[RR=1.18,95%CI(1.11,1.26),P<0.001]和脑脊液细菌清除率[RR=1.13,95%CI(1.01,1.27),P<0.001],缩短临床治疗时间[SMD=-1.60,95%CI(-1.89,-1.30),P<0.001],减少不良反应发生率[RR=0.48,95%CI(0.32,0.73),P<0.001],同时还能明显改善患者颅内压[SMD=-1.78,95%CI(-2.10,-1.47),P<0.001]、脑脊液蛋白定量[SMD=-0.18,95%CI(-0.25,-0.11),P<0.001]和脑脊液葡萄糖定量[SMD=1.77,95%CI(0.91,2.63),P<0.001],差异均有统计学意义。结论:万古霉素联合地塞米松鞘内注射治疗颅内感染临床疗效较好,可以提高脑脊液细菌清除率,缩短治疗时间,降低患者颅内压和脑脊液蛋白定量,提高脑脊液葡萄糖定量,且安全性较好。
万古霉素;地塞米松;颅内感染;鞘内注射;系统评价;Meta分析
颅内感染是重症颅脑损伤患者术后常见的并发症,也是导致患者治疗失败或死亡的主要原因。金黄色葡萄球菌是颅内感染的主要致病菌,占全部感染的70.6%;近年来耐甲氧西林金黄色葡萄球菌(MRSA)感染比例呈上升趋势,进一步增加了颅内感染的风险和治疗难度[1]。万古霉素是治疗MRSA的首选药物,但由于存在血脑屏障,致使常规剂量万古霉素在脑脊液中无法达到有效杀菌浓度。增加单次给药剂量虽在一定程度上可以提高脑脊液中的药物浓度,但肾毒性等严重不良反应发生率亦明显增加。研究发现,万古霉素鞘内注射能有效避免血脑屏障对药物的过滤作用,可通过较小用药剂量使局部达到较高的药物浓度,从而增强感染控制效果和减少不良反应的发生[2]。地塞米松为糖皮质激素,可减少体内免疫复合物和抗体的生成,《国家抗微生物治疗指南》推荐,中枢神经系统感染者使用抗菌药物联合地塞米松,能阻断肿瘤坏死因子生成[3]。本文采用Meta分析的方法,系统评价了万古霉素联合地塞米松鞘内注射治疗颅内感染的有效性和安全性,以期为临床应用提供循证依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的临床随机对照试验(RCT),盲法和语种不限。
1.1.2 研究对象 临床诊断为颅内感染者[4-5],并启动经验性抗感染治疗;排除合并严重的肝、肾疾病者,合并严重的免疫系统疾病或急、慢性疾病者。患者年龄和性别不限。
1.1.3 干预措施 对照组患者给予头孢曲松钠或万古霉素静脉滴注;试验组患者给予万古霉素联合地塞米松鞘内注射。剂量和疗程不限。
1.1.4 结局指标和疗效判定标准 ①临床有效率:患者治疗后临床症状全部消失,且脑脊液及细菌学检查均正常为痊愈;治疗后病情好转,但其临床症状、脑脊液及细菌学检查中有1项检查结果不正常为显效;治疗后临床症状明显好转,但脑脊液检查、细菌学检查均不正常为有效;治疗后临床症状无明显改善,甚至有恶化迹象为无效[有效率=(痊愈例数+显效例数+有效例数)/总例数×100%[6];②脑脊液细菌清除率;③不良反应发生率;④临床治疗时间;⑤颅内压变化值;⑥脑脊液蛋白定量变化值;⑦脑脊液葡萄糖定量变化值。其中,①②④⑤⑥⑦为疗效指标,③为安全性指标。
1.1.5 排除标准 ①未对试验组和对照组患者的基线资料进行对比的研究;②试验组和对照组患者给予的基础干预措施不一致;③试验组患者除给予万古霉素和地塞米松鞘内注射外,还给予其他药物;④试验组患者采用万古霉素静脉滴注联合鞘内注射给药;⑤结局指标报道不详尽;⑥综述及基础性研究;⑦重复发表的文献;⑧不能获取全文的文献。
1.2 检索策略
计算机检索PubMed、Medline、中国期刊全文数据库、中文科技期刊数据库和万方数据库,检索年限为各数据库建库起至2016年4月。中文检索词:“万古霉素”“地塞米松”“鞘内注射”“颅内感染”;英文检索词:“Vancomycin”“Dexamethasone”“Intrathecal injection”“Intracranial injection”。
1.3 资料提取
由两位研究者交叉性独立评价和数据提取,如遇分歧时,由第三位研究者或咨询相关专业人士解决。提取数据包括:1)研究者姓名、发表时间及期刊名;2)受试者基本信息,包括年龄、性别构成比、病程、病情严重程度等;3)干预措施,包括两种药物给药用法、用量,疗程等;4)疗效评价指标及研究结果。
1.4 文献质量评价
根据Cochrane系统评价手册5.0.1版的RCT质量评价标准进行评价:1)随机方法是否正确;2)是否采用分配隐藏;3)是否采用盲法,包括单盲、双盲或三盲;4)是否全程随访,是否报告失访人数,失访人数是否控制在10%以内。将研究质量分为A、B、C级,其中完全满足以上4条质量标准者为A级,属低度偏倚,发生各种偏倚的可能性最小;完全满足1条、或1条以上标准为部分满足者为B级,属中度偏倚;1条或1条以上标准完全不满足者为C级,属高度偏倚,有发生偏倚的高度可能性。
1.5 统计学方法
采用Rev Man 5.2统计软件进行数据分析处理。计数资料采用相对危险度(RR);计量资料采用标准均数差(SMD)进行统计,两者均以95%置信区间(CI)表示。采用χ2检验分析各研究间的异质性,显著性水平为α=0.1。如果P≥0.1,I2≤50%,表明各研究间无统计学异质性,采用固定效应模型分析;反之,表明各研究间存在明显异质性,分析异质性来源,如果异质性为统计学异质性,采用随机效应模型分析,如果为非统计学异质性,则采用描述分析。检验水准为P<0.05。采用倒漏斗图分析潜在的发表偏倚。
2 结果
2.1 纳入研究基本信息与质量评价
共检索到相关文献78篇,严格按照文献纳入与排除标准进行筛选,最终纳入8项研究,均为中文文献,合计543例患者,其中对照组254例,试验组289例[5-12]。纳入研究例数为33~145例,年龄为28~58岁。8项研究均提到“随机”分组[5-12],3项研究采用随机数字表法[5,9,11],1项研究采用计算机随机分组[12];1项研究有“脱落/失访”病例,脱落人数在10%以内[6];所有研究均未提及是否采用分配隐藏和盲法[5-12];8项研究均进行了基线分析[5-12],两组患者基线相似,具有可比性。质量评价结果为,5项研究评为B级[5-6,9,11-12],3项研究评为C级[7-8,10]。
2.2 Meta分析结果
2.2.1 有效率 8项研究报道了有效率[5-12],各研究间无统计学异质性(P=0.98,I2=0),采用固定效应模型分析,详见图1。Meta分析结果显示,试验组患者有效率显著高于对照组,差异有统计学意义[RR=1.18,95%CI (1.11,1.26),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=0.99,I2=0),采用固定效应模型分析,结果显示试验组患者有效率显著高于头孢曲松钠,差异有统计学意义[RR=1.18,95%CI(1.08,1.30),P<0.001];②对照组为万古霉素,各研究间无统计学异质性(P=0.66,I2=0),采用固定效应模型分析,结果显示试验组患者有效率显著高于万古霉素,差异有统计学意义[RR=1.18,95%CI(1.09,1.29),P<0.001]。

图1 两组患者有效率的Meta分析森林图Fig 1 Forest plot of Meta-analysis of effective rate in 2 groups
2.2.2 脑脊液细菌清除率 3项研究报道了脑脊液细菌清除率[8,11-12],对照组均为万古霉素,各研究间无统计学异质性(P=0.95,I2=0),采用固定效应模型分析,详见图2。Meta分析结果显示,试验组患者细菌清除率显著高于对照组,差异有统计学意义[RR=1.13,95%CI (1.01,1.27),P=0.03]。
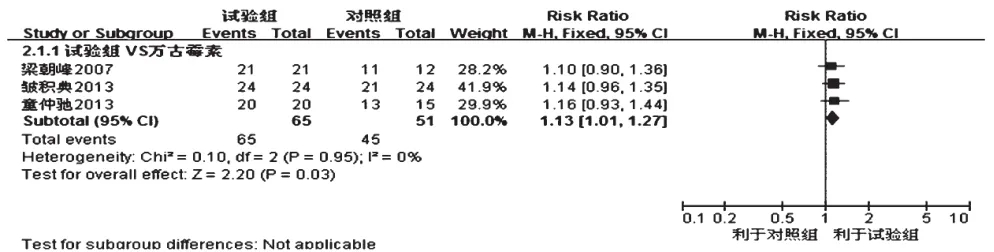
图2 两组患者脑脊液细菌清除率的Meta分析森林图Fig 2 Forest plot of Meta-analysis of bacteria clearance rate of CSF in 2 groups

图3 两组患者不良反应发生率的Meta分析森林图Fig 3 Forest plot of Meta-analysis of the incidence of adverse reactions in 2 groups
2.2.3 不良反应发生率 8项研究报道了不良反应发生率[5-12],各研究间无统计学异质性(P=0.82,I2=0),采用固定效应模型分析,详见图3。Meta分析结果显示,试验组患者不良反应发生率显著低于对照组,差异有统计学意义[RR=0.48,95%CI(0.32,0.73),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=0.42,I2=0),采用固定效应模型分析,结果显示试验组患者不良反应发生率显著低于头孢曲松钠,差异有统计学意义[RR=0.42,95%CI(0.22,0.78),P=0.006];②对照组为万古霉素,各研究间无统计学异质性(P=0.92,I2=0),采用固定效应模型分析,结果显示试验组患者不良反应发生率显著低于万古霉素,差异有统计学意义[RR=0.54,95%CI (0.31,0.94),P=0.03]。 2.2.4 临床治疗时间 共5项研究报道了临床治疗时间[8-12],各研究间无统计学异质性(P=0.46,I2=0),采用固定效应模型分析,详见图4。Meta分析结果显示,试验组患者临床治疗时间显著短于对照组,差异有统计学意义[SMD=-1.60,95%CI(-1.89,-1.30),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=0.32,I2=0),采用固定效应模型分析,结果显示试验组患者临床治疗时间显著短于头孢曲松钠,差异有统计学意义[SMD=-1.71,95%CI(-2.14,-1.29),P<0.001];②对照组为万古霉素,各研究间无统计学异质性(P=0.36,I2=1%),采用固定效应模型分析,结果显示试验组患者临床治疗时间显著短于万古霉素,差异有统计学意义[SMD=-1.48,95%CI(-1.90,-1.06),P<0.001]。

图4 两组患者临床治疗时间的Meta分析森林图Fig 4 Forest plot of Meta-analysis of clinical treatment time in 2 groups
2.2.5 颅内压变化值 共4项研究报道了颅内压变化值[6-7,9,12],各研究间有统计学异质性(P<0.001,I2=90%),采用随机效应模型分析,详见图5。Meta分析结果显示,试验组患者颅内压变化值显著大于对照组,差异有统计学意义[SMD=-1.78,95%CI(-2.10,-1.47),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=0.48,I2=0),采用固定效应模型分析,结果显示试验组患者颅内压变化值显著大于头孢曲松钠,差异有统计学意义[SMD=-2.57,95%CI(-3.00,-2.14),P<0.001];②对照组为万古霉素,各研究间无统计学异质性(P=0.75,I2=0),采用固定效应模型分析,结果显示试验组患者颅内压变化值显著大于万古霉素,差异有统计学意义[SMD=-0.86,95%CI(-1.33,-0.40),P<0.001]。
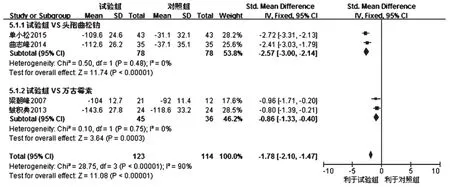
图5 两组患者颅内压变化值的Meta分析森林图Fig 5 Forest plot of Meta-analysis of changes of intracranial pressure in 2 groups
2.2.6 脑脊液蛋白定量变化值 5项研究报道了脑脊液蛋白定量变化值[6-9,12],各研究间无统计学异质性(P=0.16,I2=39%),采用固定效应模型分析,详见图6。Meta分析结果显示,试验组患者脑脊液蛋白定量变化值显著大于对照组,差异有统计学意义[SMD=-0.18,95%CI(-0.25,-0.11),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=1.00,I2=0),采用固定效应模型分析,结果显示试验组患者脑脊液蛋白定量变化值显著大于头孢曲松钠,差异有统计学意义[SMD=-0.47,95%CI(-0.87,-0.07),P=0.02];②对照组为万古霉素,各研究间无统计学异质性(P=0.10,I2=56%),采用固定效应模型分析,结果显示试验组患者脑脊液蛋白定量变化值显著大于万古霉素,差异有统计学意义[SMD=-0.17,95%CI(-0.24,-0.11),P<0.001]。

图6 两组患者脑脊液蛋白定量变化值的Meta分析森林图Fig 6 Forest plot of Meta-analysis of changes of quantitative protein of CSF in 2 groups
2.2.7 脑脊液葡萄糖定量变化值 5项研究报道了脑脊液葡萄糖定量变化值[6-9,12],各研究间有统计学异质性(P<0.001,I2=91%),采用随机效应模型分析,详见图7。Meta分析结果显示,试验组患者脑脊液葡萄糖定量变化值显著大于对照组,差异有统计学意义[SMD=1.77,95%CI(0.91,2.63),P<0.001]。按对照药物不同进一步行亚组分析:①对照组为头孢曲松钠,各研究间无统计学异质性(P=0.99,I2=0),采用固定效应模型分析,结果显示试验组患者脑脊液葡萄糖定量变化值显著大于头孢曲松钠,差异有统计学意义[SMD=1.11,95%CI (0.77,1.45),P<0.001];②对照组为万古霉素,各研究间有统计学异质性(P<0.001,I2=89%),采用随机效应模型分析,结果显示试验组患者脑脊液葡萄糖定量变化值显著大于万古霉素,差异有统计学意义[SMD=2.24,95%CI(1.12,3.36),P<0.001]。
2.3 发表偏倚性分析
以有效率为主要评价指标绘制倒漏斗图,详见图8。由图8可知,纳入研究各数据点分布基本对称,主要集中于倒漏斗的中上部,提示发表偏倚性较小。
3 讨论
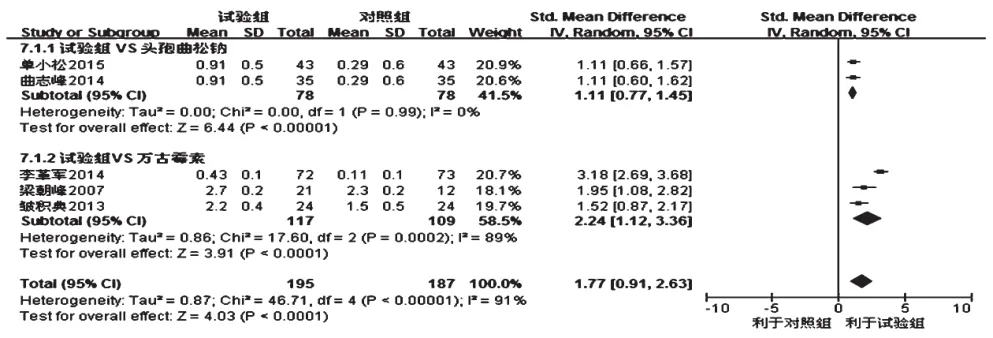
图7 两组患者脑脊液葡萄糖定量变化值的Meta分析森林图Fig 7 Forest plot of Meta-analysis of changes of glucose of CSF in 2 groups

图8 有效率的倒漏斗图Fig 8 Inverted funnel plot of effective rate
美国感染病协会(IDSA)和热病等抗感染指南指出,要想有效清除脑脊液中细菌,需要抗菌药物在脑脊液中的浓度比该药物的最低抑菌浓度(MIC)至少高出数倍[13]。万古霉素穿透血脑屏障能力较差,正常时脑脊液中药物浓度仅为血药浓度的18%,即使有炎症时脑脊液中药物浓度也只有血药浓度的28.6%~48%;鞘内给药能够通过脑脊液的循环将药物送达蛛网膜下腔各个脑室中,使药物弥散在整个脑室系统内[14]。文献报道,单纯静脉使用万古霉素时脑脊液中药物谷浓度为(1.27±0.76)mg/L,对于MIC为1 mg/L的细菌,脑脊液中药物浓度仅勉强达到MIC的1倍以上,但经鞘内给药后,药物谷浓度可达到(28.01±14.12)mg/L[15]。目前,关于万古霉素鞘内注射用量尚无统一标准,有专家建议每日给药剂量为5~20 mg[16]。本文纳入的8项研究中,2项研究万古霉素鞘内注射给药剂量为30 mg/d[5-6],2项研究给药剂量为50 mg/d[9-10],4项研究给药剂量为0.3 mg/(kg·d)[8,11-12]。由于万古霉素不同给药剂量的文献数较少,以此分组进行Meta分析偏倚性较大;其次所有给药剂量均符合万古霉素说明书规定的常规剂量,因此本文未对剂量进行亚组分析。
本研究结果显示,试验组患者有效率、脑脊液细菌清除率均显著高于对照组,临床治疗时间显著短于对照组,不良反应发生率显著低于对照组,颅内压和脑脊液蛋白定量下降幅度显著大于对照组,脑脊液葡萄糖定量增加幅度显著大于对照组,差异均有统计学意义。按对照药物不同进行的亚组分析结果显示,万古霉素联合地塞米松鞘内注射治疗颅内感染的有效率、脑脊液细菌清除率、颅内压及脑脊液蛋白定量下降幅度和脑脊液葡萄糖定量增加幅度均显著大于头孢曲松钠和万古霉素静脉滴注,临床治疗时间显著短于头孢曲松钠和万古霉素静脉滴注,差异均有统计学意义。安全性方面,试验组患者不良反应发生率显著低于对照组,差异有统计学意义。这说明,万古霉素联合地塞米松鞘内注射可以降低不良反应发生率,安全性较好。万古霉素的主要不良反应为耳、肾毒性和过敏反应,鞘内注射不良反应主要为神经根刺激症状和脑积水、脑萎缩等,但未见肝、肾功能损害,听力下降,血细胞异常变化,肢体抽搐及“红人综合征”等严重不良反应。王文波等[9]报道,万古霉素静脉滴注给药治疗颅内感染死亡率为14.3%,鞘内注射给药死亡率为0,提示鞘内注射安全性较好。
综上所述,万古霉素联合地塞米松鞘内注射治疗颅内感染临床疗效较好,可以提高脑脊脑细菌清除率,缩短治疗时间,降低患者颅内压和脑脊液蛋白定量,提高脑脊液葡萄糖定量,且安全性较好。但本研究结果受以下局限的影响:(1)纳入研究均为中文文献,未检索到相关外文文献,可能因为鞘内注射不是万古霉素说明书推荐的给药方式;而FDA尚未批准任何专供鞘内注射给药的抗菌药物。但是,万古霉素鞘内注射成功治疗颅内感染的个案报道已见诸于各类医学期刊[17-19],说明在欧美及日本等发达国家,万古霉素鞘内注射的给药途径也逐渐被临床认可和接受。(2)所有研究均未提及是否采用分配隐藏,可能导致选择性偏倚;(3)除1项研究进行2~3年回访外[9],其余研究均未对院外复发情况进行回访。因此,本文所得结论还有待于多中心、大样本、前瞻性的高质量RCT进一步验证。
[1] 袁宜荣.万古霉素与颅内动脉瘤夹闭术联合治疗颅内动脉瘤患者的疗效[J].抗感染药学,2015,12(1):113-115.
[2] 贾锋,阮舒,伏林山.鞘内注射万古霉素治疗神经外科术后颅内感染患者的疗效观察.[J].中华医院感染学杂志,2013,23(22):5225-5257.
[3] 中华人民共和国卫生部医政司,卫生部合理用药专家委员会.国家抗微生物治疗指南[M].北京:人民卫生出版社,2012:38.
[4] Huang H,Huang S,Zhu P,et al.Continuous versus intermittent infusion of cefepime in neurosurgical patients with postoperative intracranial infections[J].Int J Antimicrob Agents,2014,43(1):68-73.
[5] 单小松,丁亚楠,王冀伟,等.开颅手术后颅内感染患者脑脊液置换联合不同药物鞘内注射治疗的疗效研究[J].中华医院感染学杂志,2015,25(12):2802-2804.
[6] 曲志峰,曲艳春,陈文理,等.脑脊液置换联合万古霉素与地塞米松鞘内注射对术后颅内感染的临床研究[J].中国生化药物杂志,2014,34(2):94-96.
[7] 李革军,孙建中,刘俊超.万古霉素治疗颅脑手术患者术后耐甲氧西林金黄色葡萄球菌颅内感染的临床研究[J].中华医院感染学杂志,2014,24(23):5817-5819.
[8] 梁朝峰,李文胜,何海勇,等.万古霉素治疗耐甲氧西林革兰阳性菌所致颅内感染的疗效观察[J].中国医院药学杂志,2007,27(8):1108-1109.
[9] 王文波,杜贻庆,莫万彬,等.万古霉素与地塞米松联合鞘内注射治疗颅内化脓性感染[J].中国医院药学杂志,2011,31(1):50-52.
[10] 白风云,程文刚,闰晨光,等.腰大池持续引流联合万古霉素与地塞米松鞘内注射治疗颅内术后感染的临床研究[J].中国药物与临床,2014,14(3):371-373.
[11] 邹积典,郭庆雷,侯英芳,等.万古霉素治疗术后耐甲氧西林革兰阳性菌致颅内感染的疗效[J].中华医院感染学杂志,2013,23(12):2893-2896.
[12] 童仲驰,李志峰,黎建先.万古霉素治疗耐甲氧西林革兰阳性菌颅内感染的研究[J].中国实用神经疾病杂志,2010,13(5):16-18.
[13] 包赟,邱炳辉,曾浩,等.万古霉素静脉联合鞘内途径治疗开颅术后颅内感染[J].中华危重病急救医学,2016,28 (2):169-172.
[14] 潘志勇.万古霉素椎管内持续给药的药代动力学研究[D].广州:南方医科大学,2014.
[15] 李志勇,漆松涛,方陆雄,等.不同给药途径万古霉素在脑脊液和血液中药物浓度及疗效比较[J].中国神经精神疾病杂志,2007,33(10):601-604.
[16] 王红,齐文杰,张淑文.临床药物治疗学:感染性疾病[M].8版.北京:人民卫生出版社,2007:247.
[17] Lee K,Rho M,Yu M.et al.A case of recurrent meningitis caused by rhodococcus species successfully treated with antibiotic treatment and in trathecal injection of vancomycin through an ommaya reservoir[J].Inf Chemother,2015,47(3):183-185.
[18] Goto K,Ohi T,Namba A,et al.Successful treatment of methicillin-resistantstaphylococcus aureus meningitis by in trathecal injection of vancomycin[J].Brain Nerve,2011,63(4):417-420.
[19] Matsubara H,Makimoto A,Higa T,et al.Successful treatment of meningoencephalitis caused by methicillin-resistant Staphylococcus aureus withintrathecal vancomycin in an allogeneic peripheral blood stem cell transplant recipient[J].Bone Marrow Transplant,2003,31(1):65-67.
(编辑:申琳琳)
Efficacy and Safety of Intrathecal Injection of Vancomycin Combined with Dexamethasone in the Treatment of Intracranial Infection:A System Review
ZHANG Yuanyuan,ZHANG Xiaoyan,DU Mei,LI Fenglei,WANG Lidan(Dept.of Pharmacy,Harrison International Peace Hospital,Hebei Hengshui 053000,China)
OBJECTIVE:To systematically review the efficacy and safety of intrathecal injection of vancomycin combined with dexamethasone in the treatment of intracranial infection,and to provide evidence-based reference in the clinic.METHODS:Retrieved from PubMed,Medline,CJFD,VIP,Wanfang databases,randomized controlled trials(RCTs)about intrathecal injection of vancomycin combined with dexamethasone in the treatment of intracranial infection were collected.Two reviewers independently screened literature,extracted data and assessed the risk of bias of included studies according to Cochrane system review manual 5.0.1.Then Meta-analysis was conducted by Rev Man 5.2 statistical software.RESULTS:Total of 8 RCTs were included,involving 543 patients.Meta-analysis showed that,compared with intravenous dripping of ceftriaxone or vancomycin,intrathecal injection of vancomycin combined with dexamethasone could significantly increase response rate[RR=1.18,95%CI(1.11,1.26),P<0.001]and bacterial clearance rate of CSF[RR=1.13,95%CI(1.01,1.27),P<0.001]of intracranial infection patients,shortened treatment time[SMD=-1.60,95%CI(-1.89,-1.30),P<0.001],reduce the incidence of ADR[RR=0.48,95%CI(0.32,0.73),P<0.001].At the same time,it also could improve changes of intracranial pressure[SMD=-1.78,95%CI(-2.10,-1.47),P<0.001],changes of protein quantitation of CSF[SMD=-0.18,95%CI(-0.25,-0.11),P<0.001]and changes of glucose quantitation of CSF[SMD=1.77,95%CI(0.91,2.63),P<0.001],with statistical significance.CONCLUSIONS:Intrathecal injection of vancomycin combined with dexamethasone shows good clinical efficacy for intracranial infection,improves bacterial clearance rate,shortens treatment duration,significantly lowers intracranial pressure and protein quantitation,improves glucose quantitation of cerebrospinal fluid,with good safety.
Vancomycin;Dexamethasone;Intracranial infection;Intrathecal injection;System review;Meta-analysis
R96.1
A
1001-0408(2017)12-1665-05
2016-06-02
2017-02-10)
*主管药师。研究方向:医院药学。E-mail:179627353@qq.com
#通信作者:副主任药师。研究方向:临床药学。E-mail:251357259@qq.com
DOI10.6039/j.issn.1001-0408.2017.12.23
