非小细胞肺癌患者化疗前后血清VEGF/血小板数和TGF-β1检测的临床意义
2017-05-16张彦秋刘立杰付占昭付宝红
顾 涛,张彦秋,刘立杰,张 双,张 瑜,付占昭,付宝红
(秦皇岛市第一医院 肿瘤科,河北 秦皇岛066000)
*通讯作者
非小细胞肺癌患者化疗前后血清VEGF/血小板数和TGF-β1检测的临床意义
顾 涛,张彦秋,刘立杰,张 双,张 瑜,付占昭,付宝红*
(秦皇岛市第一医院 肿瘤科,河北 秦皇岛066000)
目的 探讨非小细胞肺癌(NSCLC)患者化疗前后血清VEGF/血小板数和TGF-β1浓度的变化,探讨两者在病情监测中的临床价值。方法 72例NSCLC患者化疗前采用酶联免疫法测定血清VEGF/血小板数和TGF-β1浓度,化疗采用GP方案,连用2周期,治疗结束后1周再次测定血清VEGF/血小板数和TGF-β1浓度,并行胸部CT检查,根据CT结果分为化疗有效组(完全缓解+部分缓解)和无效组(病情稳定+疾病进展),组间比较采用t检验,以P<0.05为差异有统计学意义。结果 NSCLC患者化疗前血清VEGF/血小板数、TGF-β1浓度分别为(0.803±0.078)10-6pg、45.56±4.54 ng/ml,均高于对照组的(0.539±0.027)10-6pg、16.02±2.32 ng/ml,差异有统计学意义(t=19.57、39.56,P<0.05)。不同性别、年龄、病理类型和分化程度NSCLC患者之间血清VEGF/血小板数、TGF-β1浓度接近,差异均无统计学意义(P>0.05)。化疗有效组化疗前血清VEGF/血小板数为(0.810±0.121)10-6pg,化疗后下降至(0.415±0.098)10-6pg,差异有统计学意义(t=16.84,P<0.05);化疗无效组化疗前血清VEGF/血小板数为(0.815±0.104)10-6pg,化疗后浓度明显升高,差异有统计学意义(t=24.42,P<0.05)。化疗有效组化疗前血清TGF-β1浓度为42.57±4.47 ng/ml,化疗后浓度下降至20.75±3.43 ng/ml,差异有统计学意义(t=26.72,P<0.05);化疗无效组化疗前血清TGF-β1浓度为41.90±5.26 ng/ml,化疗后浓度为45.51±4.48 ng/ml,差异有统计学意义(t=2.38,P=0.030)。结论 血清VEGF/血小板数和TGF-β1浓度与肿瘤活动度密切相关,可用于判定NSCLC化疗近期疗效。
非小细胞肺癌;血管内皮生长因子;转化生长因子β1
(ChinJLabDiagn,2017,21:0585)
肺癌的生长、侵袭和转移是一个极其复杂的过程,肿瘤新生血管的生成对肿瘤的生长和转移起了决定性作用。血管内皮生长因子(VEGF)属于血小板衍生生长因子家族,促进血管生成[1]。大量的VEGF存储在血小板内膜,血小板可能是血清VEGF的一个主要来源[2]。转化生长因子β1(TGF-β1)属于TGF-β超家族细胞因子,是一种具有多种细胞功能的分泌蛋白。VEGF和TGF-β1在肿瘤进展过程中高度相关,在肿瘤血管生成中发挥重要的监管作用。VEGF促进肿瘤血管生成,增加肿瘤细胞通过脉管系统进入循环,最终促进肿瘤转移。另一方面,高水平的TGF-β1也激活多种细胞通路促进肿瘤侵袭和转移[3]。本研究探讨血清VEGF/血小板数和TGF-β1浓度在非小细胞肺癌(NSCLC)患者化疗前后的变化,探讨二者预测疗效的临床意义。
1 资料与方法
1.1 研究对象
1.1.1 NSCLC组 选取2013年2月-2015年1月NSCLC患者72例,有完整的临床病理资料。男性49例,女性23例;年龄35-68岁,中位年龄56岁;均符合下列条件:KPS评分≥70分,均经细胞学或病理学证实;血常规、肝肾功能及心电图基本正常。除外合并其他的内科疾病不能接受治疗者、临床资料不全者、妊娠或哺乳期妇女。
1.1.2 正常对照组 50例体检正常健康者来自秦皇岛市第一医院体检中心,其中男28例,女22例,年龄30-66岁,中位年龄49岁,均排除肺部疾病。
1.2 化疗方案
所有患者均应用GP方案化疗:盐酸吉西他滨1 250 mg/m2,第1、8天;顺铂 75 mg/m2,第1-3天;每21天为1个周期,共2个周期。
1.3 血清VEGF/血小板数、TGF-β1检测方法
化疗前1天及2周期化疗结束后1周行血清中VEGF/血小板数和TGF-β1的检测,采用酶联免疫法测定,试剂盒由北京荣志海达生物科技有限公司提供。严格按说明书操作。
1.4 疗效评价
2周期化疗结束后1周复查胸部CT,按照实体瘤疗效评价标准(RECIST)的评定标准进行疗效评估。完全缓解(CR):所有目标病灶消失。部分缓解(PR):基线病灶长径总和缩小≥30%;病变进展(PD):基线病灶长径总和增加≥20%或出现新病灶。病情稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。CR+PR为有效病例,SD+PD为无效病例。
1.5 统计学分析
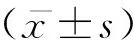
2 结果
2.1 NSCLC组及正常对照组血清VEGF/血小板数和TGF-β1浓度
NSCLC患者化疗前血清VEGF/血小板数、TGF-β1浓度分别为(0.803±0.078)10-6pg、45.56±4.54 ng/ml,均高于正常对照组的(0.539±0.027)10-6pg、16.02±2.32 ng/ml,差异有统计学意义(t=19.57、39.56,P<0.05),见表1。

表1 NSCLC组和正常对照组血清VEGF/血小板数和TGF-β1浓度
2.2 NSCLC患者血清VEGF/血小板数与临床病理因素的关系
VEGF/血小板数与NSCLC患者性别、年龄、肿瘤原发部位、病理类型和分化程度无明显相关性(P>0.05),见表2。
2.3 NSCLC患者血清TGF-β1浓度与临床病理因素关系
血清TGF-β1浓度与NSCLC患者性别、年龄、肿瘤原发部位、病理类型和分化程度无明显相关性(P>0.05),见表3。

表2 NSCLC患者血清VEGF/血小板数与临床病理因素的关系

表3 NSCLC患者血清TGF-β1浓度与临床病理因素的关系
2.4 化疗前后血清VEGF/血小板数、TGF-β1浓度变化与近期疗效的关系
化疗前血清VEGF/血小板数、TGF-β1在有效组(CR+PR)的浓度分别为(0.810±0.121)10-6pg、42.57±4.47 ng/ml,化疗后两者浓度明显下降,分别为(0.415±0.098)10-6pg、20.75±3.43 ng/ml,差异均有统计学意义(t=16.84、26.72,P<0.05),而进展组(SD+PD)血清VEGF/血小板数、TGF-β1浓度并未下降,反而明显升高,差异有统计学意义(P<0.05),见表4、5。

表4 血清VEGF/血小板数在化疗前后的变化

表5 血清TGF-β1在化疗前后的变化
3 讨论
肿瘤血管显著地影响了NSCLC的生长、侵袭和转移[4],而VEGF、TGF-β1在肿瘤血管生成中起着重要的作用[5]。目前研究显示动态检测NSCLC患者血清VEGF/血小板数变化可能有助于化疗疗效的评价。
肿瘤组织确实含有高浓度的VEGF,但由于VEGF储存于血小板膜的a-质粒中,因此血小板数量对循环VEGF水平增高有一定贡献[6]。血小板是血清中VEGF的主要来源,肿瘤患者血小板计数与血清中VEGF水平呈正相关[7,8]。因此本研究采用VEGF/血小板数来排除血小板数本身对本实验的影响。研究结果表明,VEGF/血小板数在NSCLC组明显高于正常组。VEGF通过其对肿瘤血管生成的影响和转移参与肿瘤的生长[9]。VEGF增加了各种蛋白酶的分泌和基质降解酶在肿瘤中的作用,进一步促进肿瘤浸润和转移[10]。
TGF-β1是一种多功能的细胞因子,调节各生理过程,如细胞生长、分化、免疫抑制、细胞外基质沉积和肿瘤发生[11,12]。几项研究表明TGF-β1促进肿瘤转移、血管生成和逃避免疫监视[13]。在肺癌方面,TGF-β1表现为相反的作用方式:在肿瘤生长的早期阶段,它可作为肿瘤抑制剂;在肿瘤晚期阶段,通过刺激肿瘤内血管生成,分泌VEGF为肿瘤生长、浸润和转移提供适宜的条件[14,15]。
动态检测NSCLC患者血清VEGF、TGF-β1浓度可能有助于放疗或化疗效果的评价[12]。Brattström D等[16]对血小板处于正常范围内的73例局部晚期NSCLC患者检测同步放化疗前后血清VEGF的浓度变化,结果显示:NSCLC患者外周血清VEGF浓度明显高于正常对照组,且随疾病的进展其水平亦逐步升高;治疗有效者其外周血清浓度较治疗前明显降低(P<0.05)。Zhao L等[17]对65例不可手术的中晚期NSCLC患者治疗前后血清TGF-β1浓度与同步放化疗疗效的关系进行研究,结果显示:治疗有效组的血清TGF-β1的浓度较治疗前明显下降,治疗后低浓度的TGF-β1明显提高了总有效率、延长了OS及PFS。本研究中,化疗2周期后血清TGF-β1浓度均明显下降,与化疗前比较,提示化疗后肿瘤体积减少。因此,TGF-β1浓度可以作为NSCLC患者生存的一个独立预后因素。本研究显示VEGF/血小板数和TGF-β1浓度在化疗有效组化疗后明显下降,但化疗进展组的结果正好相反,这可能是肿瘤体积变化,相关的肿瘤负荷变化,改变了肿瘤血液中释放的标志物。
本研究结果有一定的局限性。首先,如吸烟状况,BMI和其他呼吸系统疾病可能会改变VEGF/血小板数和血清TGF-β1浓度,进而影响结果的可靠性。其次,研究结果应进一步扩大到其他种族的NSCLC患者。因此,为了得到准确和系统的结果,大样本研究是必要的。
总之,研究结果表明,VEGF和TGF-β1在NSCLC行为中发挥重要作用。二者与NSCLC患者化疗疗效相关,可能成为诊断和预后的临床标志物。
[1]Wang Y,Nakayama M,Pitulescu ME,et al.Ephrin-b2 controls VEGF-induced angiogenesis and lymphangiogenesis[J].Nature,2010,465(7297):483.
[2]Bambace NM,Levis JE,Holmes CE.The effect of P2Y-mediated platelet activation on the release of VEGF and endostatin from platelets[J].Platelets,2010,21(2):85.
[3]Lech-Maranda E,Bienvenu J,Broussais-Guillaumot F,et al.Pretreatment levels of vascular endothelial growth factor in plasma predict a complete remission rate and time to relapse or progression in patients with diffuse large b-cell lymphoma[J].Arch Immunol Ther Exp,2013,61(2):165.
[4]Molina JR,Yang P,Cassivi SD,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin Proc,2008,83(5):584.
[5]Huang L,Jia J,Liu R.Decreased serum levels of the angiogenic factors VEGF and TGF-beta1 in Alzheimer’s disease and amnestic mild cognitive impairment[J].Neurosci Lett,2013,550:60.
[6]Seo HY,Park JM,Park KH,et al.Prognostic significance of serum vascular endothelial growth factor per platelet count in unresectable advanced gastric cancer patients[J].Jpn J Clin Oncol,2010,40(12):1147.
[7]Peterson JE,Zurakowski D,Italiano Jr JE,et al.VEGF,PF4 and PDGF are elevated in platelets of colorectal cancer patients[J].Angiogenesis,2012,15(2):265.
[8]Koukourakis MI,Limberis V,Tentes I,et al.Serum VEGF levels and tissue activation of VEGFR2/KDR receptors in patients with breast and gynecologic cancer[J].Cytokine,2011,53(3):370.
[9]Heng DY,Mackenzie MJ,Vaishampayan UN,et al.Primary anti-vascular endothelial growth factor (VEGF)-refractory metastatic renal cell carcinoma:clinical characteristics,risk factors,and subsequent therapy[J].Ann Oncol:Off J Eur Soc Med Oncol ESMO,2012,23(6):1549.
[10]Shibuya M.Vascular endothelial growth factor (VEGF) and its receptor (VEGFR) signaling in angiogenesis:a crucial target for anti- and pro-angiogenic therapies[J].Genes Cancer,2011,2(12):1097.
[11]Takai E,Tsukimoto M,Kojima S.TGF-beta1 downregulates COX-2 expression leading to decrease of PGE2 production in human lung cancer A549 cells,which is involved in fibrotic response to TGF-beta1[J].PLoS One,2013,8(10):e76346.
[12]Hou Y-L,Chen H,Dong Z-H,et al.Clinical significance of serum transforming growth factor-β1 in lung cancer[J].Cancer Epidemiol,2013,37(5):750.
[13]Kumar S,Guleria R,Mohan A,et al.Efficacy of plasma TGF-beta1 level in predicting therapeutic efficacy and prognosis in patients with advanced non-small cell lung cancer[J].Cancer Investig,2011,29(3):202.
[14]Lim MJ,Lin T,Jakowlew SB.Signaling mechanisms of transforming growth factor-β (TGF-β) in cancer:TGF-β induces apoptosis in lung cells by a smad- dependent mechanism[J].Tumor Suppressor Genes,2012,145:123.
[15]Maitah MY,Ali S,Ahmad A,Gadgeel S,et al.Up-regulation of sonic hedgehog contributes to TGF-beta1-induced epithelial to mesenchymal transition in NSCLC cells[J].PLoS One,2011,6(1):e16068.
[16]Brattström D,Bergqvist M,Hesselius P,et al.Serum VEGF and bFGF adds prognostic information in patients with normal platelet counts when sampled before,during and after treatment for locally advanced non-small cell lung cancer[J].Lung Cancer,2004,43(1):55.
[17]Zhao L,Ji W,Zhang L,et al.Changs of circulating transforming growth factor-beta1 level during radiation therapy are correlated with the prognosis of locally advanced non-small lung cancer[J].J Thorac Oncol,2010,5(4):521.
Clinical significance of serum VEGF/platelet count and TGF- beta 1 in patients with non-small cell lung cancer before and after chemotherapy
GUTao,ZHANGYan-qiu,LIULi-jie,etal.
(DepartmentofOncology,theFirstHospitalofQinhuangdao,Qinhuangdao066000,China)
Objective To investigate the changes of serum VEGF/platelet count and TGF- beta 1 in patients with NSCLC before and after chemotherapy and to explore their clinical value as biomarkers.Methods A total of 122 subjects were recruited at the First Hospital of Qinhuangdao between February 2013 and January 2015,including 72 NSCLC patients receiving chemotherapy (NSCLC group) and 50 healthy controls (control group).All NSCLC patients received gemcitabine plus cisplatin (GP regimen) for a total of two courses.Serum VEGF/platelet count and TGF- beta 1 were measured before and after chemotherapy using enzyme-linked immunosorbent assay (ELISA).NSCLC group was categorized into complete response (CR) plus partial response(PR) group and stable disease(SD) plus progressive disease(PD) group based on the results of CT scans obtained 1 week after chemotherapy.Results Serum VEGF/platelet count and TGF-beta 1 were significantly higher in NSCLC group before chemotherapy compared to the control group (VEGF/ platelet count,0.803±0.078 vs 0.539±0.027;t=19.57;P<0.05 and TGF-β1,45.56±4.54 vs 16.02±2.32;t=39.56;P<0.05).There were no significant differences in serum VEGF/platelet count and TGF- beta 1 in patients with different gender,age,pathological type and differentiation degree(P>0.05).Importantly,serum VEGF/platelet count and TGF-beta 1 decreased significantly after chemotherapy in CR+PR group in comparison with before chemotherapy (VEGF/platelet count,0.415±0.098 vs 0.810±0.121;t=16.84;P<0.05 and TGF-β1,20.75±3.43 vs 42.57±4.47;t=26.72;P<0.05).By contrast,serum VEGF/platelet count and TGF- beta 1 were markedly higher after chemotherapy in the SD+PD group in comparison with before chemotherapy (VEGF/platelet count,0.815±0.104 vs 1.178±0.106;t=24.42;P<0.05 and TGF-β1,41.90±5.26 vs 45.51±4.48;t=2.38;P=0.030).Conclusion Serum VEGF/ platelet count and TGF- beta 1 are closely related to tumor activity,which can be used to determine the short-term efficacy of NSCLC chemotherapy.
NSCLC;VEGF;TGF-β1
1007-4287(2017)04-0585-04
R734.2
A
2016-10-05)
