多系统萎缩伴抗利尿激素分泌不当综合征三例临床分析
2017-05-16谢曼青张燕王含崔丽英
谢曼青 张燕 王含 崔丽英
·帕金森病及运动障碍性疾病·
多系统萎缩伴抗利尿激素分泌不当综合征三例临床分析
谢曼青 张燕 王含 崔丽英
研究背景多系统萎缩是主要累及锥体外系、小脑和自主神经系统的神经变性病,临床主要表现为帕金森综合征、小脑共济失调、自主神经功能障碍等,亦可累及下丘脑及其联系纤维,导致抗利尿激素分泌不当综合征和低钠血症。本研究总结多系统萎缩伴抗利尿激素分泌不当综合征的临床特点,以为临床诊断与治疗提供依据。方法回顾分析2011-2015年在北京协和医院神经科门诊和住院治疗的3例多系统萎缩伴抗利尿激素分泌不当综合征患者的临床表现、实验室和影像学特点及诊断与治疗经过。结果3例多系统萎缩患者中2例为以帕金森综合征为主要表现型,1例为以小脑共济失调为主要表现型;均合并严重低钠血症,血清钠最低为123、118和121 mmol/L,24 h尿钠分别为91、114和129 mmol/L,1例明确诊断为抗利尿激素分泌不当综合征,2例可疑抗利尿激素分泌不当综合征;2例合并感染,1例为嗜肺军团菌感染、1例为肺部感染,予抗感染和限水补钠对症支持治疗后预后良好,余1例至疾病终末期出现顽固性低钠血症而死亡。结论多系统萎缩自身或合并感染可能是抗利尿激素分泌不当综合征的易感因素,应加强对多系统萎缩患者水钠平衡的管理。多系统萎缩伴抗利尿激素分泌不当综合征临床罕见,一旦出现顽固性低钠血症则提示预后不良。
多系统萎缩;ADH分泌不当综合征;低钠血症
多系统萎缩(MSA)是主要累及锥体外系、小脑和自主神经系统的神经变性病,临床主要表现为帕金森综合征、小脑共济失调、自主神经功能障碍。其自然病程较帕金森病进展迅速,早期易出现姿势不稳,常合并延髓功能障碍和呼吸功能障碍[1],一般于首发症状出现后7~8年死亡。研究显示,多系统萎缩亦可累及下丘脑及其联系纤维[2],导致抗利尿激素分泌不当综合征(SIADH)和低钠血症(hyponatremia)[3]。北京协和医院2011-2015年共诊断与治疗128例多系统萎缩患者,其中3例合并严重低钠血症,1例明确诊断为抗利尿激素分泌不当综合征、2例可疑抗利尿激素分泌不当综合征。多系统萎缩的诊断均符合2008年多系统萎缩诊断第2次共识声明[4],低钠血症和抗利尿激素分泌不当综合征的诊断均符合2014年欧洲低钠血症诊断与治疗临床实践指南[5]。本研究回顾分析上述3例患者的临床资料,以为临床诊断与治疗提供依据。
临床资料
例1男性,62岁,因发热、腹泻5 d,于2014年6月3日入院。患者入院前2~3年逐渐出现步态障碍、行走缓慢和体位性低血压,并未予以重视。入院前5 d无明显诱因出现发热,体温最高达42℃,热峰多出现于上午,无畏寒、寒战;全身乏力,腹泻,排腥臭味黄色水样便,6~7次/d,无腹痛、脓血便、里急后重,1~2 d后自行停止;无咳嗽、咳痰。为求进一步诊断与治疗,至我院就诊。患者既往可疑结缔组织病病史,否认低钠血症病史,个人史及家族史无特殊。入院后体格检查:神志清楚,语言流利,对答切题,面部表情尚可,脑神经检查未见明显异常,四肢肌力5级、肌张力增高,上肢呈齿轮样,左手指鼻试验可见意向性震颤,共济运动和深浅感觉未见明显异常,双侧掌颌反射阳性、Babinski征阴性,可疑颈项抵抗,颏胸距2~3横指。实验室检查:血清钠最低为123 mmol/L(135~145 mmol/L),24 h尿钠为91 mmol/L,血浆晶体渗透压280 mOsm/(kg·H2O)[275~300 mOsm/(kg·H2O)],尿渗透压表达水平457 mOsm/(kg·H2O),血清甲状腺功能试验和肾上腺相关激素均于正常值范围,血清嗜肺军团菌抗体IgM可疑阳性。影像学检查:头部MRI显示颅内多发异常信号,提示脑小血管病可能(图1)。临床诊断为以帕金森综合征为主要表现的多系统萎缩(MSA⁃P型)伴抗利尿激素分泌不当综合征。予厄他培南1 g/d(×2周)和莫西沙星0.40 g/d(×4周)静脉滴注抗感染,以及限水补钠等对症支持治疗,2周后复查血清钠逐渐恢复至正常水平,但仍时有波动。患者共住院56 d,出院时仍有发热、热峰有所下降(38℃),血清钠于正常值下限。出院后门诊随访4月余,体温逐渐降至正常水平,复查血清钠恢复至正常值范围。
例2男性,59岁,主因间断性意识障碍伴发热9 d,于2011年7月19日入院。患者入院前4年逐渐出现头晕、行走不稳、饮水呛咳、尿失禁,当地医院诊断为以小脑共济失调为主要表现的多系统萎缩(MSA⁃C型),未予特殊治疗。入院前9 d出现嗜睡,伴发热、纳差,自行服用阿莫西林等药物未见明显好转,意识障碍进行性加重至呼之不应,遂至当地医院急诊就诊,体格检查可闻及双肺大量痰鸣音,动脉血气分析二氧化碳分压(PaCO2)为94 mm Hg(1 mm Hg=0.133 kPa),予气管插管呼吸机辅助通气,以及头孢哌酮钠、舒巴坦钠和阿奇霉素抗感染治疗(具体方案不详)。胸部CT显示双下肺感染并膨胀不全。为求进一步诊断与治疗,至我院就诊。患者既往无低钠血症病史。入院后继续呼吸机辅助通气,并于2011年7月25日行气管切开术,根据病原学检查结果和药敏试验调整抗感染治疗方案,胸部CT提示肺部感染较前明显改善,拔除气管插管。体格检查:神志清楚,构音欠清晰,脑神经检查未见明显异常,四肢肌力4级、肌张力正常,双侧指鼻试验和快复轮替动作笨拙,Romberg征阳性,深浅感觉未见明显异常,左侧Babinski征可疑阳性,脑膜刺激征阴性。实验室检查:血清钠最低118 mmol/L,24 h尿钠114 mmol/L,甲状腺功能试验和肾上腺相关激素于正常值范围。影像学检查:头部MRI检查可疑脑干和小脑萎缩(图2)。临床诊断为MSA⁃C型可疑伴抗利尿激素分泌不当综合征。予抗感染(根据药敏试验调整药物和剂量),以及适度限水补钠治疗,约15 d后血清钠恢复至正常水平。患者共住院31 d,出院时体温降至正常水平,咳少量黄色粘痰,双肺未闻及干湿啰音,血清钠恢复至正常值范围。出院后失访。
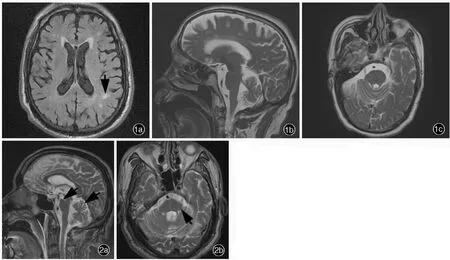
图1 头部MRI检查显示,颅内多发异常信号,提示脑小血管病可能1a横断面FLAIR成像显示,侧脑室旁白质散在斑片样高信号(箭头所示)1b矢状位T2WI显示,脑桥腹侧轻度萎缩,小脑蚓部脑沟轻度增宽,未见明显萎缩1c横断面T2WI未见脑桥“十字征”图2头部MRI检查显示,脑桥腹侧锐利,可疑萎缩,小脑蚓部脑沟增宽呈“羽毛”样(箭头所示),提示萎缩2a矢状位T2WI 2b横断面T2WIFigure 1 Head MRI showed multiple abnormal signals, suggesting the possibility of cerebral small vessel disease. Axial FLAIR showed sporadic patchy white matter hyperintensity in the periventricular areas(arrow indicates,Panel 1a).Sagittal T2WI showed mild atrophy of ventral pons,mild widening of sulci in cerebral vermis without obvious atrophy(Panel 1b).Axial T2WI showed no obvious"cross sign"in the pons(Panel 1c).Figure 2 Head MRI revealed suspicious atrophy of ventral pons,widening of sulci(penniform)in cerebral vermis(arrows indicate),suggesting atrophy.Sagittal T2WI(Panel 2a).Axial T2WI(Panel 2b).
例3男性,53岁,主因大小便障碍、性功能障碍5年,动作迟缓3年,于2015年7月7日至我院门诊就诊。外院行头部MRI检查显示,双侧颞叶萎缩,尤以左侧显著,脑干和小脑形态未见明显改变;诊断为帕金森综合征,予抗帕金森病药物试验性治疗:多巴丝肼(美多芭)187.50 mg/次(4次/d)和盐酸普拉克索0.375 mg/次(3次/d)口服,效果欠佳。门诊体格检查:阵发性抽泣样呼吸,神志清楚,语言欠流利,表情呆板,眼动不充分,其余脑神经检查未见明显异常,四肢肌力5级、肌张力增高,腱反射对称引出,双侧快复轮替动作笨拙,尤以左侧显著,深浅感觉未见明显异常,双侧Babinski征阳性,脑膜刺激征阴性。结合外院头部影像学检查,临床诊断为MSA⁃P型,建议完善肛门括约肌肌电图等检查(患者未能完善),并继续予多巴胺能药物治疗。此后电话随访,患者于2015年7月底在当地医院诊断为低钠血症,血清钠最低为121 mmol/L,24 h尿钠为129 mmol/L,甲状腺功能试验和肾上腺相关激素均于正常值范围,感染指标和肿瘤标志物筛查未见明显异常,考虑可疑抗利尿激素分泌不当综合征,予限水补钠对症支持治疗,低钠血症难以纠正,于2015年9月死亡。
讨论
抗利尿激素(ADH)又称血管升压素,是由下丘脑视上核和室旁核神经细胞分泌的九肽激素,其主要作用是提高肾小管远曲小管和集合管对水分子的通透性,促进水分子吸收,是尿液浓缩和稀释的关键性调节激素。抗利尿激素主要受外因调控,如血浆晶体渗透压、循环血容量和动脉压,血浆晶体渗透压升高,可以引起抗利尿激素分泌增多;循环血容量增加、动脉压升高,可以反射性抑制抗利尿激素释放。抗利尿激素分泌不当综合征是抗利尿激素未遵循血浆晶体渗透压调节而分泌异常增多,出现体内水潴留、尿钠排出增加和稀释性低钠血症等一系列临床表现的综合征,其典型特点是低张性低钠血症[6],常见诱发因素包括恶性肿瘤(如小细胞肺癌)、肺部疾病(如肺炎)和中枢神经系统疾病(如蛛网膜下隙出血)等[7]。限水是目前一线治疗方法,若反应不佳,可考虑抗利尿激素受体阻断剂[8⁃9]。

表1 文献报道的7例多系统萎缩伴抗利尿激素分泌不当综合征患者的临床资料[14⁃16]Table 1.Clinical data of 7 patients with MSA and SIADH reported before[14⁃16]
多系统萎缩是致死性神经变性病,组织病理学核心特点是错误折叠的α⁃突触核蛋白(α⁃Syn)在神经胶质细胞中异常沉积[10]。多系统萎缩各临床亚型虽有不同的基因异质性,但病理改变并无明显差异[11]。散发病例多见,家系罕见,目前尚缺乏有效治疗方法,尚待进一步对病理生理学和分子遗传学机制进行研究,以探寻特异性治疗的突破点[12⁃13]。多系统萎缩多伴显著的自主神经系统症状,如体位性低血压、大小便障碍等。有研究显示,多系统萎缩患者分泌抗利尿激素的下丘脑神经元存在不同程度的选择性减少,很有可能与体位性低血压密切相关[2]。
目前关于多系统萎缩与抗利尿激素分泌不当致低钠血症关系的报道尚不多见,最早见于1992年Nagumo等[14]报告的多系统萎缩伴抗利尿激素分泌不当综合征。迄今7例报道均来自日本,临床资料参见表1[14⁃16]:男性4例,女性3例;年龄52~76岁,平均(61±8)岁;病程1.50~11.00年,平均(7.07± 3.17)年;尿渗透压304~722 mOsm/(kg·H2O),平均为(437±153)mOsm/(kg·H2O);血清钠水平99~127 mmol/L,平均水平(117±9)mmol/L;血浆晶体渗透压为205~262 mOsm/(kg·H2O),平均为(244± 20)mOsm/(kg·H2O);MSA⁃P型4例,MSA⁃C型3例;既往曾植入心脏起博器1例,合并肺炎1例、肾盂肾炎1例、发热1例、窒息1例,其中合并肺炎的患者病情最重,血清钠最低至99 mmol/L,需气管插管呼吸机辅助通气,且预后较差;既往服用抗帕金森病药物5例,未服用2例。国内尚未见多系统萎缩伴抗利尿激素分泌不当综合征的文献报道。北京协和医院神经科在2011-2015年诊断与治疗的128例多系统萎缩患者中发现3例伴抗利尿激素分泌不当综合征,提示该病临床罕见,其中2例合并感染,1例(例1)可疑嗜肺军团菌感染,低钠血症在军团菌感染导致的疾病中十分常见,发生率达46%[17],但低钠血症是否由抗利尿激素分泌不当综合征所致,目前尚无定论[18],结合该例患者临床表现符合抗利尿激素分泌不当综合征,且经积极抗感染治疗后仍存在较长时间的低钠血症,故不能排除其基础疾病多系统萎缩是低钠血症的易感因素;1例(例2)合并严重肺部感染,经抗感染和对症支持治疗后,血清钠迅速恢复至正常水平,故该例患者低钠血症的原因首先考虑感染;余1例(例3)死亡前2个月出现顽固性低钠血症,对各种治疗方法均反应欠佳,因此,一旦多系统萎缩患者出现顽固性低钠血症即提示其很可能处于病程终末期,预后较差。此外,多系统萎缩本身或合并感染可能是抗利尿激素分泌不当综合征的易感因素,故应加强对多系统萎缩患者水钠平衡的管理。多系统萎缩合并感染患者出现低钠血症和抗利尿激素分泌不当综合征的概率与普通感染患者是否存在差异,目前尚无相关文献报道,有待进一步研究。
多系统萎缩伴抗利尿激素分泌不当综合征的具体机制目前尚不清楚。有研究显示,可能与脑干对下丘脑的传入刺激减弱有关,从而导致下丘脑抗利尿激素能神经元超敏化,引起抗利尿激素分泌增多[19]。抗利尿激素不仅在水钠平衡和体位性低血压方面与多系统萎缩密切相关,而且可以直接作用于中枢神经系统并全面调节交感神经活性[20]。此外,有研究显示,多系统萎缩患者行直立倾斜试验时血清抗利尿激素水平升高程度较正常对照者降低,可为早期诊断多系统萎缩提供参考[21]。由此可见,抗利尿激素与多系统萎缩关系密切,二者的复杂关系尚待进一步深入研究。
综上所述,多系统萎缩自身或合并感染可能是抗利尿激素分泌不当综合征的易感因素,对多系统萎缩患者的水钠平衡应加强管理。多系统萎缩伴抗利尿激素分泌不当综合征临床罕见,一旦出现难以纠正的低钠血症则提示预后不良。
[1]Stefanova N,Bücke P,Duerr S,Wenning GK.Multiple system atrophy:an update.Lancet Neurol,2009,8:1172⁃1178.
[2]Benarroch EE,Schmeichel AM,Sandroni P,Low PA,Parisi JE. Differential involvement of hypothalamic vasopressin neurons in multiple system atrophy.Brain,2006,129:2688⁃2696.
[3]Sone H,Okuda Y,Bannai C,Suzuki S,Yamaoka T,Asakura Y, Kawakami Y,Odawara M,Matsushima T,Kawai K,Yoshizawa T,Mizusawa H,Yamashita K.Syndrome of inappropriate secretion of antidiuretic hormone(SIADH)and Gerhardt syndrome associated with Shy⁃Drager syndrome.Intern Med, 1994,33:773⁃778.
[4]Gilman S,Wenning GK,Low PA,Brooks DJ,Mathias CJ, Trojanowski JQ,Wood NW,Colosimo C,Dürr A,Fowler CJ, Kaufmann H,Klockgether T,Lees A,Poewe W,Quinn N, Revesz T,Robertson D,Sandroni P,Seppi K,Vidailhet M. Second consensus statement on the diagnosis of multiple system atrophy.Neurology,2008,71:670⁃676.
[5]Spasovski G,Vanholder R,Allolio B,Annane D,Ball S,Bichet D,Decaux G,Fenske W,Hoorn EJ,Ichai C,Joannidis M, Soupart A,Zietse R,Haller M,van der Veer S,Van Biesen W, Nagler E;Hyponatraemia Guideline Development Group. Clinical practice guideline on diagnosis and treatment of hyponatraemia.Eur J Endocrinol,2014,170:G1⁃47.
[6]Mocan M,Terheş LM,Blaga SN.Difficulties in the diagnosis and management of hyponatremia.Clujul Med,2016,89:464⁃469.
[7]Grant P,Ayuk J,Bouloux PM,Cohen M,Cranston I,Murray RD,Rees A,Thatcher N,Grossman A.The diagnosis and management of inpatient hyponatraemia and SIADH.Eur J Clin Invest,2015,45:888⁃894.
[8]Aylwin S,Burst V,Peri A,Runkle I,Thatcher N."Dos and don'ts"in the management of hyponatremia.Curr Med Res Opin,2015,31:1755⁃1761.
[9]Verbalis JG,Adler S,Schrier RW,Berl T,Zhao Q,Czerwiec FS; SALT Investigators.Efficacy and safety of oral tolvaptan therapy in patients with the syndrome of inappropriate antidiuretic hormone secretion.Eur J Endocrinol,2011,164:725⁃732.
[10]Jellinger KA.Neuropathology of multiple system atrophy:new thoughts about pathogenesis.Mov Disord,2014,29:1720⁃1741.
[11]Ubhi K,Low P,Masliah E.Multiple system atrophy:a clinical and neuropathological perspective.Trends Neurosci,2011,34: 581⁃590.
[12]Fernagut PO,Dehay B,Maillard A,Bezard E,Perez P,Pavy⁃Le Traon A,Rascol O,Foubert⁃Samier A,Tison F,Meissner WG. Multiple system atrophy:a prototypical synucleinopathy for disease⁃modifying therapeutic strategies.Neurobiol Dis,2014, 67:133⁃139.
[13]Gu WH.Diagnosis and therapy of multiple system atrophy. Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2012,12:257⁃260.[顾卫红.多系统萎缩的诊断与治疗.中国现代神经疾病杂志,2012,12:257⁃260.]
[14]Nagumo K,Kita K,Kitano K,Simoe Y,Furumoto H.Shy⁃Drager syndrome and the syndrome of inappropriate secretion of antidiuretic hormone.Rinsho Shinkeigaku,1992,32:177⁃181.
[15]Samukawa M,Hirano M,Sakanoto H,Kitada M,Kusunoki S, Nakamura Y.Risks of inappropriate secretion of antidiuretic hormone in multiple system atrophy.Mov Disord,2011,26:2572⁃2573.
[16]Endo K,Shirai K,Sakakibara R.Multiple system atrophy and the syndrome of inappropriate secretion of antidiuretic hormone. Mov Disord,2008,23:1325⁃1326.
[17]Fiumefreddo R,Zaborsky R,Haeuptle J,Christ⁃Crain M, Trampuz A,Steffen I,Frei R,Muller B,Schuetz P.Clinical predictors for Legionella in patients presenting with community⁃acquired pneumonia to the emergency department.BMC Pulm Med,2009,9:4.
[18]Schuetz P,Haubitz S,Christ⁃Crain M,Albrich WC,Zimmerli W,Mueller B;ProHOSP Study Group.Hyponatremia and anti⁃diuretic hormone in Legionnaires'disease.BMC Infect Dis, 2013,13:585.
[19]Sahu A,Dube MG,Kalra SP,Kalra PS.Bilateral neural transections at the level of mesencephalon increase food intake and reduce latency to onset of feeding in response to neuropeptide Y.Peptides,1988,9:1269⁃1273.
[20]Suzuki S,Imaizumi T.Vasopressin in central cardiovascular regulation.Saishin Igaku,1991,46:90.
[21]Deguchi K,Sasaki I,Touge T,Tsukaguchi M,Takeuchi H, Kuriyama S.Abnormal baroreceptor⁃mediated vasopressin release as possible marker in early diagnosis of multiple system atrophy.J Neurol Neurosurg Psychiatry,2004,75:110⁃115.
Multiple system atrophy with syndrome of inappropriate antidiuretic hormone secretion:clinical analysis on three cases
XIE Man⁃qing1,ZHANG Yan1,WANG Han1,CUI Li⁃ying1,2
1Department of Neurology,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100730,China
2Neurosciences Center,Chinese Academy of Medical Sciences,Beijing 100730,China
Corresponding author:WANG Han(Email:wanghanpumch@163.com)
BackgroundMultiple system atrophy(MSA)is a neurodegenerative disorder affecting motor(either extrapyramidal or cerebellar)and autonomic nervous systems.The main clinical manifestations of MSA are parkinsonism,cerebellar ataxia and autonomic dysfunction.It may also affect the hypothalamus and related fibers,resulting in syndrome of inappropriate antidiuretic hormone secretion (SIADH)and hyponatremia.This study aims to identify the clinical characteristics of MSA with SIADH,so as to provide evidence for clinical diagnosis and treatment.MethodsClinical manifestations,laboratory examinations and imaging features,diagnosis and treatment of 3 MSA patients with SIADH in our hospital from 2011 to 2015 were retrospectively analyzed.ResultsAmong 3 MSA patients,2 cases were parkinsonism⁃predominant(MSA⁃P)and the other one was cerebellar⁃predominant(MSA⁃C).All of them presented severe hyponatremia.The lowest serum sodium concentration was 123,118 and 121 mmol/L, respectively.The level of urinary sodium concentration was 91,114 and 129 mmol/L,respectively.One was diagnosed as definite SIADH,and the other 2 cases were possible SIADH.Two cases were complicated with infection(one Legionella pneumophila and one pulmonary infection),which was greatly improved after anti⁃infection treatment and sodium supplement.The other case died of refractory hyponatremia in the end.ConclusionsMSA patients with autogenous or concurrent infection may besusceptible to SIADH,therefore water⁃sodium balance management is important for MSA patients.MSA with SIADH is rare,and refractory hyponatremia may indicate a poor prognosis.
Multiple system atrophy;Inappropriate ADH syndrome;Hyponatremia
2016⁃12⁃26)
10.3969/j.issn.1672⁃6731.2017.02.009
100730中国医学科学院北京协和医学院北京协和医院神经科(谢曼青,张燕,王含,崔丽英);100730北京,中国医学科学院神经科学中心(崔丽英)
王含(Email:wanghanpumch@163.com)
