自身免疫性肝炎患者外周血CD8+T细胞PD-1表达水平变化
2017-05-15芮志莲
芮志莲
自身免疫性肝炎患者外周血CD8+T细胞PD-1表达水平变化
芮志莲
目的探讨自身免疫性肝炎(AIH)患者外周血CD8+T细胞程序性死亡因子(PD-1)表达水平的变化。方法随机选取我院收治的AIH患者25例和健康志愿者25例,使用流式细胞仪进行检测外周血CD8+T淋巴细胞PD-1分子和PD-1分子受体(PD-L1)表达水平。结果与健康人比,AIH血CD8+T细胞PD-1/PD-L1表达阳性百分比分别为(2.6±0.1)%和(2.1±0.8)%,明显高于健康人【(0.5±0.2)%和(0.4±0.1)%,P<0.01);10例男性AIH患者血CD8+T细胞PD-1/PD-L1表达阳性百分比分别为(1.4±0.5)%和(2.3±0.6)%,显著低于15例女性患者【(3.8±0.8)%和(2.5±0.5)%),P<0.05);经皮质激素治疗4 w,25例AIH患者获得病情缓解。AIH患者在缓解期PD-1/PD-L1表达水平分别为(3.3±0.2)%和(2.8±0.3)%。结论AHI患者外周血CD8+T细胞PD-1表达水平升高,与疾病活动可能存在密切的关系。
自身免疫性肝炎;CD8+T细胞;程序性死亡因子-1;程序性死亡因子受体-1
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种复杂的免疫损伤性疾病,其病因和发病机理至今尚不明确。有学者认为其发病与遗传易感和病毒感染等多方面因素有关[1-3]。研究发现,人体存在一种调节T细胞分化和活化抑制传导信号的共刺激分子,即程序性死亡因子(programmed death-l,PD-1)[4]。由于PD-1可以通过与其配体(programmed death ligand 1,PD-L1)的互相作用,使得效应性或记忆性T淋巴细胞功能和首次免疫应答水平降低,起到抑制免疫反应的作用[5]。病毒性疾病的进展过程与PD-1信号通路密切相关。PD-1还与糖尿病、系统性红斑狼疮等多种自身免疫性疾病的进展有关[6,7]。本研究检测了AIH患者血CD8+T淋巴细胞PD-1表达水平,以探讨PD-1在AIH发病过程中的作用。
1 资料与方法
1.1 临床资料2013年1月~2015年12月我院收治的AIH患者25例,男10例,女15例;平均年龄为42.2±1.7岁。根据2010年美国肝病学会(AASLD)更新的有关AIH治疗指南以及2008年国际自身免疫性肝炎小组(IAIHG)提出的AIH简化诊断积分系统进行临床诊断。其中8例患者经服用泼尼松龙后症状有所缓解,其余17例患者由于病情发展至晚期,故未行相应免疫抑制剂治疗。排除遗传代谢性、药物性和酒精性肝病以及肝炎病毒感染患者。另选健康人25例,男10例,女15例;平均年龄为28.8±6.7岁。
1.2 外周血CD8+T淋巴细胞PD-1表达水平检测抽取空腹外周静脉血3 ml,经肝素抗凝。另取3支试管,取全血100 μl,分别加入小鼠抗人CD3-FITC、抗CD8-APC和抗PD-1-PE单克隆抗体(美国BD公司)10 μl,于4℃避光环境下孵育30 min,加入10倍稀释后的红细胞裂解液2 ml,室温避光静置15 min。待红细胞完全溶血后,加入缓冲液,重复洗涤3次。另取2%多聚甲醛300 μl重悬细胞,立刻上流式细胞仪检测,应用BD Cell Quest软件对数据进行分析。
1.3 统计学处理应用SPSS 19.0软件分析,计量资料以±s表示,两组间比较采用两独立样本的t检验,以P<0.05表示两组间差异有统计学意义。
2 结果
2.1 两组人群外周血CD8+T细胞PD-1/PD-L1表达水平比较与健康人比,AIH患者血CD8+T细胞PD-1和PD-L1分子阳性百分比均显著升高(P<0.01,表1)。
表1 两组人群外周血CD8+T细胞PD-1/PD-L1表达水平(%,±s)比较
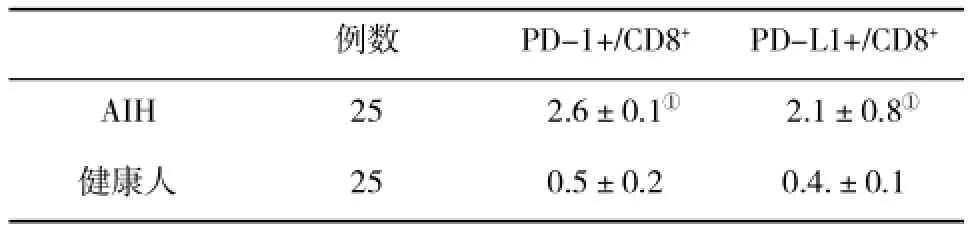
表1 两组人群外周血CD8+T细胞PD-1/PD-L1表达水平(%,±s)比较
与健康人比,①P<0.01
例数PD-1+/CD8+PD-L1+/CD8+AIH252.6±0.1①2.1±0.8①健康人250.5±0.20.4.±0.1
2.2 不同性别AIH患者血CD8+T细胞PD-1/PD-L1表达水平比较10例男性AIH患者血CD8+T细胞PD-1/PD-L1表达阳性百分比分别为(1.4±0.5)%和(2.3±0.6)%,显著低于15例女性患者【(3.8±0.8)%和(2.5±0.5)%),P<0.05)。
2.3 不同疾病分期AIH患者血CD8+T细胞PD-1/PD-L1表达水平比较给予所有患者强的松0.8~1.0 mg·kg-1·d-1治疗,4周后逐渐减量。所有患者经治疗后谷丙转氨酶降低,球蛋白及胆红素水平下降,达到缓解。AIH患者在缓解期PD-1/PD-L1表达水平分别为(3.3±0.2)%和(2.8±0.3)%。
3 讨论
PD-1是最近新发现的CD28家族中的一种抑制传导信号的共刺激分子,它不仅具有调节T细胞分化的功能,可以活化T淋巴细胞[8,9]。尽管PD-1共刺激分子与细胞毒性T淋巴细胞抗原4在氨基酸分子结构上面具有23%的同源性,但在表达方面PD-1却与其很不一致,在活化的B细胞、T细胞和髓系细胞上PD-1具有更多的表达[10],提示在免疫调节方面PD-1比CTLA-4作用范围更广。由于PD-1可以与其配体PD-L1互相作用,通过细胞胞浆尾部免疫受体,使得效应性或记忆性T淋巴细胞功能和首次免疫应答水平降低,从而起到负性调控抑制免疫反应的作用[11,12]。有大量的实验观察证明PD-1不仅对T细胞细胞因子的分泌、增殖方面起到抑制作用,而且对T细胞的免疫杀伤能力等方面也存在一定程度的抑制,故通过阻断上述免疫抑制通路便可以在一定程度上恢复T细胞的功能[13,14]。病毒特异性CD8+T细胞PD-1表达水平在HIV、慢性HBV、HCV感染患者中明显升高,故HIV、慢性HBV、HCV感染患者由于免疫功能受到抑制,导致患者处于长期慢感染状态[15]。在机体免疫应答的初始和效应阶段,PD-1/PD-L1通路起到抑制作用而达到避免机体因免疫过强导致自身免疫性疾病的发生[16]。
本研究从性别和疾病分期的角度出发,通过对AIH患者血CD8+T淋巴细胞PD-1表达水平进行检测,从而探讨PD-1在AIH发病过程中的作用和意义。研究结果显示,与健康对照人群相比,AIH患者血CD8+T细胞PD-1表达水平明显升高,且两组间差异有明显统计学意义。上述结果提示可能是AIH患者自身免疫反应的代偿作用使得PD-l表达水平升高,但机体的代偿作用并不能控制病情的进一步发展,病情并无好转。除此之外,AIH患者发病期PD-1表达水平略低于缓解期,但差异并无统计学意义,提示糖皮质激素等免疫抑制剂治疗的功效可能是由于PD-1通路的表达水平增加。在自身免疫性疾病方面,PD-1/PD-L1通路可以起到一定的预防作用,上级刺激信号的持续时长以及信号强弱等与其通路活化后的表达水平密切相关。在性别方面,不同性别的AIH患者和健康对照人群血CD8+T淋巴细胞PD-1表达水平有所差异,PD-1通路活化后的表达水平在女性群体中表达较男性群体高,但两组人群差异并无统计学意义,对于女性人群较易出现自身免疫肝炎的原因则需进一步研究。
综上所述,自身免疫性肝炎的发病可能与PD-1表达水平密切相关。对AIH患者体内PD-1通路表达增强的研究有重要的临床意义,通过检测AIH患者外周血PD-1的表达程度,可以作为一种参考指标诊断患者体内存在一定程度的免疫功能紊乱。本研究未对PD-1在B淋巴细胞以及其它细胞亚群的表达水平进行检测,其对免疫功能的影响也需要进一步研究。
[1]张宏宇,张晓刚,何梅芳,等.PD-1/PD-L1在自身免疫性肝炎患者外周血T淋巴细胞中的表达及意义.广东医学,2016,37(1):101-103.
[2]Than NN,Wiegard C,Weiler-Normann C,et al.Long-term follow-up of patients with difficult to treat type 1 autoimmune hepatitis on tacrolimus therapy.Scand J Gastroenterol,2016,51(3):329-336.
[3]Jiménez-Rivera C,Ling SC,Ahmed N,et al.Incidence and characteristics of autoimmune hepatitis.Pediatrics,2015,136(5): 1237-1248.
[4]艾国,肖芳,汪鹏,等.自身免疫性肝炎患者外周血CD8+T淋巴细胞PD-1表达及意义.实用肝脏病杂志,2013,16(4): 320-322.
[5]任健,柯宗明.自身免疫性肝炎患者PD-1及SIRPα表达及意义.海南医学院学报,2014,20(9):1184-1186.
[6]Tabll A,Abbas AT,El-Kafrawy S,et al.Monoclonal antibodies: principlesandapplicationsofimmmunodiagnosisandimmunotherapy for hepatitis C virus.World J Hepatol,2015,7(22): 2369-2383.
[7]DeFilippis EM,Kumar S.Clinical presentation and outcomes of autoimmune hepatitis in inflammatory bowel disease.Dig Dis Sci,2015,60(10):2873-2880.
[8]范晓飞,林睿,罗莉丽,等.自身免疫性肝炎合并肝外自身免疫疾病患者的临床特点观察.山东医药,2014,15(40):75-77.
[9]赵素贤,张玉果,谭普芳,等.药物诱导的自身免疫性肝炎与药物性肝损伤的临床特征对照研究.中华肝脏病杂志,2016,24(4):302-306.
[10]De Martin E,Coilly A,Ichai P,et al.The role of corticosteroids in acute-severe autoimmune hepatitis is still highly debatable.J Hepatol,2015,63(4):1041-1042.
[11]Muratori P,Fabbri A,Lalanne C,et al.Autoimmune liver disease and concomitant extrahepatic autoimmune disease.Eur J Gastroenterol Hepatol,2015,27(10):1175-1179.
[12]胡晓蕾,赵志钢,骆方军,等.浙江省丽水市强直性脊柱炎患者外周血CD4+T淋巴细胞和CD8+T淋巴细胞程序性死亡因子1的表达及意义研究.中国全科医学,2016,13(6):678-682.
[13]夏红,周智,杨玉霞,等.乙型肝炎患者恩替卡韦抗病毒治疗后外周血T淋巴细胞PD-1的表达及其与HBeAg血清学的关系.海南医学院学报,2016,22(7):655-657.
[14]Yeoman AD,Kotha S,Heneghan MA.Reply to“the role of corticosteroids in acute-severe autoimmune hepatitis is still highly debatable”.J Hepatol,2015,63(4):1043.
[15]Lian F,Wang Y,Xiao Y,et al.Activated farnesoid X receptor attenuates apoptosis and liver injury in autoimmune hepatitis. Mol Med Rep,2015,12(4):5821-5827.
[16]周俊英,周东方,李俊卿,等.青少年慢性乙型肝炎患者乙型肝炎病毒特异性CD8+T淋巴细胞程序性死亡分子-1的表达.中华肝脏病杂志,2013,21(1):27-32.
(收稿:2016-09-26)
(本文编辑:陈宗炳)
Programmed cell death-1 and programmed cell death-1 receptor on peripheral blood CD8+T lymphocytes in patients with autoimmunehepatitis
Rui Zhilian.Clinical Laboratory,People’s Hospital,Liyang 213300,Jiangsu Province,China
Autoimmune hepatitis;CD8+T lymphocytes;Programmed cell death-1;Programmed cell death-1 ligand
10.3969/j.issn.1672-5069.2017.03.025
213300江苏省溧阳市人民医院检验科
芮志莲,女,49岁,大学本科,副主任技师。E-mail:ruizhilian3480@126.com
