Orionin对急性肝衰竭小鼠的保护作用及其对肝组织细胞因子水平的影响*
2017-05-15邓怡林于合国施敏石翠翠范建高李光明
邓怡林,于合国,施敏,石翠翠,范建高,李光明
·肝衰竭·
Orionin对急性肝衰竭小鼠的保护作用及其对肝组织细胞因子水平的影响*
邓怡林,于合国,施敏,石翠翠,范建高,李光明
目的探讨冬凌草甲素(Oridonin)对脂多糖/D-氨基半乳糖氨(LPS/D-Gal)联合诱导的急性肝衰竭(ALF)小鼠的保护作用及其对肝组织细胞因子水平的影响。方法取150只小鼠,随机分成5组,每组30只。采用LPS/D-Gal腹腔注射建立小鼠ALF模型,设生理盐水对照组、Oridonin对照组、LPS/D-Gal诱导模型组和LPS/D-Gal处理及不同剂量Oridonin干预组。采用Real-time PCR法检测肝组织肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1α、IL-1β和IL-6 mRNA水平。结果模型组小鼠48 h存活率为0.0%(0/30),而两个Oridonin干预组小鼠48 h存活率分别提高至64.5%(19/30)和80.6%(24/30,P<0.01);组织病理学检查显示模型组小鼠肝细胞呈大块或/和亚大块坏死,肝小叶结构消失,残存肝细胞肿胀、空泡变性,肝窦肿胀充血,炎细胞浸润。Oridonin干预组小鼠肝细胞坏死、空泡变性和炎细胞浸润等较模型组有明显的改善;模型组小鼠血清ALT和AST水平分别为(345.3± 54.1)U/L和(500.2±53.5)U/L,明显高于对照组的[(42.3±0.6)U/L和(117.1±9.8)U/L,P<0.01],两个Oridonin干预组分别为(303.9±39.5)U/L和(340.6±2.8)U/L及[(130.2±38.3)U/L和(209.8±36.2)U/L,P<0.05];模型组小鼠肝组织TNF-α、IL-1α、IL-1β和IL-6 mRNA水平显著高于正常对照组(P<0.01),而两个Oridonin干预组肝组织TNF-α、IL-1α、IL-1β和IL-6 mRNA水平显著低于模型组(P<0.01)。结论Oridonin对LPS/D-Gal诱导的ALF小鼠具有显著的保护作用,其作用机制可能与降低肝组织细胞因子水平有关。
急性肝衰竭;脂多糖;D-氨基半乳糖氨;冬凌草甲素;细胞因子;小鼠
急性肝衰竭(Acute liver failure,ALF)病情凶险,死亡率高,目前尚无有效防治方法[1]。因此,探寻能改善ALF预后的治疗新策略具有重要的临床意义。ALF病情进展与炎性细胞因子过度释放及由此介导的肝细胞凋亡和坏死密切相关[1-3]。冬凌草甲素(oridonin)是从中药冬凌草中分离出来的活性双萜类化合物,具有广泛的抗肿瘤和抗炎等生物活性[4-7]。基于ALF是一种炎症相关性疾病,oridonin具有广泛强大的抗炎效应,提示oridonin可能对ALF具有保护作用。本研究以脂多糖/D-氨基半乳糖氨(Lipopolysaccharide/D-galactosamine,LPS/D-Gal)诱导小鼠ALF为模型,探讨oridonin的保护作用,并初步探索其保护作用是否与抑制肝组织细胞因子的分泌水平有关。
1 材料与方法
1.1 动物、试剂与药物6~8周龄,雌性SPF级,体质量为20~22 g的C57/BL6小鼠购自中国科学院上海生命科学研究院,在清洁级动物实验中心喂养(标准动物饲料及饮水,环境温度为21±2℃,12 h的明暗交替光照时间)。所有动物实验均符合本校动物伦理委员会的有关规定。D-Gal和LPS(E. Coli,菌株O111:B4)购自美国Sigma公司。Oridonin购自美国Selleck公司。苏木素-伊红染色试剂盒购自江苏凯基生物技术股份有限公司。ReverTra Ace qPCR RT Kit购自日本Toyobo公司,SYBR@ Green Real-time PCR Master Mix购自上海ExCell Bio公司。
1.2 ALF模型的建立取150只小鼠,随机分成5组,每组30只。a组(正常对照组):给予生理盐水0.5 ml腹腔注射,1 h后注射同等体积的生理盐水;b组(药物对照组):给予Oridonin(将oridonin溶于生理盐水,0.2 mg/只)0.5 ml腹腔注射,1 h后注射同等体积的生理盐水;c组(模型组):给予LPS(40 μg/只)/D-Gal(5 mg/只)/生理盐水0.5 ml腹腔注射,1 h后注射同等体积的LPS/D-Gal混合溶液;d组和e组(药物干预组):给予Oridonin(0.2 mg/只)/LPS(40 μg/只)/D-Gal(5 mg/只),其中d组给予Oridonin(0.2 mg/只)0.5 ml腹腔注射,1 h后给予同等体积的LPS/D-Gal混合溶液腹腔注射,e组给予Oridonin 0.5 ml腹腔注射,1次/4 d,共3次,最后一次在给药后1 h给予同等体积的LPS/D-Gal混合溶液腹腔注射。观察并记录各组小鼠存活情况,1次/6 h,计算小鼠48 h存活率。另取25只小鼠,随机分成5组,每组5只,分组和药物处理方法同上。在腹腔注射LPS/D-Gal后6 h,经眼球采血,分离血清,保存于-80℃,备检。取肝组织,浸泡于4%多聚甲醛溶液中,经过常规脱水、浸蜡、包埋,制成5μM切片,行HE染色。另取肝组织经液氮速冻后,置于-80℃冰箱保存,备检。
1.3 血清ALT和AST水平检测使用日立7180全自动血生化分析仪检测。
1.4 肝组织细胞因子mRNA水平检测采用RT-PCR法,以Trizol法提取肝组织RNA,经紫外分光光度计测定RNA纯度,取吸光度A260/A280为1.8~2.0的RNA用于逆转录,采用Real-time PCR试剂盒行PCR扩增,每个反应体系共20μl,包括DNA模板(10 ng/μl)1.4μl,SYBR 10μl,引物1.6μl(10μM)和ddH2O 7μl。反应条件为95℃预变性10 min,95℃变性20 s,58℃退火30 s,72℃延伸25 s,40个循环。以GAPDH为内参照,运用2-△△CT法分析结果。所有引物均由美国Thermo Fisher Scientific公司合成,其序列分别为:TNF-α:正义链,5’-CTCCCAGGTATATGGGCT CA-3’,反义链:5’-CCA GGT TCT CTT CAA GGG AC-3’;IL-1α:正义链,5’-AGT ATC AGC AAC GTC AAG CAA-3’,反义链:5’-TCC AGA TCA TGG GTT ATG GAC TG-3’;IL-1β:正义链,5’-GAAATGCCACCTTTTGACAGT G-3’,反义链:5’-TGG ATG CTC TCA TCA GGA CAG-3’;IL-6:正义链,5’-TAG TCC TTC CTA CCC CAA TTT CC-3’,反义链:5’-TTG GTC CTT AGC CAC TCC TTC-3’;GAPDH:正义链,5’-TCC AAG GAG TAA GAA ACC CTG GAC-3’,反义链,5’-GTTATTATGGGGGTCTGGGAT GG-3’。
1.5 统计学处理应用GraphPad Prism 6.0行统计学分析,计量资料以±s表示,组间比较采取独立样本t检验,两个和两个以上样本率的比较采用卡方检验。P<0.05和P<0.01分别表示差异具有显著性和非常显著性统计学意义。
2 结果
2.1 Oridonin可显著提高ALF小鼠存活率在LPS/D-Gal刺激后,模型组小鼠48 h存活率为0.0%(0/30);经Oridonin干预的d组和e组小鼠48h存活率分别提高至64.5%(19/30)和80.6%(24/30,P<0.01,图1),表明Oridonin可明显提高ALF小鼠的存活率。
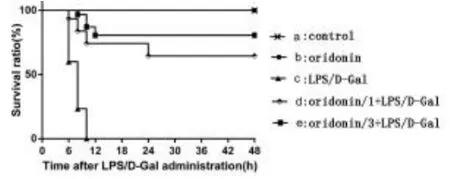
图1 各组小鼠存活率比较正常对照组及药物对照组小鼠48 h存活率为100%(30/30);在LPS/D-Gal刺激后,模型组小鼠48 h存活率为0.0%(0/30),经Oridonin干预的d组和e组小鼠48 h存活率分别提高至64.5%(19/30)和80.6%(24/30)
2.2 Oridonin显著改善ALF小鼠肝组织损伤正常对照组及药物对照组肝组织细胞及肝小叶结构完整;在LPS/D-Gal处理6 h后,模型组小鼠肝组织呈大块或/和亚大块坏死,小叶结构消失,残存肝细胞肿胀、空泡变性,肝窦肿胀充血,炎细胞浸润;Oridonin干预组小鼠肝细胞坏死、空泡变性及炎细胞浸润等较模型组有明显的改善(图2)。
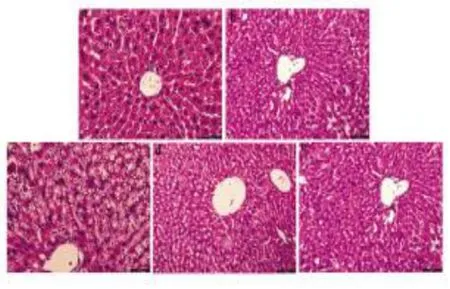
图2 肝组织病理学表现(HE,200×)a:正常对照组,b:药物对照组;c:模型组;d和e:药物干预组
2.3 各组小鼠血清ALT和AST水平比较在LPS/D-Gal处理6 h后,模型组小鼠血清ALT和AST水平分别为(345.3±54.1)U/L和(500.2± 53.5)U/L,显著高于对照组的(42.3±0.6)U/L和(117.1±9.8)U/L,P<0.01);Oridonin干预的d组血清ALT和AST水平分别下降为(303.9±39.5)U/L和(340.6±2.8)U/L,Oridonin干预的e组血清ALT和AST水平分别显著下降为(130.2±38.3)U/L和(209.8±36.2)U/L(P<0.05,图3)。
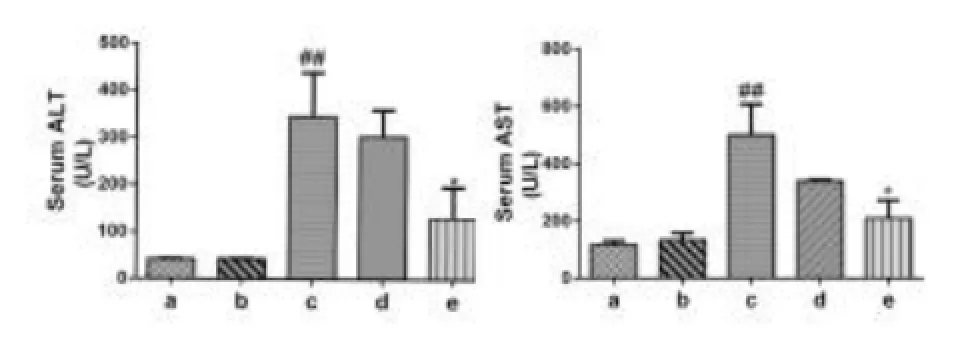
图3 各组血清转氨酶水平变化比较与正常对照组比,##P<0.01;与模型组比,*P<0.01
2.4 各组小鼠肝组织炎症因子mRNA水平比较见图4,提示Oridonin对LPS/D-Gal诱导的小鼠肝组织炎症因子水平具有显著的阻抑作用。

图4 肝组织细胞因子mRNA水平变化与正常对照组比,##P<0.01;与模型组比,*P<0.01
3 讨论
LPS/D-Gal诱导的ALF与临床ALF病理过程相似,是研究ALF的经典动物模型[11-13],也是筛选ALF治疗新药的重要手段。因此,利用此动物模型,我们探讨了Oridonin对ALF小鼠的保护作用及其可能的机制。
我们选择在LPS/D-Gal刺激前,给予Oridonin预处理[14-18]。结果显示,给予Oridonin预处理可明显提高ALF小鼠48 h存活率,表明Oridonin对ALF具有显著的保护作用。我们进一步研究了LPS/D-Gal处理6 h后模型组小鼠肝组织呈大块和/或亚大块坏死伴血清ALT/AST显著升高,提示小鼠ALF模型构建成功,Oridonin干预组小鼠不仅血清ALT/AST水平明显降低,而且肝细胞变性、坏死及炎性细胞浸润也显著减轻,提示Oridonin对LPS/D-Gal诱导的ALF小鼠具有显著的保护作用。
ALF发病机制与损伤因素诱导的炎性细胞因子过度释放及其引起的肝组织急性炎症反应密切相关[12,15,19]。有研究报道,Oridonin可以抑制LPS和β-淀粉样蛋白刺激的神经小胶质细胞一氧化氮(NO)、TNF-α和IL-6等炎症因子释放,同时伴有对NF-κB信号通路的抑制[7,20],说明Oridonin可能对炎症相关性疾病具有保护作用。为了探讨Oridonin对ALF小鼠的保护机制,我们评估了在ALF发病中起关键作用的促炎细胞因子TNF-α、IL-1和IL-6基因水平变化。研究发现在LPS/D-Gal诱导的ALF小鼠肝组织TNF-α、IL-1α、IL-β和IL-6 mRNA水平显著上调,Oriodnin预处理则可显著抑制上述炎症因子的上调,提示Oriodnin对ALF的保护作用可能与抑制肝脏炎症反应有关。
我们的研究首次证实Oridonin对ALF具有显著保护作用,其机制可能与抑制肝脏炎症反应有关,预示Oridonin在ALF临床干预方面可能具有潜在的应用价值。
[1]Jedicke N,Struever N,Aggrawal N,et al.Alpha-1-antitrypsin inhibits acute liver failure in mice.Hepatology,2014,59(6): 2299-2308.
[2]Guicciardi ME,Malhi H,Mott JL,et al.Apoptosis and necrosis in the liver.Compr Physiol,2013,3(2):977-1010.
[3]Brenner C,Galluzzi L,Kepp O,et al.Decoding cell death signals in liver inflammation.J Hepatol,2013,59(3):583-594.
[4]Gao SY,Li J,Qu XY,et al.Downregulation of cdk1 and cyclinb1expressioncontributestooridonin-inducedcellcycle arrestatG2/MphaseandgrowthinhibitioninSGC-7901 gastric cancer cells.Asian Pacif J Cancer Prevent,2014,15(15):6437-6441.
[5]Wong AM,Zhang Y,Kesler K,et al.Genomic and in vivo evidence of synergy of a herbal extract compared to its most activeingredient:rabdosiarubescensvs.oridonin.ExpTher Med,2010,1(6):1013-1017.
[6]Zhen T,Chen Z,Chen SJ.Targeting of AML1-ETO in t(8;21)leukemia byoridonin generates a tumor suppressor like protein.Cancer Biol Ther,2012,4:127-138.
[7]Wang S,Yang H,Yu L,et al.Oridonin attenuates abeta1-42-induced neuroinflammation and inhibits NF-kB pathway.PLoS One,2014,9(8):e104745
[8]Lee W M,Squires R H,Jr.,Nyberg S L,et al.Acute liver failure:summaryofaworkshop.Hepatology,2008,47(4): 1401-1415.
[9]Michael D.Josephs FRB,Fukuzuka K.Lipopolysaccharide and D-galactosamine-inducedhepaticinjuryismediatedby TNF-α and not by Fas ligand.Am J Physiol Regulatory Integrative Comp Physiol,2000,278:1196-1201.
[10]SchwabeRF,BrennerDA.MechanismsofLiverInjury.I. TNF-alpha-inducedliverinjury:roleofIKK,JNK,andROS pathways.Am J Physiol Gastrointest Liver Physiol,2006,290(4):G583-589.
[11]Luo M,Zhao A,Li J,et al.Acute liver injury attenuation of a novel recombinant sTNFR through blocking hepatic apoptosis. Immunopharmacol Immunotoxicol,2015,37(3):295-300.
[12]Silverstein R.D-galactosamine lethality model:scope and limitations.J Endotoxin Res,2004,10(3):147-162.
[13]Tunón M J.An overview of animal models for investigating thepathogenesis andtherapeutic strategies inacutehepatic failure.World J Gastroenterol,2009,15(25):3086.
[14]Gill RQ,Ark S.Acute liver failure.J Clin Gastroenterol,2001,33(3):191-198.
[15]Li X,Gou C,Yang H,et al.Echinacoside ameliorates D-galactosamine plus lipopolysaccharide-induced acute liver injury in mice via inhibitionof apoptosis andinflammation.ScandJ Gastroenterol,2014,49(8):993-1000.
[16]Zhan Y,Wang Z,Yang P,et al.Adenosine 5'-monophosphate ameliorates D-galactosamine/lipopolysaccharide-induced liver injury through an adenosine receptor-independent mechanism in mice.Cell Death Dis,2014,5:e985.
[17]PanCW,ZhouGY,ChenWL,etal.Protectiveeffectof forsythiasideAonlipopolysaccharide/d-galactosamine-induced liver injury.Int Immunopharmacol,2015,26(1):80-85.
[18]Zhang J,Xu L,Zhang L,et al.Curcumin attenuates D-galactosamine/lipopolysaccharide-induced liver injury and mitochondrial dysfunction in mice.J Nutr,2014,144(8):1211-1218.
[19]AdamsDH,JuC,RamaiahSK,etal.Mechanismsofimmune-mediated liver injury.Toxicol Sci,2010,115(2):307-321.
[20]Xu Y,Xue Y,Wang Y,et al.Multiple-modulation effects of oridonin on the production of proinflammatory cytokines and neurotrophicfactorsinLPS-activatedmicroglia.IntImmunopharmacol,2009,9(3):360-365.
(收稿:2016-10-14)
(本文编辑:陈从新)
Effect of oridonin on hepatic cytokine levels in mice with LPS/D-Gal-induced acute liver failure
Deng Yilin,Yu Heguo,Shi Min,et al.Department of Gastroenterology,Xinhua Hospital Affiliated to Jiaotong University School of Medicine,Shanghai 200092,China
ObjectiveTo investigate the effectoforidonin on hepatic cytokinelevelsinmicewith polysaccharide(LPS)/D-galactosamine(D-Gal)-induced acute liver failure.Methods150 mice were randomly divided into five groups(30 in each group),e.g.,normal,oridonin control,model,oridonin-intervened,and oridoninintervened for 12 days.ALF model was established in C57BL/6 mice by intraperitoneal injection of LPS/D-Gal. ResultsThe 48 h lethality rate in LPS/D-Gal-induced group reached an extremely high level of 100%. However,the 48 h survival rates in two oridonin-intervened groups were 64.5%(19/30)and 80.6%(24/30,P<0.01);The damage in liver tissues was ameliorated in mice pretreatedwith oridonin as compared with that in the model group;Serum ALT and AST levels in model group were(345.3±54.1)U/L and(500.2±53.5)u/L,significantly higher than those in control group[(42.3±0.6)U/L and(117.1±9.8)U/L,P<0.01]or in oridonin-treated group[(303.9± 39.5)U/L and(340.6±2.8)U/L or[(130.2±38.3)U/L and(209.8±36.2)U/L,P<0.05];Administration of oridonin in mice with LPS/D-Gal-induced ALF significantly decreased mRNA levels of hepatic TNF-α,IL-1α,IL-1β and IL-6 compared with in model group(P<0.01).ConclusionOridonin has a protective effect on mice with LPS/DGal-induced ALF,and the mechanism might be related to inhibition of hepatic cytokine activities.
Acute liver failure;Lipopolysaccharide;D-galactosamine;Oridonin;Cytokines;Mice
10.3969/j.issn.1672-5069.2017.03.010
国家自然科学基金资助项目(编号:81400631/81570549)
200092上海市上海交通大学医学院附属新华医院消化内科(邓怡林,石翠翠,范建高,李光明);同仁医院消化内科(施敏);上海市计划生育科学研究所(于合国,刁华)
邓怡林,女,25,硕士研究生。主要从事肝损伤及肝纤维化的防治研究。E-mail:yilindeng1991@163.com
李光明,E-mail:ligm68@126.com
