手术切除与射频消融治疗原发性肝癌患者预后比较
2017-05-15王鹤董家鸿卢实春何蕾
王鹤,董家鸿,卢实春,何蕾
手术切除与射频消融治疗原发性肝癌患者预后比较
王鹤,董家鸿,卢实春,何蕾
目的比较手术切除与射频消融(RFA)治疗原发性肝癌患者预后比较。方法2009年7月~2011年12月我院收治的原发性肝癌患者218例,其中106例实施手术切除肿瘤,另外112例实施RFA。比较两种不同方法治疗患者的预后情况。结果两组患者病灶清除率均为100%,但RFA组术中无输血患者,而4.7%手术组患者术中实施了输血(P<0.05),RFA组平均治疗时间为(30.5±7.4)min,平均住院时间为(7.3±0.9)d,均短于手术组的(146.2±30.4)min和(12.4±2.7)d(P<0.05);RFA组发生胸腔/腹腔积液比例为15.2%,血红蛋白(Hb)≤90g/L比例为15.2%,血清白蛋白(ALB)≤30g/L比例为17.0%,三种并发症比例均低于手术组(31.1%、35.8%和36.8%,均P<0.05);两组围术期出现体温>38℃患者比例和腹腔感染发生率差异无统计学意义;术后三个月经增强MRI检查两组患者病灶消失情况,显示5.4%RFA组患者存在病灶残留,手术组无病灶残留患者(P<0.05),RFA组病灶复发比例为9.8%,显著高于手术组的1.9%(P<0.05);RFA组1 a、3 a和5 a生存率分别为92.9%、39.3%和17.9%,而手术组为97.2%、56.6%和29.2%,其中3 a和5 a生存率存在组间显著差异(P<0.05);RFA组1 a、3 a和5 a复发转移率分别为39.3%、69.6%和98.2%,而手术组为29.2%、51.9%和86.8%,其中3 a和5 a复发转移率存在组间显著差异(均P<0.05)。结论RFA治疗原发性肝癌可缩短手术时间,减少并发症发生,但容易有病灶残留,患者长期预后较手术组稍差。
原发性肝癌;肝叶切除;射频消融;预后
肝癌是世界流行的恶性肿瘤,其发病率为所有恶性肿瘤的第五位,而死亡率为第三位[1]。流行病学调查显示,当今肝癌发病率无明显下降趋势,每年将有几十万肝癌患者死亡[2]。导致肝癌死亡率高的原因有多个,早期疾病隐匿,发现困难也是原因之一,45%~75%肝癌患者确诊时已处于中晚期,丧失了最佳手术时机[3]。随着对肝脏恶性肿瘤认识的提高,中晚期肝脏恶性肿瘤患者也可从积极治疗中获益。应用比较广泛的技术主要包括手术切除和射频消融(radio frequency ablation,RFA)技术[4]。多数学者认为手术切除仍然是治疗肝脏恶性肿瘤效果最确切的治疗方式。对于直径小于3 cm的局灶性肝癌,手术切除能达到根治的效果,但我国肝癌患者多合并有肝硬化,多数患者肝功能差,无法耐受肝癌切除术,限制了其应用[5]。RFA技术是利用电场释放热量,直接杀死靶组织的治疗技术。自20年前首次应用于治疗肝癌以来,RFA就以其创伤小、费用低、效果好等特点受到临床医生的认可,但该技术也存在适应证严格、并发症多等问题[6]。本研究对我科手术与RFA治疗的肝脏恶性肿瘤患者进行了长期随访,以了解患者预后情况。
1 资料与方法
1.1 一般资料2009年7月~2011年12月我院收治的原发性肝癌患者218例,其中106例(男69例,女37例,年龄28~72岁,平均年龄48.2±7.1岁)实施手术切除肿瘤,另外112例(男74例,女38例,年龄26~69岁,平均年龄47.6±6.9岁)实施RFA治疗。原发性肝癌诊断依据《原发性肝癌的临床诊断与分期标准》[7]。纳入标准:(1)肝功能Child-Pugh分级为A级和B级;(2)病灶数1~3个,且单发病灶直径小于5 cm,多发病灶最大直径均小于3 cm。排除标准:(1)术中或术后发生严重并发症导致死亡的患者;(2)肝移植患者或转移性肝癌患者。在手术患者中,单发肿瘤90例,2个肿瘤病灶12例,3个肿瘤病灶4例,总共肿瘤病灶数为126个。肿瘤直径为(2.89±0.56)cm,其中≤3 cm的病灶数为85个,>3 cm病灶数为41个,肝功能Child-Pugh A级87例,B级19例;在行RFA治疗患者中,单发肿瘤95例,2个肿瘤病灶13例,3个肿瘤病灶4例,总共肿瘤病灶数为133个。肿瘤直径为(2.86±0.54)cm,其中≤3 cm的病灶数目90个,>3 cm病灶数43个。肝功能Child-Pugh A级92例,B级20例。两组患者以上基本资料的差异无统计学意义(均P>0.05)。
1.2 治疗方法实施全身麻醉,采用经腹部切口肝脏病灶切除手术或在准确定位肿瘤后,使用济宁科电检测仪器有限公司生产的HCH-3000F超声诊断仪和德国Celon AG公司生产的Celonlab ENT射频消融治疗仪,根据肿瘤大小和位置制定布针方案,实施RFA。在消融过程中,利用超声控制手术范围,使强回声范围控制在病灶边缘1 cm以内。术后均给予预防感染和护肝等基础治疗。感染诊断依据《医院感染诊断标准》[8]。
1.3 临床检测与检查采用比色法检测血红蛋白(hemoglobin,Hb)和血清白蛋白(albumin,ALB)水平(上海江莱生物科技有限公司);使用CS-6400全自动生化分析仪(南昌高腾科技有限公司)检测血生化指标。病灶清除标准为经增强磁共振成像(magnetic resonance imaging,MRI)或电子计算机断层扫描(computed tomography,CT)检查,未显示增强病灶。使用上海纽迈电子科技有限公司生产的EDUMR20-015V-I核磁共振成像仪和德国西门子股份公司生产的SOMATOM Spirit螺旋CT诊断仪。
1.4 统计学方法应用SPSS 22.0软件进行分析,计量资料以±s表示,采用t检验,计数资料采用卡方检验,当P<0.05时,表示差异具有统计学意义。
2 结果
2.1 两组治疗情况在112例RFA治疗患者中,接受1次治疗者94例,2次治疗者14例,3次治疗者4例,共接受治疗134次;在手术组,均接受1次手术治疗。两组经治疗,均成功清除病灶。手术组术中输血患者多于RFA组(P<0.05),手术组平均治疗时间长于RFA组(P<0.05),手术组平均住院时间长于RFA组(P<0.05,表1)。
2.2 两组围术期并发症比较两组发热和腹腔感染比例差异均无统计学意义(均P>0.05);RFA组胸腔/腹腔积液、Hb<90 g/L和血清ALB<30 g/L的患者比例均低于手术组(均P<0.05,表2)。
表1 两组治疗情况(%,±s)比较

表1 两组治疗情况(%,±s)比较
与手术组比,①P<0.05
例数病灶数病灶清除术中输血手术时间(min)住院时间(d)手术106126126(100.0)5(4.7)146.2±30.412.4±2.7 RFA112133133(100.0)0(0.0)①30.5±7.4①7.3±0.9①
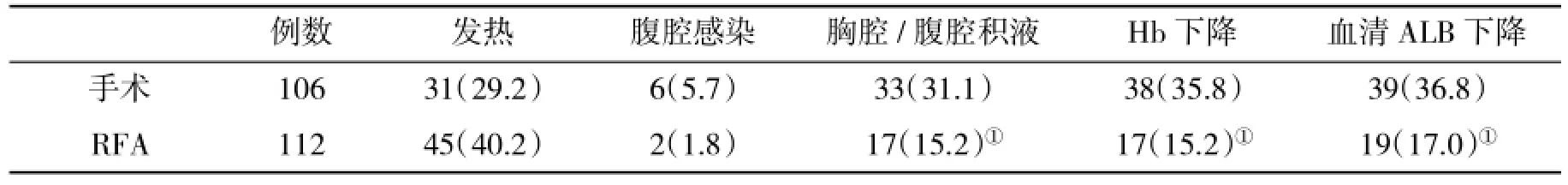
表2 两组围术期并发症发生率(%)比较
2.3 两组病灶变化情况治疗后3个月进行增强MRI检查,显示RFA组病灶残留率显著高于手术组,差异有统计学意义(P<0.05),同时RFA组病灶复发比例也显著高于手术组(P<0.05,表3)。
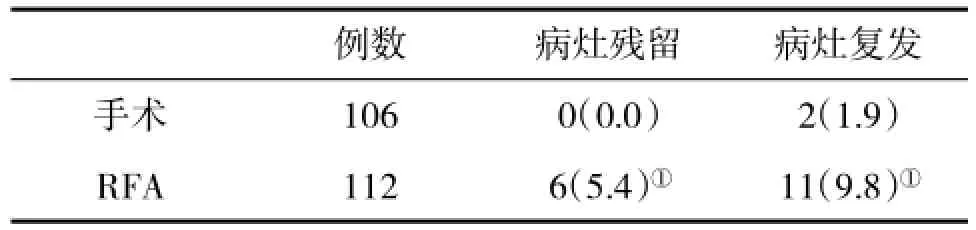
表3 两组病灶变化(%)情况比较
2.4 两组生存率比较在治疗后,RFA组1 a、3 a和5 a生存率均低于手术组,其中3 a和5 a生存率显著低于手术组(P<0.05,表4)。

表4 两组生存率(%)比较
2.5 两组肿瘤复发转移情况比较治疗后,RFA组肿瘤复发转移率均高于手术组,差异具有统计学意义(P<0.05,表5)。
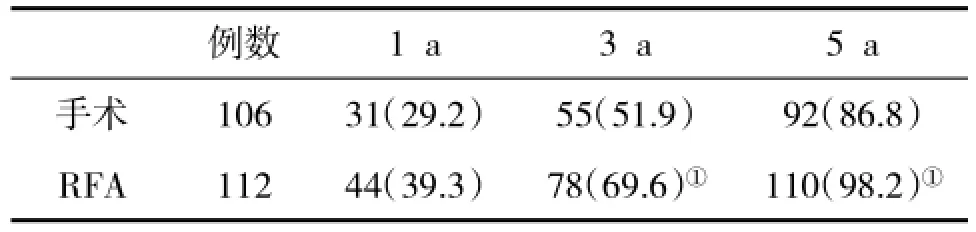
表5 两组肿瘤复发转移率(%)比较
3 讨论
肝癌的治疗一直是非常棘手的问题。如何选择恰当的治疗方法是临床医生需要思考的重要问题。近年来,RFA在肝癌的治疗中发挥出越来越重要的作用。该技术利用局部热能精准释放,达到消融肝癌病灶的目的[9]。RFA的优点之一是操作时间短,因该技术只需要设置好电极即可开展治疗,因此其治疗时间显著缩短[10]。本研究显示接受RFA治疗的原发性肝癌患者平均治疗时间和住院时间均显著短于手术组。RFA的治疗效果受肝脏恶性肿瘤体积的影响十分明显。多数学者指出,该技术可能仅对瘤体直径小于3 cm的病灶效果良好,对直径超过3 cm的病灶无法保证完全坏死[11,12]。有研究认为,多次射频消融治疗有助于提高直径超过3 cm的肝脏恶性肿瘤患者的治疗效果,但受电极能量限制,临床发现多次射频消融治疗并不能提高超过3cm直径的肝癌病灶的毁损[13]。近年来,随着技术进步出现了双电极射频消融,使肝脏病灶毁损面积显著增加,但毁损呈“哑铃”状,多数情况下不符合肿瘤的自然形态[14]。目前,多个肝脏恶性肿瘤病灶已经不是RFA治疗的难点。本研究结果同样提示病灶数目为2个或3个的肝癌患者经射频消融治疗后能保证病灶瘤体100%被毁损,此结果与丁强等[15]的研究结果相符合。国内指南指出,对肝脏恶性肿瘤行手术切除术仍然是治疗肝癌的主要手术,手术治疗的优势之一是即使对直径较大的肝脏恶性肿瘤也可实施切除治疗[16],多数文献也报道晚期肝癌患者接受手术治疗后仍可明显获益,患者5 a生存率显著提高[17]。手术切除的另一个优点是对突出于肝脏表面的瘤体具有更加良好的治疗效果,而RFA可能会引发此类瘤体破裂。对于突出于肝脏表面的恶性肿瘤,射频消融技术并不合适[18]。既往研究认为,对于瘤体直径小于3 cm的肝脏恶性肿瘤患者手术切除与RFA治疗的效果相当,其5 a生存率差异无显著性[19]。本研究结果显示接受手术治疗的患者5 a生存率为29.2%,高于接受RFA治疗的患者,此结果与黄建钊等[20]的研究结果不一致,分析其原因可能与纳入患者肿瘤数目和分期差异有关。安永德等[21]报道,肝癌患者接受RFA及手术治疗后,其复发率差异无显著性。本研究结果显示随访5年,接受RFA治疗的肝脏恶性肿瘤患者肿瘤复发率略高于接受手术患者,分析其原因可能与肿瘤直径较大有关。
综上所述,肿瘤切除手术仍然是治疗肝脏恶性肿瘤的基本手段,对于早期肝脏恶性肿瘤患者可能达到根治效果,对于无法耐受手术的肝癌患者射频消融治疗可使大部分患者获益,但对于瘤体直径较大的患者无论是手术或射频消融技术的应用均受到限制。
[1]Jakob M,Schneider M,Hoeller I,et al.Malignant solitary fibrous tumor involving the liver.World J Gastroenterol,2013,19(2): 3354-3357.
[2]陈建国,陈万青,张思维,等.中国2003-2007年肝癌发病率与死亡率分析.中华流行病学杂志,2012,33(6):547-553.
[3]Kim HO,Kim JE,Bae KS,et al.Imaging findings of primary malignant gastrointestinal stromal tumor of the liver.Jpn J Radiol,2014,32(6):365-370.
[4]Vogl TJ,Hagar A,Noureldin NEA,et al.High frequency versus low frequency microwave ablation in malignant liver tumors:Evaluation of local tumor control and survival.Int J Hyperthermia,2016,12(9):1-34.
[5]刘允怡,赖俊雄,刘晓欣.手术切除在肝癌多学科综合治疗中的地位.中国实用外科杂志,2014,10(8):677-680.
[6]张辉,徐新保,何晓军,等.原发性肝癌术后复发再手术切除与射频消融治疗的疗效比较.西部医学,2013,25(12):1816-1818.
[7]中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准.中华肝脏病杂志,2001,9(6):324-324.
[8]中华人民共和国卫生部.医院感染诊断标准(试行).中华医学杂志,2001,81(5):314-320.
[9]Kelogrigoris M,Laspas F,KyrkouK,etal.Percutaneous radiofrequency ablation for malignant liver tumors in challenging locations.Eur Congress Radiol,2014,13(6):167-169.
[10]刘力,隋秀芳,叶显俊,等.经皮射频消融治疗肝癌的疗效评估.安徽医科大学学报,2012,47(10):1260-1262.
[11]刘会春,单二波,周磊,等.射频消融与手术切除治疗小肝癌的效果观察.蚌埠医学院学报,2012,37(5):531-534.
[12]KinghamTP,KarkarAM,D'AngelicaMI,etal.Ablationof perivascular hepatic malignant tumors with irreversible electroporation.J Am Coll Surg,2012,215(3):379-387.
[13]高恒军,陈敏山.射频消融治疗肝癌的选择与其联合治疗方式.中华肝脏病杂志,2012,20(4):245-247.
[14]Nam SY,Rhim H,Kang TW,et al.Percutaneous radiofrequency ablation for hepatic tumors abutting the diaphragm:clinical assessmentoftheheat-sinkeffectofartificialascites.AJR,2012,194(2):227-231.
[15]丁强,殷世武,项廷淼.多极射频消融治疗肝癌并发症的临床分析及防治.介入放射学杂志,2014,23(4):343-345.
[16]邱兆磊,王振杰,吴华,等.原发性肝癌的手术治疗体会.中华全科医学,2012,10(5):693-694.
[17]汪大伟,姜洪池.肝癌肝切除术后复发再手术治疗价值及术式选择.中国实用外科杂志,2012,14(10):824-826.
[18]Fischbach F,Lohfink K,Gaffke G,et al.Magnetic resonance-guided freehand radiofrequency ablation of malignant liver lesions:a new simplified and time-efficient approach using an interactive open magnetic resonance scan platform and hepatocyte-specific contrast agent.Invest Radiol,2013,48(6):422-428.
[19]陈雨节.射频消融术与手术切除治疗小肝癌疗效比较.山东医药,2013,53(3):70-71.
[20]黄建钊,刘江伟,孙倩,等.射频消融与手术切除治疗肝癌的疗效比较.广东医学,2012,33(13):1991-1993.
[21]安永德,郭亚民,范龙鑫.手术切除联合射频消融治疗结肠癌肝转移疗效分析.实用肝脏病杂志,2016,19(3):327-330.
(收稿:2017-01-11)
(本文编辑:陈从新)
Postoperative complications and long-term prognosis in patients with primary liver cancer after surgical resection or radiofrequency ablation
Wang He,Dong Jiahong,Lu Shichun,et al.Department of Hepatobiliary Surgery,PLA General Hospital,Beijing 100853,China
ObjectiveTo explore the long-term prognosis in patients with primary liver cancer after surgical resection or radiofrequency ablation(RAF).MethodsClinical data of 218 patients with primary liver cancer who received surgical resection or RAF between July 2009 and December 2011 were retrospectively analyzed.106 cases among them received surgical resection,while the other 112 cases received RFA.The prognosis in the two groups was compared.ResultsLesion clearance rates in the two groups were both 100.0%;No patients in RFA group needed blood transfusion,whereas 4.7%of patients in the operation group received blood transfusion(P<0.05);The average operation time in RFA group was shorter than that in surgical resection group[(30.5±7.4)min vs.(146.2±30.4)min,P<0.05];The hospitalization stay inRFA group was also shorter than that in the surgical resection group[(7.3±0.9)d vs.(12.4±2.7)d,P<0.05];40.2%of patients in RFA group,while 29.2%in surgical resection group had a body temperature higher than 38℃,without statistical difference(P<0.05);Abdominal infection occurred in 1.8%of patients in RFA group and 5.7%of patients in surgical resection group(P<0.05);The percentages of patients with pleural and/or peritoneal effusion,or hemoglobin(Hb)levels less than 90g/L or serum albumin(ALB)levels less than 30g/L in RFA group were 15.2%,15.2%and 17.0%,respectively,much lower than those in surgical resection group(31.1%,35.8%and 36.8%,respectively,P< 0.05 for all);Enhanced MRI were conducted in all the patients to exam the lesion clearance,and 5.4%of patients in RFA group had tumor residue,while the full clearance was obtained in surgical resection group(P< 0.05);The one year,three year and five year survival rates in RFA group were 92.9%,39.3%and 17.9%,respectively,which were lower than those in surgical resectiongroup(97.2%,56.6%and29.2,respectively);The one year,three year and five year recurrence and metastasis rates in RFA group were 39.3,69.6%and 98.2%,respectively,which were lowerthan those in surgical resection group(29.2%,51.9%and 86.8%,respectively),with the three and five year recurrence and metastasis rates statistically significantly different between the two groups(P<0.05 for both). ConclusionRFA can reduce the operation time and postoperative complications,but it is discounted with the possibility of tumor residue and relatively poor long-term prognosis in treatment of patients with primary liver cancer.
Hepatoma;Hepalobectomy;Radiofrequency ablation;Prognosis
10.3969/j.issn.1672-5069.2017.03.020
100853北京市解放军总医院肝胆外科
王鹤,男,38岁,医学硕士,主治医师。研究方向:肝胆外科疾病诊治研究
董家鸿,E-mail-dongjiahongdjh@163.com
