早期肠内免疫微生态营养对原发性肝癌患者术后临床疗效的影响
2017-05-15雍伟
雍伟
早期肠内免疫微生态营养对原发性肝癌患者术后临床疗效的影响
雍伟
目的观察原发性肝癌患者行肝癌切除术后早期给予肠内免疫微生态营养支持的临床疗效。方法120例行原发性肝癌切除术患者被随机分为观察组60例和对照组60例,对照组术后常规肠内营养,观察组在对照组的基础上在肠内营养物中加入L-谷氨酰胺、L-精氨酸和双歧三联活菌,比较两组患者术后肝功能、凝血功能、血清免疫球蛋白、内毒素、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、外周血CD4+和CD8+淋巴细胞、一般状况和胃肠道功能。结果观察组患者术后第7天血清白蛋白、前白蛋白、血清IgA、IgG、IgM、血CD4+和CD8+淋巴细胞相对计数分别为(41.65±4.58)g/L、(196.65±25.64)mg/L、(2.12±0.56)g/L、(9.65±0.86)g/L、(0.98±0.25)g/L、(0.42±0.14)和(0.32±0.05),均显著高于对照组的[(35.52±5.38)g/L、(178.38±30.54)mg/L、(1.83±0.48)g/L、(8.22±0.68)g/L、(0.80±0.25)g/L、(0.32±0.06)和(0.24±0.08),P均<0.05];国际标准化比值、总胆红素、直接胆红素、内毒素、TNF-α和IL-6分别为(1.05±0.16)、(20.34±8.65)μmol、(11.35±2.38)μmol/L、(1.82±0.25)ng/L、(258.62±28.65)pg/mL和(156.24±9.38)pg/mL,均显著低于对照组的[(1.46±0.18)、(38.65±9.46)μmol、(19.35±4.28)μmol/L、(2.14±0.15)ng/L、(314.65±41.28)pg/mL和(171.35±20.38)pg/mL,P均<0.05];观察组患者术后排气、排便、下床活动、进食半流质、住院时间分别为(44.52±8.36)h、(74.35±14.68)h、(30.17±9.65)h、(85.34±16.25)h和(10.25±1.88)d,均显著短于对照组的[(68.65±10.48)h、(112.58±14.95)h、(41.35±10.38)h、(115.36±25.68)h、(14.58±2.36)d,P均<0.01]。结论在原发性肝癌肝切除术后早期给予肠内免疫微生态营养支持有助于改善患者营养状态,提高免疫功能,减轻炎症反应和肝功能损害,促进患者早期康复。
肝癌;肝切除术;肠内营养;免疫微生态营养;临床疗效
原发性肝癌(Primary liver cancer,PLC)为流行率及死亡率较高的恶性肿瘤,约占全部肿瘤的7%。《2013年中国肿瘤登记年报》数据显示肝癌发病率居第二位,WH0于2014年发布的《全球癌症报告》显示中国肝癌新增患者和死亡人数均居世界第一位[1],且有继续增高趋势。目前普遍认为HBV和HCV等感染性肝病、慢性非感染性肝病、饮酒、吸烟、糖尿病、肝病家族史等均与PLC发病密切相关[2,3],但存在区域性差异,故明确本地区PLC致病因素,及早做好防治工作很有必要[4]。临床上治疗肝癌首选肝切除术,在手术过程中需阻断肝门,肝缺血-再灌注损伤(HIRI)使肝脏代谢解毒功能降低,微血管阻力升高,出现肝损伤甚至肝功能衰竭,同时手术严重影响患者机体代谢和内环境,加之术后的应激反应使机体处于高分解代谢状态,导致患者术后营养不良,影响快速恢复[5],甚至增加肿瘤复发和远处转移的风险。近年来,研究证实合理的肠内营养支持不仅可减轻手术患者术后负氮平衡,还可预防并减少并发症,维持重要脏器的功能[6]。行肝切除的肝癌患者术后早期予以肠内营养可快速恢复小肠功能,提高机体营养状况,有利于早期康复、预防并发症、改善预后[7]。临床上,营养支持方案有肠外营养和肠内营养。实践发现肠外营养可导致肠屏障功能障碍、肠道菌群紊乱、影响肝功能,甚至出现胆汁淤积等并发症,故目前基本选择早期肠内营养支持疗法[8]。本研究在原发性肝癌患者探讨了常规肠内营养和肠内微生态营养治疗的效果及安全性,现将结果报道如下。
1 资料与方法
1.1 临床资料2013年1月~2016年1月我院肝胆外科收治的120例行肝癌切除术患者,符合《原发性肝癌诊疗规范》(2011年版)[9]的诊断标准,既往有慢性肝病史,经超声、CT、MRI等影像学检查提示有肝内占位性病变。BCLC分期为A~C期,术前肝功能Child-Pugh为A级或B级,具有肝癌切除术适应证,术前均未接受过化疗、放疗、生物靶向治疗。排除胆管细胞癌、混合型肝癌和转移性肝癌、其他部位恶性肿瘤,术前7 d合并感染且未完全控制者,合并严重心、肺、肾等重要脏器功能障碍者,近2月内有消化道出血、肝性脑病、自发性腹膜炎等病史者,既往有胃肠道、胆道重大手术史者,对本研究用药或者营养物过敏者。采用随机数字表法将患者分为两组,每组60例,两组患者在性别构成比、年龄、BMI、Child-Pugh分级、BCLC分期、手术切除范围、手术时间、肝门阻断时间、术中出血量等基线资料方面比较,差异均无统计学意义(P>0.05),具有高度的均衡性和可比性(表1)。本研究经本院医学伦理委员会审核批准,患者及家属知情同意并签署相关同意书。
1.2 营养支持方法对照组患者采用常规肠内营养支持,术前经鼻放置肠营养管,手术过程中将其远端送入空肠内(Treitz韧带下约15~30 cm处),术毕开始肠内营养支持,营养液为短肽型肠内营养剂(百普素,荷兰纽迪希亚Nutricia Export B.V.,进口药品注册证号H20040403,成分:每500 mL溶液含蛋白质19.9 g,脂肪4.9 g,碳水化合物93.1 g,矿物质2.6 g,维生素400 mg),将其溶于0.9%氯化钠注射液500 mL中,40℃,经肠内营养泵控制滴注速度为25 mL/h,500 ml/d,滴注时间>20 h。根据患者耐受情况调整,最大速度不超过100 mL/h,术后前3天不足的热量、氮量、水、电解质等均由外周静脉输注葡萄糖溶液等补充,营养支持时间为1 w;观察组在对照组基础上经营养管注入L-谷氨酰胺(成都力思特制药股份有限公司,国药准字H20040245)0.4 g·kg-1·d-1、L-精氨酸(海南赞邦制药有限公司,国药准字H20058 759)0.25 g.kg-1·d-1、三联活菌制剂(上海信谊药厂有限公司,国药准字S10950032)6 g·d-1,3次/d。
1.3 观察指标使用Hitachi7600型全自动生化分析仪检测血生化指标(杭州瑞析科技有限公司提供试剂);使用ACL TOP凝血分析仪检测凝血功能指标(贝克曼库尔特公司);采用ToxinSensorTM显色法检测血清内毒素水平(金斯瑞生物科技);采用ELISA法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6,南京森贝伽生物科技有限公司);使用NucleoCounterRNC-3000流式细胞仪检测外周血T细胞亚群(上海逍鹏生物科技有限公司);采用免疫散射比浊法检测血清免疫球蛋白。
1.4 统计学处理应用SPSS 18.0软件行统计学分析,计量资料以±s表示。对符合正态分布的资料采用配对或成组t检验,对不符合正态分布的资料则采用秩和检验,计数资料和等级资料以构成比(%)表示,采用x2检验或秩和检验,均采用双侧检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 两组有关指标改善情况观察组患者术后7 d血清ALB、PA水平均明显高于对照组,INR、TBIL、DBIL水平均明显低于对照组(P均<0.05);观察组血清IgA、IgG、IgM和外周血CD4+、CD8+细胞百分比与对照组比,均有显著性差异(P均<0.05,表2、表3)。
表1 两组一般临床资料(n,±s)比较

表1 两组一般临床资料(n,±s)比较
对照组(n=60)观察组(n=60)x2/t值P值性别男35380.31480.5748女2522年龄(岁)58.64±6.5859.25±7.380.47790.6336 BMI(kg/m2)21.58±3.5622.05±3.480.73130.4661 Child-Pugh分级A级34360.13710.7111 B级2624肝炎类型甲型57乙型32310.37140.8305丙型2322 BCLC分期A期3432 B期19200.15290.9264 C期78肝切除范围左半肝1820右半肝16150.32390.9555 1~2段1513<1段1112手术时间(min)-194.58±36.25196.54±35.680.29850.7659肝门阻断时间(min-18.35±2.3619.04±3.681.22260.2239术中出血量(mL)-225.64±35.68235.25±36.571.45690.1478
表2 两组血生化指标(±s)变化比较
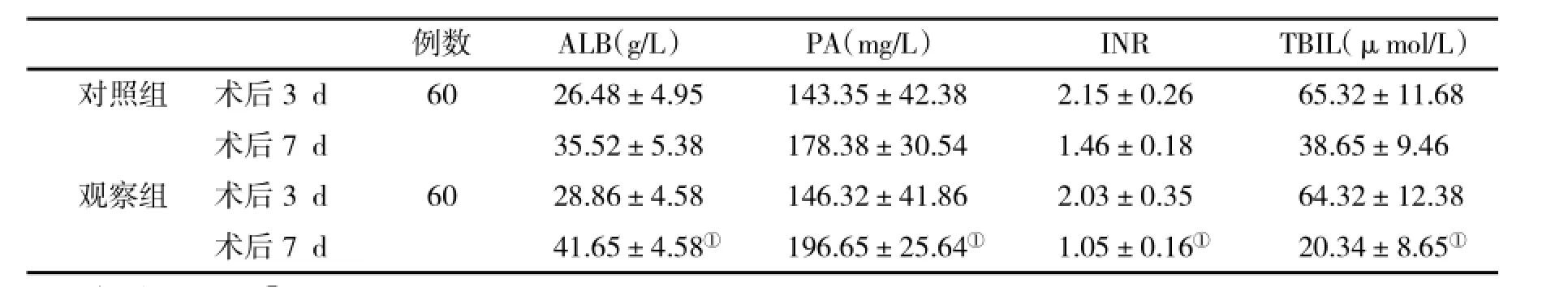
表2 两组血生化指标(±s)变化比较
与对照组比,①P<0.05
例数ALB(g/L)PA(mg/L)INRTBIL(μmol/L)对照组术后3 d6026.48±4.95143.35±42.382.15±0.2665.32±11.68术后7 d35.52±5.38178.38±30.541.46±0.1838.65±9.46观察组术后3 d6028.86±4.58146.32±41.862.03±0.3564.32±12.38术后7 d41.65±4.58①196.65±25.64①1.05±0.16①20.34±8.65①
表3 两组血清免疫球蛋白和血淋巴细胞计数(±s)变化比较

表3 两组血清免疫球蛋白和血淋巴细胞计数(±s)变化比较
与对照组比,①P<0.05
例数Ig A(g/L)IgG(g/L)AgM(g/L)CD4+CD8+对照组术后3 d601.52±0.356.85±0.820.64±0.180.24±0.080.19±0.05术后7 d1.83±0.488.22±0.680.80±0.250.32±0.060.24±0.08观察组术后3 d601.48±0.327.12±0.860.62±0.200.23±0.060.21±0.07术后7 d2.12±0.56①9.65±0.86①0.98±0.25①0.42±0.14①0.32±0.05①
2.2 两组血内毒素和细胞因子水平变化观察组术后7 d血内毒素和细胞因子水平均明显低于对照组(P<0.05,表4)。
2.3 术后恢复及并发症情况观察组患者术后肛门排气、排便、下床活动、进食半流质、住院时间均明显短于对照组(P<0.05,表5)。两组患者术后均未发生严重并发症,仅出现轻微腹泻,经对症处理后恢复。
表4 两组血内毒素和炎症因子水平(±s)变化比较

表4 两组血内毒素和炎症因子水平(±s)变化比较
与对照组比,①P<0.05
例数内毒素(ng/L)TNF-α(pg/mL)IL-6(pg/mL)对照组术后3 d602.58±0.36343.58±42.65187.58±18.65术后7 d2.14±0.15314.65±41.28171.35±20.38观察组术后3 d602.31±0.38312.58±40.64185.35±19.58a术后7 d1.82±0.25①258.62±28.65①156.24±9.38①
表5 两组手术恢复指标(±s))比较

表5 两组手术恢复指标(±s))比较
例数肛门排气(h)排便(h)下床活动(h)进食半流质(h)住院时间(d)对照组6068.65±10.48112.58±14.9541.35±10.38115.36±25.6814.58±2.36观察组6044.52±8.3674.35±14.6830.17±9.6585.34±16.2510.25±1.88 t值-13.942314.13346.110318.855411.1160 P值-0.00000.00000.00000.00000.0000
3 讨论
PLC可能是氧化应激作用下肝细胞凋亡、坏死、修复与再生、新血管产生进而促进异常增生进展而来,常继发于病毒性肝炎和肝硬化[10]。肝脏作为人体代谢功能脏器,当肝细胞受损、储备功能降低、脱氨基和转氨基作用被抑制、脂质代谢障碍、类固醇激素的灭活功能降低等因素作用下使营养代谢平衡被破坏,同时患者多存在食欲减退现象,加之肿瘤细胞对机体物质代谢的影响,故PLC患者多伴有营养不良[11]。肝切除术降低肝的代谢解毒功能,增高微循环阻力,损伤肝功能甚至发生肝功能衰竭,同时术后的应激反应使机体处于高分解代谢状态,进一步加重患者的营养不良程度[12],延缓术后早期恢复,增加术后并发症发生率和病死率[13],故术后早期予以合理的营养支持对预防肝功能损伤、提高患者机体免疫功能,改善预后[14]等均具有积极的临床价值。
近年来,快速康复外科治疗理念在临床上被广泛应用[15]。郑惊雷等[16]报道肝癌手术患者应用快速康复外科措施可行性大,可促进患者快速康复。普遍认为,除了需加强手术操作技术的训练和提高外,安全合理的应用支持疗法亦是快速康复的重要组成部分[17,18]。王丽[19]在静脉镇痛基础上予以早期营养支持,发现可明显改善患者术后营养状况、肝功能及免疫功能,且均未出现严重并发症。目前,临床营养支持多采用肠外营养和肠内营养,肠外营养通过中心静脉输入机体所需的营养素,但长期应用可导致机体代谢功能异常,出现深静脉导管感染、肝功能损害、胆汁淤积、肠道黏膜萎缩、肠道结构和功能损伤、菌群移位产生内毒素血症等并发症,且费用高昂,增加患者的经济负担[20],而肠内营养经门静脉系统吸收输送至肝脏,有利于肝脏蛋白质的合成和代谢的调节,同时还可促进胃肠激素的分泌和肠道功能恢复,维持肠粘膜结构的完整性,增强肠道的免疫屏障功能,阻止内毒素吸收和菌群易位,减轻对残肝的损害,故目前多倾向于肠内营养[21]。但是,关于营养底物的选择尚无确切的标准,故本研究在肝癌手术患者术后均采用肠内营养,对比不同营养底物对患者术后营养状态、免疫功能和肝功能的影响。
肠内营养底物由短肽型肠内营养剂和生理盐水配制而成,可满足机体对热能的需求,在此基础上加用谷氨酰胺可支持氨基酸的生物合成,为肠黏膜上皮细胞活动提供充足的能量,同时还可减少或者避免上皮细胞的凋亡,保护肠上皮细胞抵抗内毒素和炎症因子的损伤,预防细菌异位,不同程度地增强肠黏膜的屏障功能。内毒素为脂多糖物质,多在肠道内产生,若患者肠道功能正常则可阻止内毒素进入机体,若肠道黏膜损伤则可大量渗入血液导致内毒素血症等多种病症。我们监测了术后3 d和7 d患者血浆内毒素水平,可在一定程度上反映肝癌患者术后肠黏膜通透性,结果发现早期予以肠内免疫微生态营养支持可明显降低血浆内毒素水平,且观察组术后3 d、7 d内毒素水平均明显低于对照组。观察组术后3 d、7 d血TNF-α和IL-6水平均明显低于对照组,与Ostadhahi S[22]报道基本一致。我们还添加三联活菌制剂(双歧杆菌、嗜酸乳杆菌、粪链球菌),以增强肠黏膜谷氨酸-半胱氨酸连接酶的活性,协同谷氨酰胺促进谷胱甘肽的合成,调控炎症细胞因子动态平衡,此结果与Hai[23]和Rodrigue C[24]报道高度一致。
PLC患者在肝切除术后早期给予肠内免疫微生态营养支持可明显改善患者营养状态、提高免疫功能,减轻炎症反应和肝功能损害,促进患者早期康复。
[1]Abdelaziz AO,Elbaz TM,Shousha HI,et al.Survival and prognosticfactorsforhepatocellularcarcinoma:anEgyptian multidisciplinary clinic experience.Asian Pac J Cancer Prev,2014,15(9):3915-3920.
[2]Bosetti C,Turati F,La Vecchia C.Hepatocellular carcinoma epidemiology.BestPrastResClinGastroenterol,2014,28(5): 753-770.
[3]Testino G,Lenoe S,Borro P,et al.Alcohol and hepatocellular carcinoma:A review and a point of view.World J Gastroenterol,2014,20(43):15943-15954.
[4]李佳红,付娜,牛学敏,等.573例原发性肝癌病因及临床特点分析.实用肝脏病杂志,2015,18(4):399-402.
[5]Lee S C,Kim J O,Kim S J.Secretome from human adipose-derived stem cells protects mouse liver from hepatic ischemia-reperfusion injury.Surgery,2015,157(5):934-943.
[6]Tang AM,Quick T,Chung M,et al.Nutrition assessment,counseling,and support interventions to improve health-related outcomes in people living with HIV/AIDS:a systematic review of the literature.J Acquir Immune Defic Syndr,2015,68(3):340-349.
[7]Ding D,Feng Y,Song B,et al.Effects of preoperative and postoperative enteral nutrition on postoperatoive nutritional status and immune function of gastric cancer patients.Turk J Gastroenterol,2015,26(2):181-185.
[8]姚金科,陈捷,商昌珍,等.腹腔镜肝癌切除术后早期肠内营养的临床应用价值.中华肝脏外科手术学电子杂志,2015,4(3): 165-168.
[9]中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).北京,人民卫生出版社,2011:12-15.
[10]Papatheodoridis GV,Chan HL,Hansen BE,et al.Risk of hepatocellularcarcinomainchronichepatitisB:Assessmentand modification with current antiviral therapy.J Hepatol,2015,62(4):956-967.
[11]易佳盛,张吉翔,王静,等.肝癌患者营养不良的原因及其营养治疗.肿瘤代谢与营养电子杂志,2015,2(3):73-76.
[12]Hdde P,Sorensson MA,Polleryd P,et al.Influence of BMI on short-termsurgicaloutcomeaftercolorectalcancersurgery:a study based on the Swedish national quality registry.Int J Colorectal Dis,2015,30(9):1201-1207.
[13]乔秋阁,游道锋,陶华洁,等.肝癌患者营养状况与临床结局相关性研究.河北医药,2016,38(2):282-285.
[14]齐瑞兆,李志伟,张培瑞,等.原发性肝癌患者术后两种营养支持的疗效对比及对免疫功能的影响研究.现代生物医学进展,2014,14(5):888-891.
[15]Frontrea D,Arena L,Corsale I,et al.Fast track in colo-rectal surgery.Preliminary experience in a rural hospital.G Chir,2014,35(11/12):293-301.
[16]郑惊雷,王在国,陈刘镇,等.肝癌手术患者应用快速康复外科措施的效果分析.中华临床医师杂志(电子版),2016,10(1): 16-19.
[17]Paga AJ,Ejaz A,Spolverato G,et al.Enhanced recovery after surgery protocols for open hepatectomy-physiology,immunomodulation,andimplementation.J Gastrointest Surg,2015,19(2): 387-399.
[18]Wong-LunHingEM,VanDamRM,HeijnenLA,etal.Is currentperioperativepracticeinhepaticsurgerybasedon enhanced recovery after surgery(ERAS)principles.World J Surg,2014,38(5):1127-1140.
[19]王丽.静脉镇痛联合早期营养支持原发性肝癌术后患者中的应用研究.实用临床医药杂志,2016,20(10):84-86.
[20]王平,何宇,谢嘉奋,等.肠内营养联合免疫微生态营养对肝切除患者肝功能及肠道功能的影响.广西医学,2015,37(1): 102-104.
[21]杜晓燕.低热量肠内营养支持疗法对原发性肝癌术后恢复的临床疗效观察.医学研究杂志,2015,44(4):111-113.
[22]Ostadhadi S,Rezayat SM,Ejtemaei Mehr S,et al.Mesenteric arteryresponsivenesstoacetycholineandphenylephrinein cirrhotic rats challenged with endotoxin:the role of TLR4.Can J Phsiol Pharmacol,2015,93(6):475-783.
[23]Hai NV.The use of probiotics in aquaculture.J Appl Microbiol,2015,119(4):917-935.
[24]Rodrigue CI,Kegeles LS,Levinson A,et al.In vivo effects of ketamine on glutamate-glutamine and gamma-aminobutyric acid inobsessive-compulsivedisorder:Proofofconcept.Psychiat Res,2015,233(2):141-147.
(收稿:2016-09-23)
(本文编辑:陈从新)
Early enteral nutrition and ecoimmunonutrition in patients with primary liver cancer after hepatectomy
Yong Wei.Department of Hepatobiliary Surgery,Seventh People's Hospital,Chengdu 610000,Sichuan Province,China
ObjectiveTo observe the clinical effects of early enteral nutrition and ecoimmunonutrition in patients with primary liver cancer after hepatectomy.Methods 120 patients with primary liver cancer after hepatectomy were randomly divided into observation group(n=60)and control group(n=60).In the control group,the patients were treated with routine enteral nutrition,while in the observation group the intervention including L-glutamine,L-arginineandbifidtripleviableweregivenatthebaseofroutineenteralnutrition.The postoperative serum liver function index,immunoglobulin,endotoxin,tumor necrosis factor alpha(TNF-α),interleukin 6(IL-6),peripheral blood CD4+and CD8+lymphocytes,general condition and gastrointestinal function were compared between the two groups.ResultsThe levels of serum albumin,prealbumin,IgA,IgG,IgM,blood CD4+and CD8+in the observation group on the 7th postoperative day were(41.65±4.58)g/L,(196.65±25.64)mg/L,(2.12±0.56)g/L,(9.65±0.86)g/L,(0.98±0.25)g/L,(0.42±0.14)and(0.32±0.05),much higher than those in the control group[(35.52±5.38)g/L and(178.38±30.54)mg/L,(1.83±0.48)g/L,(8.22±0.68)g/L,(0.80±0.25)g/L,(0.32±0.06)and(0.24±0.08),P<0.05],while the levels of international normalized ratio,total bilirubin,direct bilirubin,endotoxin,TNF-α and IL-6 in the observation group were(1.05±0.16),20.34±8.65)μmol,(11.35±2.38)μmol/L,(1.82±0.25)ng/L,(258.62±28.65)pg/mL and(156.24±9.38)pg/mL,much lower than those in the control group[(1.46±0.18),(38.65±9.46)μmol,(19.35±4.28)μmol/L,(2.14±0.15)ng/L,(314.65± 41.28)pg/mL and(171.35±20.38)pg/mL,P<0.05];thetimeofpostoperativeexhaust,defecation,ambulation,semifluid diet and hospitalization in the observation group were[(44.52±8.36)h,(74.35±14.68)h,(30.17±9.65)h,(85.34±16.25)h,and(10.25±1.88)d,significantly shorter than those in the control group [(68.65±10.48)h,(112.58±14.95)h,(41.35±10.38)h,(115.36±25.68)h,(14.58±2.36)d,P<0.05].Conclusion Early enteral nutrition and ecoimmunonutrition can improve the nutritional status,improve immune function,reduce inflammationandliverdamage,and promoteearlyrehabilitationofpatientswithprimarylivercancerafter hepatectomy.
Hepatoma;Hepatectomy;Enteral nutrition;Ecoimmunonutrition;Clinical effect
10.3969/j.issn.1672-5069.2017.03.018
610000成都市第七人民医院肝胆外科
雍伟,男,43岁,大学学历,副主任医师。E-mail:mam. mqa@163.com
