鲁氏酵母的复壮及培养条件的研究
2017-05-15张立文刘振蓉
张立文,刘振蓉
(1.烟台经济学校,山东 烟台 264000;2.烟台大学 生命科学学院,山东 烟台 264005)
鲁氏酵母的复壮及培养条件的研究
张立文1,刘振蓉2
(1.烟台经济学校,山东 烟台 264000;2.烟台大学 生命科学学院,山东 烟台 264005)
对退化的鲁氏酵母进行了复壮,并研究了培养条件对鲁氏酵母生物量,通过单因素试验和正交试验对酵母生长条件进行了优化,实验结果表明鲁氏酵母最佳生长条件为:食盐浓度8%,温度30 ℃,pH值5,含氮量0.15%。
鲁氏酵母;分离;纯化
酱油在传统的制作工艺上主要是用大豆、小麦中的植物蛋白、食盐和水为主要原料,经过微生物,比如酵母菌、米曲霉以及乳酸菌等多种微生物和细胞的共同作用酿造而成[1]。其中霉菌(米曲霉和黑曲霉)与产品发酵周期的长短、发酵成熟的快慢、产品的色泽和味道有着密切的联系,而酱油的风味醇香程度则主要取决于微生物中的鲁氏酵母菌和乳酸菌[2,3]。鲁氏酵母是耐高渗透压酵母,能够在盐浓度为5%~8%时生长良好,鲁氏酵母是酱油酿造过程中的主要产香菌株,在发酵温度过高的情况下,酵母会失去活性从而影响酱油香气成分的形成[4,5]。
本文对鲁花生物科技有限公司提供的鲁氏酵母菌悬液进行了分离纯化,挑选出茁壮的酵母菌落,分别考察它们的细胞形态、细胞生长曲线、酒精发酵能力,从中筛选出最优的菌株,并对其发酵条件进行了优化。
1 材料与方法
1.1 实验材料
鲁氏酵母 鲁花生物科技有限公司;液体麦芽汁 烟台大学发酵工程实验室。
1.2 实验用培养基
1.2.1 液体麦芽汁培养基的制备
将液体麦芽汁进行解冻,按7.0 g/dL的比例加入NaCl,三角瓶分装后,在121 ℃下蒸汽杀菌30 min。
1.2.2 固体麦芽汁培养基的制备
将上述所得的液体麦芽汁培养基中加入2%的琼脂,溶解、分装后,121 ℃灭菌30 min。
1.2.3 酵母生长的液体培养基
酱油氨基酸氮0.25%,葡萄糖5%,盐10%。
1.3 实验方法[6]
1.3.1 鲁氏酵母的分离纯化
将鲁氏酵母悬液充分摇匀,分别取5.0 mL接于3个500 mL灭过菌的液体麦芽汁培养基中,在恒温振荡器上30 ℃培养36 h,观察生长状况。
酵母悬液的梯度稀释:用移液管准确移取1.0 mL鲁氏酵母悬液至9.0 mL的无菌水中,摇匀,然后进行梯度稀释到10-7。
制作平板:将稀释后的菌悬液用倾注法倒平板,置于30 ℃的培养箱中培养2天,观察生长状况。
划线分离:从上述的平板中找出长势快的菌株,在平板上进行划线分离,直到长出纯的菌落,标记后斜面保存。
1.3.2 鲁氏酵母生长曲线的测定
将纯化好的3株鲁氏酵母分别接入到酵母生长的液体培养基中,摇床150 r/min,28 ℃培养2天。
标准曲线的测定:取2个相同体积的离心管,分别用移液管准确移取10 mL的菌悬液,在4800 r/min的离心机离心15 min,弃去上清液,再加蒸馏水至10 mL,再次离心15 min,重复操作3次。 其中一个离心管中的菌泥,用少量的水完全转移到已经称重过的小烧杯中,80 ℃干燥至恒重,记录小烧杯和菌泥总重,得到菌泥的干重X;另一个离心管中的菌泥,转移至10 mL的比色管中定容,摇匀后,按照浓度由大到小的原则,稀释5个梯度,使得5个梯度的OD值在0.25~0.75,用1 cm比色皿测定在660 nm下的OD值,以酵母菌浓度X为横坐标,用测得的吸光度A值为纵坐标,绘制酵母菌的标准曲线。
鲁氏酵母浓度的测定:每隔2 h取样,分别取10 mL菌液于离心管中,离心10 min(4800 r/min),然后用蒸馏水清洗,再次离心,用分光光度计测出其吸光度,根据标准曲线计算菌体浓度,绘制鲁氏酵母的生长曲线。
1.4 鲁氏酵母培养条件的优化
1.4.1 培养温度对鲁氏酵母生物量的影响
将鲁氏酵母接入液体培养基中,分别置于26,28,30,32,34 ℃的恒温培养箱中(每个温度设置3组平行),培养36 h,测定菌体的浓度。
1.4.2 NaCl含量对鲁氏酵母生物量的影响
将酵母接入液体培养基中,培养基中的NaCl浓度分别为6%,8%,10%,12%,14%(每组设3个平行),于150 r/min摇床培养36 h,测定菌体的浓度。
1.4.3 pH值对鲁氏酵母生物量的影响
将酵母接入液体培养基中,培养基中的pH值分别为4.0,4.5,5.0,5.5,6.0(每组设3个平行),于150 r/min摇床培养36 h,测定菌体的浓度。
1.4.4 含氮量(酱油添加量)对鲁氏酵母生物量的影响
在液体培养基中分别添加0.05%,0.15%,0.25%,0.35%,0.45%的酱油(每组设3个平行),于150 r/min摇床培养36 h,测定菌体的浓度。
1.4.5 鲁氏酵母生长条件的优化
在单因素实验的基础上,对以上四因素进行三水平的正交试验,确定鲁氏酵母的最适生长条件,因素水平表见表1。

表1 因素水平表
2 实验结果与讨论
2.1 鲁氏酵母标准曲线的制作
鲁氏酵母的标准曲线见图1。

图1 鲁氏酵母的标准曲线
由图1可知,鲁氏酵母的吸光度(0.3~0.8)和浓度之间线性关系良好。
2.2 温度对鲁氏酵母生物量的影响
温度对鲁氏酵母生物量的影响,见图2。

图2 温度对鲁氏酵母生物量的影响
由图2可知,鲁氏酵母菌的生物量随着培养温度的升高呈现出先增加后下降的趋势,在30 ℃时达到最高,当温度超过32 ℃,酵母的生物量开始急剧减少。
随着培养温度的升高,酵母体内的酶活力也在增加,代谢加快,故酵母的生物量增加很快,但当温度超过32 ℃时,酵母体内的酶会迅速失活,代谢水平急剧下降,因而酵母的生物量也会急剧下降[7]。
2.3 氯化钠浓度对鲁氏酵母生物量的影响
氯化钠浓度对鲁氏酵母生物量的影响见图3。

图3 氯化钠浓度对鲁氏酵母生物量的影响
由图3可知,当培养基中盐浓度小于8%时,鲁氏酵母的生物量随培养基中盐浓度的增加而增加,当盐浓度超过8%时,鲁氏酵母的生物量随盐浓度的增加而下降。
NaCl是鲁氏酵母生长的重要因子,当培养基中的NaCl浓度较低时,限制鲁氏酵母的生长,故鲁氏酵母的生物量随着NaCl浓度的增加而增加;但当培养基中NaCl浓度高于8%时,由于一方面高浓度的盐会抑制酵母的生长,另一方面高浓度的盐也会使培养基的渗透压增加,超过了酵母能够耐受的程度,也会使酵母的生物量下降。
2.4 pH值对鲁氏酵母生物量的影响
pH值对鲁氏酵母生物量的影响见图4。

图4 pH对鲁氏酵母生物量的影响
由图4可知,鲁氏酵母菌在pH值为5时的生物量最高,pH值超过5时,随着pH值的增加,鲁氏酵母的生物量下降,过高或过低的pH都会影响鲁氏酵母的生长。
2.5 含氮量对鲁氏酵母生物量的影响
含氮量(酱油的添加量)对鲁氏酵母生物量的影响见图5。

图5 含氮量对鲁氏酵母生物量的影响
由图5可知,含氮量会影响鲁氏酵母的生长,当含氮量为0.15%时,此时的生物量最大,当超过了0.25%,鲁氏酵母的生物量随着含氮量的增加而减少。
氮源作为鲁氏酵母生长的重要底物,在底物浓度不足时会对酵母的生长起到限制作用,而浓度过高又对酵母的生长起到抑制作用,而且浓度越大,对酵母的抑制作用也越大。
2.6 正交试验结果
正交试验结果见表2。
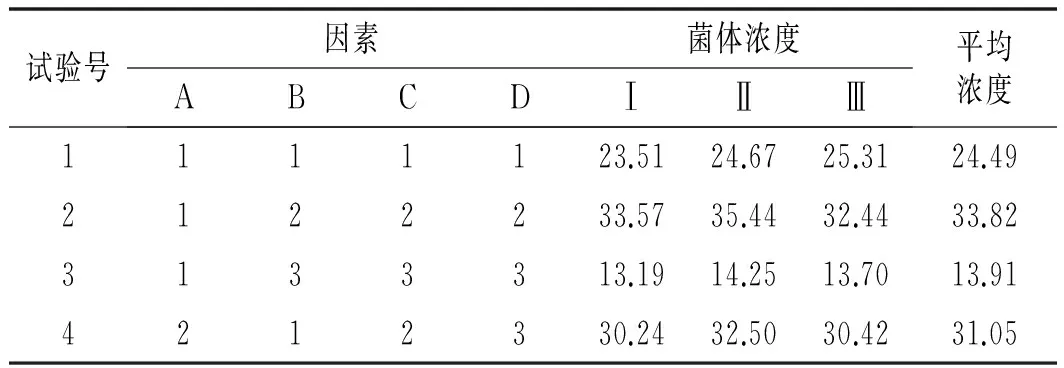
表2 L9(34)正交试验

续 表
由表2可知,选取的4个因素对酵母的生物量都有影响,其中温度对酵母菌体浓度的影响最显著,其余依次为盐浓度、pH、含氮量。鲁氏酵母生长的最优组合为A2B2C2D2,此时盐浓度为10%,温度为30 ℃,pH值为5,含氮量为0.15%。
之后在鲁氏酵母生长最优条件下重新进行接种,培养3天,再测定酵母的菌体浓度,最后测得的菌体含量为35.73 g/L,含量高于实验第二组A1B2C2D2的平均含量,所以通过正交试验得到的优化条件是可行的,可用于实际的生产。
3 结论
单因素试验和正交试验结果表明:复壮后的鲁氏酵母的适合生长条件为温度30℃,盐浓度10%,pH值5,含氮量0.15%。
[1]徐高丹,陈敏,蒋予箭.酵母菌对酿造酱油风味形成的影响[J].中国调味品,2011,36(1):29-30.
[2]Kim Jong K.Hybridoma of ZygosaccharomycesrouxiiandTorulopsisversatiliswhich produce aromas of soy sauce[P]. United States: 5210034,1993.
[3]孙泰山.微生物在酱油酿造中的应用[J].中小企业管理与科技(下旬刊),2012(6):307.
[4]蔡金星,曹小红,刘秀凤.酿造酱油酵母纯化、生长特性及初步应用研究[D].天津:天津科技大学,2004(5):1-2.
[5]林祖申.提高低盐固态发酵酱油质量风味的研究与探讨[J].中国酿造,2010(9):13-14.
[6]钱存柔.微生物学实验教程[M].北京:北京大学出版社,2008.
[7]戚以政,汪叔雄.生物反应动力学与反应器[M].北京:化学工业出版社,2007.
Study on Rejuvenation and Culture Conditions of Saccharomyces rouxii
ZHANG Li-wen1, LIU Zhen-rong2
(1.Yantai Economic School,Yantai 264000, China;2.College of Life Science,Yantai University,Yantai 264005, China)
The degeneratedSaccharomycesrouxiiis purified and rejuvenated.The cultivation conditions are investigated as well. The optimal conditions for the growth ofSaccharomycesrouxiiare obtained by the methods of single-factor experiment and orthogonal test. The results show that the optimal conditions for the growth of rejuvenated strains are as follows: salt concentration is 8%, temperature is 30 ℃, pH is 5, nitrogen content is 0.15% respectively.
Saccharomycesrouxii; separation; purification
2016-12-10
张立文(1964-),男,山东烟台人,高级讲师,研究方向:微生物发酵。
TS264.21
A
10.3969/j.issn.1000-9973.2017.05.010
1000-9973(2017)05-0049-03
