全自动智能染色机对临床微生物标本染色性能的评估
2017-05-15李颖陈欣欣赵颖刘亚丽王贺张小江杨启文徐英春
李颖 陈欣欣 赵颖 刘亚丽 王贺 张小江 杨启文 徐英春
·论著·
全自动智能染色机对临床微生物标本染色性能的评估
李颖 陈欣欣 赵颖 刘亚丽 王贺 张小江 杨启文 徐英春
目的 评估全自动智能染色机在临床微生物标本革兰染色、萋-尼抗酸染色和荧光抗酸染色方面的染色性能。方法 收集不同类型临床微生物标本103份,依据不同的染色需求予以革兰染色、萋-尼抗酸染色和荧光抗酸染色,同时进行手工法和全自动智能染色机染色操作,以手工法染色结果为参照,从染色结果一致率、染色效率、易操作性及安全性等方面评估全自动智能染色机的染色性能。结果 全自动智能染色机在不同类型临床微生物标本染色方面总体效果好,其对临床微生物标本的革兰染色[100% (58/58)]、萋-尼抗酸染色[100% (45/45)]和荧光抗酸染色[100% (45/45)]效果与手工法染色结果一致,且全自动智能染色机较手工染色法具有高通量、省时省力、易操作、稳定性好、无污染等优点。结论 全自动智能染色机对临床微生物标本具有良好的染色性能。
临床实验室技术; 染色与标记; 分枝杆菌属; 对比研究
近年来,医学微生物领域发生着巨大的变革,许多传统微生物检测技术已逐渐被简便、快捷的新技术与自动化机器取代,如法国梅里埃公司生产的Vitek 2 compact和美国BD公司生产的Phoenix 100全自动微生物鉴定及药物敏感性分析系统基本取代了传统的微生物手工生化鉴定,全自动血培养仪、飞行时间质谱等技术也正在微生物检测与鉴定领域大展身手[1-3]。临床微生物标本直接染色是微生物检验中最基本且重要的环节。通过染色可以根据菌体的着色性、有无特殊结构、排列分布方式等大致获得标本中的菌体类型和荷菌量等相关信息,对于辅助临床诊断及指导经验性用药具有重要意义。临床上常用的细菌染色方法有革兰染色,萋-尼抗酸染色和荧光抗酸染色等方法;其中,革兰染色应用最多,萋-尼抗酸染色法和荧光抗酸染色法则主要应用于分枝杆菌等某些不易着色病原体[4-5]。目前,国内大多数医院对细菌染色仍然采用传统的手工染色法,该方法需要连续的多个步骤,包括初染、媒染、脱色、复染、流水冲洗等,并且每个步骤都有明确规定的染色时间,超时或染色时间不足将严重影响标本的着色效果,继而干扰阅片人员的判断。此外,通量低、人力消耗大、稳定性差、易污染周边环境等也是手工染色法的弊端。自动染色机具有染色程序自动化、高通量、染色效果稳定等优点,近些年来越来越受到检验人员的青睐。笔者拟对韩国Standard公司生产的KS-S100全自动智能染色机在临床微生物标本革兰染色、萋-尼抗酸染色及荧光抗酸染色方面的染色性能进行检验,评估其应用价值。
材料和方法
一、材料
1.标本收集:按照评估实验需求,收集2016年3—5月北京协和医院检验科微生物室接收的临床患者送检标本,包括呼吸道标本、便标本、拭子标本、无菌体液标本等。其中,对于革兰染色,共收集43份临床送检标本,另收集临床分离菌株15株。对于萋-尼抗酸染色及荧光抗酸染色法,共收集分枝杆菌阳性痰标本14份,其中菌量+~++痰标本10份,菌量+++~++++痰标本4份;另收集分枝杆菌阴性痰标本31份。
2.试剂和机器:手工用革兰染色液、萋-尼抗酸染色液、荧光金胺O染色液购自珠海贝索生物技术有限公司;KS-S100全自动染色机用革兰染色液、萋-尼抗酸染色液、荧光金胺O染色液均采用仪器配套染色液。KS-S100全自动染色机由北京东方日创生物科技有限公司提供用于评估实验;普通光学显微镜购自德国徕卡显微系统有限公司,荧光显微镜购自奥林巴斯(中国)有限公司。
二、方法
1.标本涂片:痰标本、便标本直接用无菌棉签取适量涂玻片,干燥固定。胸腹腔积液标本、脑脊液标本采用细胞离心涂片机离心制片,干燥固定。纯培养菌落涂片取适量菌体,用1滴生理盐水研磨涂布于玻片上,干燥固定。所有标本均制片≥2张用于手工法和KS-S100仪器法两种染色手段的平行处理。制好的涂片在生物安全柜中紫外线照射1 h。
2.染色:手工法革兰染色、萋-尼抗酸染色、荧光抗酸染色操作流程完全参照标准程序进行[5-6]。KS-S100全自动染色机革兰染色、萋尼法抗酸染色、荧光法抗酸染色操作完全按照厂家指导说明进行。
3.镜检及结果判定:革兰染色和萋-尼抗酸染色标本在普通光学显微镜下进行观察。对于革兰染色,革兰阳性细菌呈紫色,革兰阴性细菌呈粉红色,酵母菌呈紫色。对于萋-尼抗酸染色,抗酸阳性细菌呈粉红色,抗酸阴性细菌呈蓝色。荧光抗酸染色标本在荧光显微镜下观察阳性荧光信号。对于生物标本染色,背景细胞着色清晰、细菌染色特征典型、染料杂质少判断为染色合格;背景细胞着色模糊、细菌染色特征不易辨认、染料杂质多判断为染色不合格[7]。以手工法染色结果作为参考,对于染色结果不一致的样本再次以手工法染色进行复核验证,计算2种染色方法染色结果的一致率(染色结果一致的样本数/总样本数×100%);并从染色效率、易操作性及安全性等方面进一步评估全自动智能染色机的染色性能。
结 果
一、染色效果
全自动智能染色机在不同类型临床微生物标本染色方面总体效果好,菌体着色清晰,染色特征易辨认,无染料杂质沉积等情况(图1~12)。
二、一致性比较
1.革兰染色:全自动智能染色机在不同类型临床微生物标本的革兰染色方面总体效果好,与手工法革兰染色结果一致(表1)。
2.萋-尼抗酸染色:全自动智能染色机在分枝杆菌萋-尼抗酸染色方面与手工法染色结果一致(表2)。
3.荧光抗酸染色:全自动智能染色机在分枝杆菌荧光抗酸染色方面与手工染色的结果一致(表3)。
三、染色性能评估
全自动智能染色机对临床微生物标本的染色效果好,与手工法染色结果一致。并且,全自动智能染色机在染色效率、易操作性、稳定性和安全性等方面均明显优于手工法(表4)。

表1 全自动智能染色机与手工法染色结果比对

续表1
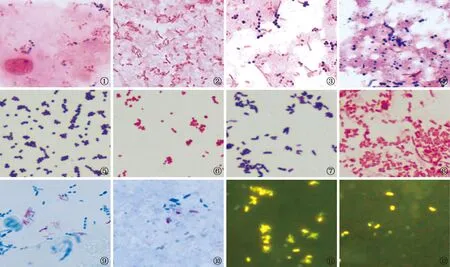
图1 全自动智能染色机对痰标本的革兰染色效果图,可见革兰阳性球菌、革兰阴性杆菌和革兰阳性杆菌 图2 全自动智能染色机对血培养阳性液标本的革兰染色效果图,可见革兰阴性杆菌 图3 全自动智能染色机对腹腔积液标本的革兰染色效果图,可见革兰阳性球菌和革兰阴性杆菌 图4 全自动智能染色机对粪便标本的革兰染色效果图,可见革兰阳性球菌和革兰阴性杆菌,形态多样 图5 全自动智能染色机对革兰阳性球菌纯菌涂片效果(金黄色葡萄球菌) 图6 全自动智能染色机对革兰阴性球菌纯菌涂片效果(卡他莫拉菌) 图7 全自动智能染色机对革兰阳性杆菌纯菌涂片效果(纹带棒杆菌) 图8 全自动智能染色机对革兰阴性杆菌纯菌涂片效果(大肠埃希菌) 图9,10 痰标本萋尼法抗酸染色(分枝杆菌) 图11,12 痰标本荧光法抗酸染色(分枝杆菌)

表2 不同分枝杆菌标本萋-尼抗酸染色手工法与全自动智能染色机染色法结果的比较

表3 不同分枝杆菌标本荧光抗酸染色手工法与全自动智能染色机染色结果的比较

表4 手工法与全自动智能染色机染色性能的对比
讨 论
微生物实验室的传统细菌染色技术是采用手工染色法依照具体步骤逐步完成,整个流程全部依靠手工操作,人员占用力度大;技术人员的操作手法、熟练程度等的差异易导致染色结果出现偏差,所以手工法染色结果重复性差,不易做到标准化,需要训练有素的技术人员进行操作[7-8]。染色时间的长短严重影响染色结果[9],标本量过多容易导致每一步骤的操作时间超过规定的染色时间继而影响染色效果,这使得手工染色法的染色通量受到一定的限制。此外,传统手工法染色需要靠近水池进行操作,染液易迸溅到周围物品上造成污染;同时,手工法染色处于开放环境中,流水冲洗及吹吸染液过程中易形成气溶胶危害。
相比之下,KS-S100全自动染色机无论是在操作简易程度上,还是染色效率上均较手工染色法具有优势。操作人员只需将制好的待染色玻片放入染色机中,选择好目标程序后即可通过自动化操作完成整个染色过程,人员活动自由,染色结束后取出已干燥的玻片直接镜检即可。KS-S100全自动染色机采用高通量设计,一个染色流程可处理40张待染色涂片,明显优于手工法染色通量;并且随着标本量的增加,全自动染色系统相比手工染色消耗的时间明显减少,高通量优势更为明显。自动染色机对操作人员的占用力度小,技术员可在仪器染色过程中进行镜检阅片等工作,在节省了操作人员人力消耗的同时,又将镜检结果报告时间提前,对后续检验工作和指导临床诊断及治疗等方面具有重要意义。在当前强调规范化操作、质量控制严格的环境下,如何做好标准化操作是各级实验室必须关注的。KS-S100全自动染色机操作不受人为因素影响,能够保证染色结果的稳定性,便于染色实验的规范化和标准化管理。此外,KS-S100自动染色机的系统呈封闭状态,染色过程中产生的所有废液都可以集中回收,不会造成染液遗洒和喷溅,从而提高了生物安全性及工作环境的整洁度。
本研究所涉及的微生物标本类型涵盖了临床常见的染色检查样本及菌株种类,能够有效地评价全自动智能染色机在临床微生物检验中的应用。该染色机在临床标本革兰染色、萋-尼抗酸染色和荧光抗酸染色方面的染色合格率高,与手工法染色结果一致,且在染色效率、易操作性、稳定性及安全性等方面均较传统手工染色具有明显优势。本研究表明,全自动智能染色机在临床微生物标本革兰染色、萋-尼抗酸染色、荧光抗酸染色方面染色性能良好,在提供高质量染色结果的同时,提高染色效率,减少人力占用,能满足临床微生物标本染色的需求。
[1] 王瑶, 徐英春, 谢秀丽, 等. 全自动微生物鉴定药敏分析仪对临床相关细菌药敏测定能力的评估. 中华检验医学杂志, 2007, 30(9):1052-1055.
[2] 赵忠, 杨秀莲, 张德明. Phoenix-100全自动微生物鉴定/药敏系统的临床应用. 宁夏医学杂志, 2007, 29(8): 751-752.
[3] 张丽, 徐英春. MALDI-TOF MS在临床微生物实验室的应用研究进展. 中国感染与化疗杂志, 2013, 13(3): 226-231.
[4] Popescu A, Doyle RJ. The Gram stain after more than a century. Biotech Histochem, 1996, 71(3): 145-151.
[5] 张秀明, 兰海丽, 卢兰芬. 临床微生物检验质量管理与标准操作程序. 北京: 人民军医出版社, 2010: 317-323.
[6] 中国防痨协会. 结核病诊断细菌学检验规程. 中国防痨杂志, 1996,18(1):28-29.
[7] 黎敏, 张峰领, 王浚霁, 等. 全自动革兰染色仪应用效果评价. 重庆医学, 2013, 42(36): 4445-4446.
[8] 黄静芳. 革兰染色影响因素的探讨. 实用医技杂志, 2006, 13(18): 3312-3313.
[9] 何建民. 浅谈细菌革兰染色的影响因素. 黑龙江医药科学, 2003, 26(1):62.
(本文编辑:李敬文)
Evaluation of the performance of automatic stainer in clinical microbiological samples staining
LIYing,CHENXin-xin,ZHAOYing,LIUYa-li,WANGHe,ZHANGXiao-jiang,YANGQi-wen,XUYing-chun.
DepartmentofClinicalLaboratory,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege,ChineseAcademyofMedicalSciences,Beijing100730,China
Correspondingauthor:YANGQi-wen,Email:yangqiwen81@163.com
Objective To evaluate the performance of automatic stainer in staining of clinical microbiological samples. Methods One hundred and three microbiological samples collected from clinical patients were disposed to staining according to detailed needs of gram staining, acid-fast staining or fluorescence auramine O staining. The manual staining and the automatic stainer methods were carried out paralleled. Consistency of the staining results, efficiency, operability, stability and bio-safety of these two approaches were compared to evaluate the performance of automatic stainer. Results The automatic stainer performed excellently in clinical microbiological samples staining with higher consistency to manual staining results on gram staining (100% (58/58)), acid-fast staining (100% (45/45)) and fluorescent staining (100% (45/45)) and merits of being efficient, easy to operate, stable and pollution-free. Conclusion The automatic stainer had favorable performance in staining of clinical microbiological samples.
Clinical laboratory techniques; Staining and labeling; Mycobacterium; Comparative study
10.3969/j.issn.1000-6621.2017.03.011
中国医学科学院医学与健康科技创新工程协同创新团队项目(2016-I2M-3-014)
100730 中国医学科学院北京协和医学院 北京协和医院检验科
注:李颖和陈欣欣对本文有同等贡献,为并列第一作者
杨启文,Email:yangqiwen81@163.com
2016-10-17)
