肉芽肿性多血管炎与肺结核的鉴别诊断(附一例报告)
2017-05-15陈禹李桂琴王宇鹏曲波李然高鸿美李茵茵
陈禹 李桂琴 王宇鹏 曲波 李然 高鸿美 李茵茵
·临床病例讨论·
肉芽肿性多血管炎与肺结核的鉴别诊断(附一例报告)
陈禹 李桂琴 王宇鹏 曲波 李然 高鸿美 李茵茵
肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)是一种病因未明的罕见多系统自身免疫性疾病。其特征为坏死性肉芽肿性炎和免疫性中小血管炎,大部分患者以呼吸道病变为首发症状,容易误诊为肺结核。笔者报道2015年1月本院收治的1例以“发热、肺部阴影、单侧胸腔积液”为主要临床表现的患者,诊断为肺结核及结核性胸膜炎,经抗结核治疗无效,为明确诊断,笔者组织临床专家对患者的诊断及治疗进行了讨论。患者经肺活组织检查及检测c-ANCA阳性后,最终诊断为肉芽肿性多血管炎。
血管炎, 变应性肉芽肿性; 结核,肺; 诊断, 鉴别; 结果与过程评价(卫生保健)
肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA)是一种坏死性肉芽肿性血管炎,属自身免疫性疾病。本病病变累及小动脉、静脉及毛细血管,偶尔累及大动脉,其病理以血管壁的炎症为特征,主要侵犯上、下呼吸道和肾脏,通常以鼻黏膜和肺组织的局灶性肉芽肿性炎症为开始,继而进展为血管的弥漫性坏死性肉芽肿性炎症。大部分患者以上呼吸道病变为首发症状,容易误诊为肺结核。笔者就1例GPA的诊断过程进行报告,并组织临床专家进行讨论,以提高结核科医生对本病的认识,减少误诊与误治。
临床资料
患者,男,52岁,公务员。因“咳嗽、发热、乏力2个月”,于 2015年 1月入住沈阳市胸科医院。既往健康,吸烟史35年,约20支/d;2个月前患者无明显诱因出现间断性咳嗽,咯少量白色黏痰,无痰中带血,每日5~6口,不含胃内容物,伴午后低热、乏力,无畏寒、寒战、腹痛、腹泻、心悸、气促、尿频、尿急、血尿及泡沫尿等症状和体征。2014年11月21日于外院行胸部增强CT扫描,显示右上肺团片阴影(图1~4)。疑诊肺炎、肺部肿瘤待除外。同期进行的正电子发射计算机体层摄影(PET)-CT检查显示右肺上叶及中叶软组织肿块影,提示炎性病变不能除外;右锁骨上淋巴结及右肺门淋巴结代谢增高;右侧胸腔少量积液。遂于外院呼吸科应用头孢噻利(1.0 g/次,2次/d,静脉点滴)抗感染治疗10 d,症状无好转。患者拟诊“肺肿物”于2015年1月5日收入我院肿瘤科,患者仍间断发热,最高体温升至38.5 ℃,咳嗽加重,少痰,伴右侧胸部针刺样疼痛,咳嗽时疼痛加重。胸部CT扫描复查,显示右上肺肿物,右侧中等量胸腔积液(图5~8)。因病变性质不明,行右肺肿物穿刺活检;病理检查结果显示纤维组织增生,可见灶状粉染无结构坏死组织及少量类上皮样细胞、多核细胞、慢性炎细胞(图9)。考虑坏死性肉芽肿性炎。1月12日胸腔彩色超声(简称“彩超”)引导下行右侧胸腔穿刺抽液术,胸腔积液病理检查见炎性细胞,未见典型瘤细胞 (图10)。
2015年1月15日疑诊右肺结核、结核性胸膜炎,为进一步明确诊断转入我科。体格检查:体温38.5 ℃,心率 85次/min,呼吸20次/min,血压110/80 mm Hg(1 mm Hg=0.133 kPa),SpO297%。患者意识清楚,外耳道无异常分泌物,听力正常;鼻腔无异常分泌物,鼻窦无压痛;口唇无发绀,全身皮肤、巩膜无黄染,浅表淋巴结未触及明显肿大;颈软,无抵抗,颈静脉无怒张。双肺叩诊清音,双肺听诊右肺下呼吸音略低,其余肺呼吸音清,两肺未闻及干湿性啰音;心率85次/min,心律齐,心脏各瓣膜听诊区未闻及明显病理性杂音。腹部平坦,全腹无压痛,无反跳痛及肌紧张;肝脾肋下未扪及,移动性浊音阴性;双下肢无水肿,病理征阴性。辅助检查:血常规、肝肾功能、尿常规正常。血肿瘤标记物糖类抗原125(CA125) 为97.24 U/ml (正常值0~35 U/ml),甲胎蛋白(AFP)、癌胚抗原(CEA)、细胞角蛋白19片段(cytokeratin-19-fragment,CYFRA21-1)、神经元特异性烯醇化酶(NSE)均未见明显异常;血红细胞沉降率(ESR)44 mm/1 h,血清结核抗体阴性,PPD皮肤试验强阳性(硬结平均直径18 mm,有水泡),血结核感染T细胞斑点试验(T-SPOT.TB)检查阳性,C反应蛋白(C-reaction protein,CRP)>12 mg/L。T细胞亚群检测:CD4细胞:310个/μl,CD8细胞:106个/μl,痰抗酸杆菌涂片检查3次阴性,痰结核分枝杆菌快速(BACTEC MGIT 960)培养阴性。胸腔积液实验室检查结果:红色浑浊,李凡他试验阳性,细胞数9800×106/L,淋巴细胞0.7,总蛋白56.7 g/L,腺苷脱氨酶35.24 U/L,乳酸脱氢酶1083 U/L,葡萄糖3.14 mmol/L,氯101 mmol/L。心电图未见明显异常。腹部彩超检查未见明显异常。胸腔彩超检查示右侧胸腔积液。纤维支气管镜检查,显示右肺上叶支气管黏膜充血、水肿,考虑右肺上叶支气管炎症;刷检组织行涂片检查,2张抗酸杆菌均阴性,刷检细胞学检查见少量炎细胞。
入院初步诊断:(1)右肺病变,结核可能性大、肿瘤不除外;(2)右侧结核性胸膜炎可能性大。予2H-R-Z-E/4H-R初治方案行诊断性抗结核治疗3周,患者仍发热,咳嗽、胸痛无好转,无其他症状出现。体格检查仍为右肺下呼吸音减弱,其余无阳性发现。胸腔彩超检查提示右侧胸腔积液,无明显改善。
病例讨论与临床诊治
王宇鹏(结核科) 该例患者特点:(1)中年男性,既往身体健康,无结核病接触史及结核病史,有吸烟史35年。(2)病程较长,主要症状为咳嗽、午后低热伴胸腔积液。(3)生命体征平稳,右肺下呼吸音略低。(4)血常规、肝肾功能、血肿瘤标记物未见明显异常,PPD皮肤试验强阳性;血T-SPOT.TB检查阳性;CRP>12 mg/L;胸腔积液化验呈渗出液改变,腺苷脱氨酶35.24 U/L。(5)胸部CT检查见右上肺团片影;PET-CT示右肺上叶及中叶软组织肿块影,提示炎性病变不除外;纤维支气管镜检查考虑右肺上叶支气管炎症,镜下刷检细胞学见少量炎细胞;右肺肿物穿刺活检,病理检查结果为坏死性肉芽肿性炎;胸腔积液病理检查见炎性细胞,未见典型瘤细胞。
该患者多方面证据已排除肺部肿瘤的可能性,仍考虑肺结核、结核性胸膜炎可能性大,而目前抗结核药物治疗时间较短,可能为疗效不佳的主要原因,也不能除外存在耐药可能或为非结核分枝杆菌(NTM)病;建议继续规范抗结核治疗,同时应进行痰及胸腔积液的结核分枝杆菌培养、DNA扩增菌种鉴定,GeneXpert MTB/RIF检查,进一步寻找细菌学诊断依据。明确是否存在耐药及除外非结核分枝杆菌病。
曲波(结核科) 患者呈亚急性发病,病程已达2个月,中年男性;根据临床主要表现、实验室检查结果及影像学特征,病因方面考虑:(1)感染:如结核分枝杆菌、真菌、早期肺脓肿等。患者首先考虑结核分枝杆菌感染,可继续寻找病原学证据,同时注意与肺脓肿及肺部真菌病的鉴别,需再次送检痰标本行致病菌培养及真菌培养,并完善1,3-β葡聚糖检测(G试验)、半乳甘露聚糖抗原检测(GM试验),同时动态观察肺部影像及胸腔积液化验的变化。(2)肿瘤:患者有长期大量吸烟史,胸部影像符合肺肿物合并感染,必要时行纤维支气管镜下活检或外科开胸肺活检,获得病理学证据,明确病变性质。(3)免疫性疾病:如结节病、类风湿关节炎、血管炎等免疫性疾病亦会形成肺部结节病变,但此类疾病通常除了肺部表现,还有全身系统性受累的表现。需继续观察患者有无其他系统受累表现。
高鸿美(呼吸科) 该患者暂不考虑肺炎(肺化脓症)及肺真菌病。肺部真菌性肉芽肿的常见形式是结节型组织胞浆菌病,它是一个界限清晰的坏死性肉芽肿,含大量的梗塞样粉红色的坏死,随后可能发生玻璃样变和钙化。而隐球菌好发于免疫功能低下者,如糖尿病、恶性肿瘤患者、人类免疫缺陷病毒感染者,以及接受免疫抑制剂治疗的患者等。隐球菌性肺部肉芽肿可无临床症状而仅有影像学异常,或只有低热、乏力、体质量下降、嗜睡等非特异性全身症状,或咳嗽、咯痰、痰中带血、胸痛等呼吸道症状。因患者既往身体健康状况良好,细胞免疫功能正常(CD4细胞:310个/μl;CD8细胞:106个/μl);无真菌感染高危因素,未查到真菌感染的病原学依据。患者肺内病灶以上肺野为主,边缘较清晰且渗出病灶较少,临床症状及胸腔积液化验亦不支持肺化脓症。
李茵茵(肿瘤科) 该患者肺内病灶穿刺组织活检提示肉芽肿病变。肉芽肿性肺疾病是一组病因不同但以肉芽肿性炎症和肉芽肿形成为病理特征的肺部疾病总称。肉芽肿是指巨噬细胞及其演化的细胞(如上皮样细胞、多核巨细胞)聚集和增生所形成的境界清楚的结节状病灶,是一种特殊的慢性增生性炎症。目前,我国缺乏肉芽肿性疾病的病因学研究资料。通常分成两大类:感染性肺肉芽肿和非感染性肺肉芽肿,前者包括结核分枝杆菌和非结核分枝杆菌、真菌、寄生虫,后者包括结节病、铍病、滑石肺肉芽肿、肉芽肿性血管炎、吸入性肺炎、类风湿结节等。也有少部分为原因不明的肉芽肿。当临床医生接到肉芽肿的病理回报时往往在鉴别诊断方面会遇到困难与挑战,综合本例患者的临床特点考虑不除外血管炎性疾病,需注意观察患者有无其他系统受损的相应症状及完善抗中性粒细胞胞浆抗体(ANCA)等相关检测。
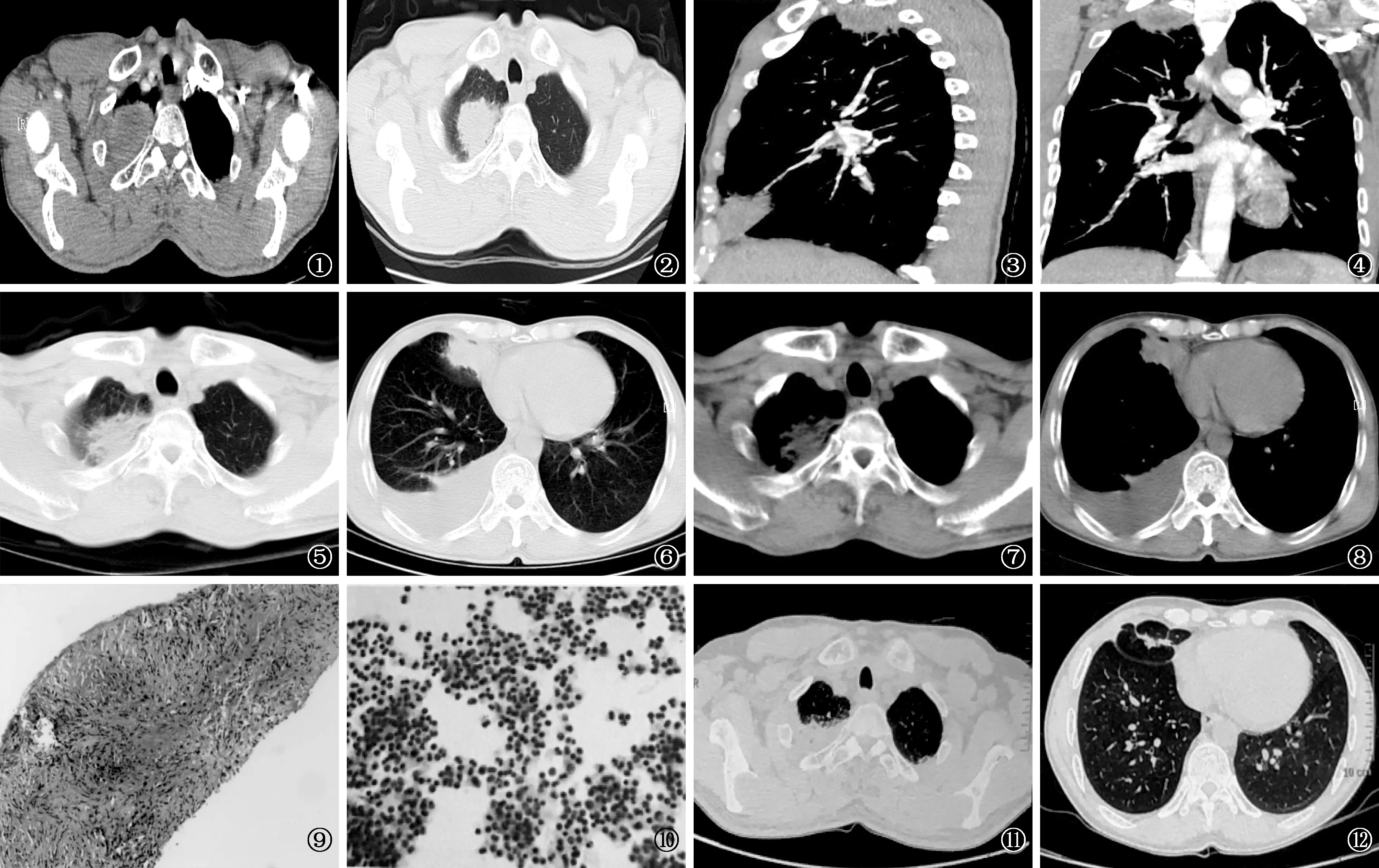
图1~4 2014年11月21日胸部CT增强扫描,显示右上肺团片影。炎症?肿瘤待除外? 图5~8 2015年1月5日胸部CT检查,右上肺肿物,伴右侧胸腔积液 图9 右肺肿物穿刺活检病理检查,可见纤维组织增生,灶状粉染无结构坏死组织,少量类上皮细胞、多核细胞、慢性炎细胞(HE ×100) 图10 胸腔积液涂片病理检查,可见炎性细胞(HE ×100) 图11,12 2015年4月1日胸部CT检查,右肺病变明显吸收,右侧胸腔积液明显减少
李桂琴(结核科) 患者经过抗结核药物治疗3周仍咳嗽、发热,且右侧胸腔积液无减少,肺活检病理为坏死性肉芽肿性炎,未查到肿瘤细胞。当感染、肿瘤和结核可能性逐渐变小时,越来越多的思考指向了GPA、嗜酸性肉芽肿性多血管炎(EGPA)等免疫性疾病,尽管目前患者无肾脏、眼、鼻、关节肌肉及皮肤受损表现,且血管炎性疾病引起胸腔积液者临床罕见,但不除外患者仍处于发病初期,临床症状尚不典型,亟待进一步完善其他系统评估及相关自身抗体检查以明确诊断。所以建议到上一级医院风湿免疫科就诊,完善相关检查。
与患者沟通病情后,患者就诊于中国医科大学附属第一医院风湿免疫科,复查肺增强CT:右肺部病灶增大,双肺间质性改变,纵隔淋巴结增大,右侧胸腔积液增多,出现心包积液。此时患者已经抗结核治疗5周,自觉发热、乏力症状逐渐加重伴痰中带血,尿常规检查显示尿蛋白微量,尿液镜检红细胞327.11个/高倍视野;尿液镜检白细胞3.89个/高倍视野;尿比重1.015,尿胆原(±),异常形态红细胞80%(出现肾脏损伤);粪便隐血++(可能伴有消化道受累情况);鼻窦CT平扫:双侧筛窦和左侧上颌窦黏膜增厚,鼻中隔弯曲。蛋白酶3(PR3)-ANCA阳性,胞质型ANCA(cANCA)阳性。经评估,患者有鼻、肺脏、肾脏等多系统受累表现,辅助检查提示ESR、CRP等炎性指标升高,ANCA尤其是PR3-ANCA阳性,且感染、肿瘤的证据不足,结合患者肺部病理为坏死性肉芽肿等特点,考虑诊断ANCA相关性血管炎(AAV),分类为GPA。给予甲强龙每日250 mg静脉点滴3 d后,改为每日120 mg静脉点滴14 d,期间给予环磷酰胺(CTX)冲击治疗2 d,分别为第1天0.4 g,第2天0.6 g,同时给予保护胃黏膜、补钙、保肝、营养心肌等治疗共3周。患者体温逐渐恢复正常,咳嗽、咯痰、胸痛明显减轻。2015年4月行肺高分辨率CT(HRCT)复查,显示胸腔积液消失,右肺上团片阴影较前明显缩小(图11,12)。
最终诊断: GPA。
讨 论
GPA首次由Friedreric Wegener博士报道于1936年,表述为累及上下呼吸道的坏死性肉芽肿病。直到1954年,Churg和Goodman将其描述为坏死性肾小球肾炎、坏死肉芽肿性呼吸道炎症及坏死性全身性血管炎的“韦格三联征”[1]。2012年的Chapel Hill会议正式将韦格纳肉芽肿(WG)更名为GPA,同时将Churg-Stmass综合征更名为EGPA[2-3]。GPA是一种潜在的危及生命的罕见疾病,病因未知。GPA的组织形态学特征在于血管内坏死性肉芽肿性炎症和中小血管的全身性坏死性血管炎。临床上,约80%的患者可见具有肺浸润,肺泡出血和快速进展性肾小球肾炎的肺-肾综合征。GPA与PR3-ANCA相关。治疗方案要依据器官受累的严重程度和疾病的活动程度来拟定,细胞免疫抑制剂或单克隆抗-CD20抗体通过血管周围肉芽肿性炎症活检被证实有效[4]。
一、诊断及误诊原因分析
1.病情特点:GPA主要侵犯上、下呼吸道和肾脏,通常以鼻黏膜和肺组织的局灶性肉芽肿性炎症为开始,继而进展为血管的弥漫性坏死性肉芽肿性炎症。临床常表现为鼻和副鼻窦炎、中耳炎、肺结节、空洞和进行性肾功能衰竭。还可累及关节、眼、皮肤、心脏、神经系统等[2],少数可累及消化道血管而致消化道出血、穿孔等急腹症表现。肺部受累约80%,其临床症状与其他肺部疾病无特异性区别,发热为其主要的临床表现,易误诊为其他间质性肺疾病、肺结核、肺癌、肺炎等。本例临床误诊,患者即为以发热、肺部症状为首发表现。因此,临床上诊断为上述肺疾病经相应治疗效果不佳时,应考虑GPA肺损伤,并进一步做相关检查。
2.胸部影像学检查:GPA的胸部影像学表现复杂多样且非特异性[5-6]。最常见的胸部CT表现为结节和肿块阴影,通常为多发并侵犯双侧,沿胸膜下或支气管血管分布。这些损伤通常较为散在,约25%并发空洞[5-9]。可伴有纵隔淋巴结肿大和肺门淋巴结肿大。胸膜受累不常见,特别是作为GPA的首发症状,估计占发病率的10%[10-12],而胸腔积液的病理生理在免疫疾病中需要进一步研究。其他少见表现为支气管扩张、心包炎、冠状动脉栓塞、主动脉炎等[13-14]。本例患者的肺部表现即为右肺上单发肿块并发右侧中等量胸腔积液,临床实属罕见,且胸腔积液化验与结核性胸膜炎基本相同,考虑此为误诊为肺部肿瘤及结核病的主要原因,需提醒临床医生注意。
3.病理改变:GPA的病理改变主要为坏死性肉芽肿和(或)血管炎[15],其特点为小血管非免疫复合物性炎症、水肿、纤维素样物沉积、增殖,最终导致血管腔狭窄、闭塞,引起组织缺血坏死,且为非干酪样坏死,并伴有上皮样细胞、巨细胞及多种炎症细胞浸润的肉芽肿。经纤维支气管镜行肺活检是发现血管炎性肉芽肿改变的重要手段之一,必要时可反复多处活检或剖胸肺活检以明确诊断[16]。结核感染所致肉芽肿,中心为大小不等的干酪样坏死区,肉芽肿大小差异较大,互相融合较多见,分布不均,网状纤维少。二者鉴别要点为干酪样坏死,病理切片也可以进一步进行抗酸染色,寻找抗酸杆菌,加以鉴别。
4.自身抗体检查:ANCA是诊断GPA、EGPA及显微镜下多血管炎(microscopic polyangiitis,MPA)3种小血管炎的有效工具[17]。ANCA的靶抗原有10余种,与临床最相关的是蛋白酶3(PR3) 和髓过氧化物酶(MPO),两者与ANCA相关血管炎及这些疾病的肾脏表现密切相关[18]。抗MPO抗体阳性强烈提示坏死性血管炎或特发性新月体性肾小球肾炎(NCGN),GPA 患者阳性率为24%;抗PR3 抗体在临床上与GPA密切相关,敏感性取决于疾病的活动性和病期阶段,在初发不活动的GPA 中,阳性率只有50%,而在活动性典型性GPA中,几乎100%为阳性[19]。本例患者在发病初期未进行自身抗体检测,忽略了对自身免疫性疾病肺部受累情况的筛查,是造成误诊误治的重要原因。
二、治疗
GPA的治疗与其他AAV类似,以糖皮质激素和CTX为代表的免疫抑制剂为主,尤其是肉芽肿性改变为主要改变时,CTX的地位尤其重要。在治疗过程中应在患者可耐受的前提下,及时、积极、大量、脉冲式使用CTX治疗,方可尽快达到诱导缓解的目的。对CTX治疗失败的患者,可以考虑多种免疫抑制剂联合使用,或使用CD20单抗等生物制剂。
几点体会:(1)临床上表现为发热、咳嗽、胸腔积液的患者,不能仅片面考虑常见的细菌性肺炎、肺结核等感染性疾病,还需开拓思路,基于详细系统的问诊、体格检查及辅助检查,筛查肿瘤、自身免疫性疾病肺部受累等情况。(2)建议诊断不明确或治疗效果不佳的肺部病变,尽早完善ANCA,因为系统性疾病继发肺改变时极易造成误诊误治,一定要提高警惕性,对此类疾病进行排查。(3)病理学、影像学诊断需要临床提供完整的资料及病情的演变过程才能更精准。(4)精准医疗需要有高精尖的检查,但切不可忽视肝功能、便、尿、血常规的检查结果。(5)多学科协作,对于提高临床诊断水平有重要意义。
[1] Petkovic TR, Radovic M, Pejcic T,et al. Wegener’s granulomatosis-case report. Acta Medica Medianae, 2008,47:78-81.
[2] Falk RJ, Gross WL, Guillevin L,et al. Granulomatosis with polyangiitis (Wegener’s): an alternative name for Wegener’s granulomatosis.Ann Rheum Dis,2011,70(4):704.
[3] Jennette JC, Falk RJ, Bacon PA,et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheumatism, 2013, 65(1):1-11.
[4] Kerstein A, Holl-Ulrich K, Müller A,et al. Granulomatosis with polyangiitis.Dtsch Med Wochenschr,2017,142(1):24-31.
[6] Ananthakrishnan L, Sharma N, Kanne JP,et al. Wegener’s granulomatosis in the chest: high-resolution CT findings. AJR Am J Roentgenol, 2009, 192(3):676-682.
[7] Aberle DR, Gamsu G, Lynch D. Thoracic manifestations of Wegener granulomatosis: diagnosis and course. Radiology,1990, 174(3 Pt 1):703-709.
[8] Papiris SA, Manoussakis MN, Drosos AA,et al.Imaging of thoracic Wegener’s granulomatosis: the computed tomogra-phic appearance. Am J Med, 1992, 93(5):529-536.
[9] Reuter M, Schnabel A, Wesner F, et al.Pulmonary Wegener’s granulomatosis: correlation between high-resolution CT fin-dings and clinical scoring of disease activity. Chest,1998, 114(2):500-506.
[10] Toffart AC, Arbib F, Lantuejoul S,et al.Wegener granulomatosis revealed by pleural effusion. Wegener Granulomatosis Revealed by Pleural Effusion. Case Rep Med,2009:164395.
[11] Blundell AG, Roe S. Wegener’s granulomatosis presenting as a pleural effusion.BMJ,2003 327(7406):95-96.
[12] Koyama S, Murakami K, Sakakibara T,et al. Massive pleural effusion and bronchopleural fistula in Wegener’s granulomatosis. Sarcoidosis Vasc Diffuse Lung Dis, 2010, 27(1):76-79.
[13] Martinez F,Chung JH,Digumarthy SR,et al. Common and uncommon manifestations of Wegener granulomatosis at chest CT: radiologic-pathologic correlation.Radiographics, 2012,32(1):51-69.
[14] Ananthakrishnan L,Sharma N,Kanne JP.Wegener’s granulomatosis in the chest: high-resolution CT findings. AJR Am J Roentgenol,2009,192(3):676-682.
[15] 钟南山,府军,朱元珏. 现代呼吸病进展.北京:中国医药科技出版社,1994,302.
[16] 张孔,曾辉,梁国庆,等.韦格纳肉芽肿病肺损害的临床分析.中华结核和呼吸杂志, 2003,26(10):623-625.
[17] 栗占国.凯利风湿病学.北京:北京大学医学出版社,2011:1485.
[18] 栗占国.自身抗体检测在自身免疫病中的临床应用专家建议.中华风湿病杂志,2014,18(7):437-443.
[19] 邹和建.自身抗体.北京:人民卫生出版社,2009:71-90.
(本文编辑:范永德)
Differentiating between granulomatosis with polyangiitis and pulmonary tuberculosis (A case report)
CHENYu,LIGui-qin,WANGYu-peng,QUBo,LIRan,GAOHong-mei,LIYin-yin.
DepartmentofTuberculosis,ShenyangTenthPeople’sHospital,ShenyangChestHospital,Shenyang110044,China
Correspondingauthors:LIGui-qin,Email:guiqinli2010@163.com;CHENYu,Email: 3337636@qq.com
Granulomatosis with polyangiitis (GPA) is a rare multisystem autoimmune disease of unknown etiology. Its hallmark features include necrotizing granulomatous inflammation and pauci-immune vasculitis in small- and mediumsized blood. Respiratory lesions is as common as the first manifestation of GPA. It is easily misdiagnosed as pulmonary tuberculosis. We reported a patient who presented with “fever, lung shadow, unilateral pleural effusion”.He was diagnosed with tuberculosis and tuberculous pleurisy in our hospital in January 2015.The anti-TB treatment was ineffective. In order to make a definite diagnosis, the author organized the clinical experts to discuss the diagnosis and treatment of the patient, and the final diagnosis of the disease was GPA after lung biopsy and c-ANCA detection positive.
Churg-strauss syndrome; Tuberculosis, pulmonary; Diagnosis, differential; Outcome and process assessment (health care)
10.3969/j.issn.1000-6621.2017.03.020
110044 沈阳市第十人民医院 沈阳市胸科医院结核科(陈禹、李桂琴、王宇鹏、曲波、李然),呼吸科(高鸿美),肿瘤科(李茵茵)
李桂琴,Email: guiqinli2010@163.com;陈禹,Email: 3337636@qq.com
2016-11-21)
