慢性乙型病毒性肝炎治疗现状和展望
2017-05-13王晶晶陈国凤廖家杰
王晶晶,陈国凤,廖家杰
·导向与述评·
慢性乙型病毒性肝炎治疗现状和展望
王晶晶,陈国凤,廖家杰
HBV感染是导致肝硬化和肝癌的主要原因,在过去20余年里,慢性乙型肝炎的治疗药物主要为干扰素和核苷(酸)类似物两大类,它们虽然能有效抑制病毒复制,但仍面临HBsAg清除率极低,安全停药难等问题,难以实现“临床治愈(或功能性治愈)”。新型的血清标志物的出现为指导临床如何安全停用抗病毒药物开辟了新的途径,同时,治疗慢性乙型肝炎的新型药物和生物制剂的崛起也给慢性乙型肝炎患者带来福音。
乙型肝炎;治疗;肝炎表面抗原;血清标志物
全球慢性HBV感染人数约3.5亿,如果不进行治疗,约1/4的感染者将死于肝硬化、肝衰竭或者肝癌。中国是WHO统计的感染人数最多的37个国家之一[1]。抗病毒治疗对慢性乙型肝炎(慢乙肝)患者来说是最重要的治疗,通过有效抗病毒治疗可以明显减轻肝脏炎症坏死,逆转肝纤维化,减少肝硬化和肝癌的发生,提高患者生活质量,延长患者寿命。本文将对慢乙肝治疗的现状及最新研究进展进行综述。
1 慢乙肝治疗现状
1.1 治疗目标 慢乙肝治疗的理想终点是HBeAg阳性和HBeAg阴性的患者,停药之后实现持久的HBsAg清除,伴或不伴HBsAg的血清学转换。慢乙肝治疗的满意终点:HBeAg 阳性患者,停药后获得持续的病毒学应答,ALT复常,并伴有HBeAg 血清学转换;HBeAg 阴性患者,停药后获得持续的病毒学应答和 ALT 复常。慢乙肝治疗的基本终点是如果停药后无法获得持续应答,至少在抗病毒治疗期间能够长期维持病毒学应答(HBV DNA 检测不到)。慢乙肝治疗的长期目标是提高患者的生活质量,延长生存时间,防止疾病进展至肝硬化、失代偿期肝硬化、终末期肝病、肝癌以及死亡等,尽可能实现慢乙肝的“临床治愈(或功能性治愈)”,即停止治疗后持续的病毒学应答,HBsAg消失,并伴有ALT复常和肝组织病变改善[2-5]。目前已有大量的研究表明早期有效的抗病毒治疗可以减轻肝脏炎症,逆转肝纤维化,减慢发展至终末期肝病和肝癌。Massimo等[6]的一项回顾性研究表明,HBeAg阴性的慢乙肝患者经长期核苷(酸)类似物[nucleos(t)ide analogues, NAs]治疗后实现HBsAg的清除,可伴或不伴HBsAg血清学转换,是可以安全停药的。HBsAg的清除可以最大程度地减少HCC的发生,延长患者寿命,基本达到临床治愈[3]。
1.2 目前慢乙肝的抗病毒药物治疗及存在的问题 目前国际公认的治疗慢乙肝的药物包括普通干扰素 (interferon, IFN)-α、聚乙二醇干扰素(pegylated interferon, Peg-IFN)α和NAs。目前的治疗方案虽能明显抑制病毒的复制,使血清中无法检测到HBV DNA,但对清除共价闭合环状DNA(covalently closed circle DNA, cccDNA)或者抑制cccDNA的转录无效。cccDNA的产生过程(见图2)为:首先HBV Dane病毒颗粒进入肝细胞后,脱去病毒包膜进入肝细胞质内成为核衣壳,然后脱去衣壳膜,细胞外的松弛环状的双链DNA(relaxed circular DNA, rcDNA)进入肝细胞核内,在宿主酶的作用下,形成cccDNA;再以cccDNA为模板,形成前基因组RNA(pregenome RNA, pgRNA);以pgRNA为模板,在HBV反转录酶作用下,形成子代rcDNA,并在肝细胞质中装配形成完整的HBV,释放出肝细胞,进入血液中;肝细胞质中的rcDNA也可再进入肝细胞核,再次形成cccDNA,继续同样的复制过程。这样,由于cccDNA的存在,使得病毒无法彻底清除,这才是慢乙肝无法治愈的真正原因。WHO及我国指南均推荐应用Peg-INFα、恩替卡韦(ETV)或者替诺福韦酯(TDF)作为初始的单药治疗药物[2-4]。然而,不论单药还是联合治疗,目前可用的治疗方法很难达到HBsAg清除(见表1),例如,Peg-IFNα抗病毒治疗48周停药后继续随访24周,只有3% 的HBeAg阳性和4%的 HBeAg阴性患者获得HBsAg清除[7-8]。在NAs治疗中HBsAg清除率极低,即使在TDF治疗中,也只有3%的HBeAg阳性患者治疗48周达到HBsAg清除,而HBeAg阴性患者中无一例达到HBsAg清除[9]。另外近期研究显示,针对慢乙肝患者,TDF联合Peg-IFNα治疗 48周,其HBsAg清除率优于任一单药治疗效果[10]。因此目前在慢乙肝的临床治疗中面临的主要问题,一方面是如何提高HBsAg清除率,尽可能达到功能性治愈或完全治愈;另一方面,遵循目前指南推荐的停药标准,停药后的病毒反弹率仍较高,如何寻找到新的标志物指导临床安全停药。除此之外,在HBV与HCV共感染、接受免疫抑制剂治疗以及生物治疗的患者中出现的HBV再激活问题也须要引起的极大的关注[11-12]。

图1 cccDNA和pgRNA形成过程示意图[13]Figure 1 Model on the production of cccDNA and pgRNA[13]
2 预测慢乙肝治疗效果的血清标志物
2.1 qHBsAg在慢乙肝治疗中的作用 血清HBsAg定量(serum quantitative hepatitis B surface antigen, qHBsAg)与肝内cccDNA的转录活性是密切相关的[15],清除HBsAg可以显著降低慢乙肝患者发生肝硬化、肝癌的风险,因此qHBsAg在慢乙肝治疗中发挥举足轻重的作用。目前临床中常用的NAs和IFN-α这两类抗病毒药物中,NAs治疗时qHBsAg下降相对不明显[16],而IFN-α阴转HBsAg的作用有限,常出现不良反应,因此如何更好的提高HBsAg的阴转率是我们亟待解决的问题。之前有研究报道,在LdT和TDF抗病毒过程中,早期快速的qHBsAg下降与HBsAg 消失相关[17-18]。那么如何定义qHBsAg下降的最佳临界值和时间点须进一步研究。近期Peng等[19]针对以上问题做了一系列研究,结果显示HBeAg阳性患者分别在最初治疗3个月和HBeAg阴性患者最初治疗的12个月时qHBsAg下降≥ 基线的75%可预测慢乙肝治疗的效果,包括病毒学应答、HBeAg血清学转换、HBsAg<100 IU/ml和HBsAg的消失。该研究明确了在NAs治疗过程中,早期的qHBsAg下降可以预测预后,同时明确了qHBsAg下降的最佳临界值和最佳时间点。因此早期测定qHBsAg的下降可以协助临床确定预测某些关键的治疗终点。

表1 慢乙肝患者接受单药和联合治疗时HBsAg清除率(%)[14]Table1 HBsAg clearance rate to monotherapy and combination therapies in patients with chronic hepatitis B(%)[14]
NAs治疗是一种广泛应用于慢乙肝患者有效的抗病毒治疗方式,但是,停药复发常见,因此须要长期服药。qHBsAg不但可以预测预后、HBsAg消失,还可以预测HBV复发。在LAM和LdT抗病毒治疗中,治疗结束时qHBsAg水平和早期qHBsAg的下降率均可以预测停药后的持续应答和指导停药时间[20-21]。Chen等[22]研究结果显示在HBeAg阴性患者中治疗结束时的qHBsAg值为200 IU/ml可以预测LAM停药之后的应答反应,治疗结束时qHBsAg的水平是最重要的因素,且qHBsAg值为150 IU/ml是预测HBV复发的最佳临界值,不论在HBeAg阳性还是阴性患者中,qHBsAg的基线水平和治疗结束时的水平均是HBV复发的独立预测因子[23]。
2.2 新型血清标志物在慢乙肝治疗中的作用 HBV cccDNA的彻底清除是目前公认的“治愈”的指征,但由于检测肝组织内HBV cccDNA的含量须行肝组织活检,在临床工作中较难开展,因此目前临床迫切地须要寻找一些易于操作且能反应cccDNA水平的血清学标志物替代检测指标。早在1996年,Köck 等[24]已经在HBV感染者的外周血单核细胞中检测到了HBV RNA的存在。Jansen等[25]报道慢乙肝患者NAs治疗期间HBV RNA水平高于HBV DNA水平,Peg-IFNα治疗可以诱导HBV RNA的明显下降,NAs联合Peg-IFNα抗病毒治疗使HBV RNA水平更低,因此HBV RNA水平的下降程度与治疗应答效果相关。近年来,有研究认为,在HBeAg阳性患者中,血清HBV RNA可以预测血清学应答效果[26]。鲁凤民研究团队对HBV RNA进行了更进一步研究,首先明确提出血清HBV RNA就是被包裹的pgRNA,是以类似于HBV样的病毒颗粒存在。再次提出在应用NAs治疗之后HBV pgRNA病毒颗粒的水平较前增加,同时阻止pgRNA的核衣壳形成后使pgRNA的水平下降,鉴于此,临床上可以考虑研究针对核衣壳装配的抗病毒新药物[13]。因此,在NAs治疗过程中,血清中的HBV pgRNA可能会成为指导临床安全停药的一个新的生物标志物 。在2017年亚太肝病学会会议上,鲁凤民团队提出应将传统的病毒学应答(HBV DNA检低于检测下限)做重新的定义,那就是HBV DNA联合RNA共同低于检测下限,并表示血清HBV RNA可以反映肝内cccDNA的转录活性,因此可以把血清HBV RNA持续消失作为安全停药的指征[27]。
在对肝内cccDNA血清标志物替代物的研究上,国内外均做了很多工作。除以上介绍的HBV RNA新的标志物之外,还要介绍另一种新型的标志物:血清乙肝核心相关的抗原(serum hepatitis B core-related antigen, HBcrAg)。Chen等[28]最新研究中指出与qHBsAg相比,血清HBcrAg定量(serum quantitative HBcrAg, qHBcrAg)更能强烈地体现出与肝内cccDNA的相关性,而且随着qHBcrAg和qHBsAg的下降,肝内cccDNA水平也随之下降,其中qHBcrAg的下降对cccDNA影响更大,因此血清qHBcrAg是一个令人满意的肝内cccDNA替代标志物,这对临床评估目前抗病毒药物的疗效、预后及选择停药时机具有重要意义。
3 治疗慢乙肝的新药及生物制剂的研究进展
目前治疗慢乙肝的新药大概分为两类[29](详见表2)。第一类主要针对HBV生活周期。包括病毒进入、HBV DNA聚合酶、HBV cccDNA、HBV基因表达、HBV核衣壳以及病毒蛋白的分泌等多个阶段的作用,其中即将问世进入临床应用的是正在进行的Ⅲ期临床试验的一种新型的替诺福韦艾拉酚胺(tenofovir alafenamide besifovir, TAF),它的抗病毒效果与TDF相似,但明显减轻了对骨质和肾的损害等不良反应[30-31]。另外研究更多的热点,一方面集中于如何抑制HBV cccDNA的转录、生成及使其发生突变等方面,但仍均处于临床前期阶段。另一方面集中于抑制HBV的基因表达方面,比如近年美国生物技术公司Arrowhead发布旗下慢乙肝候选药物ARC-520,是一款基因RNA干扰(RNAi)技术设计的药物,通过作用于mRNA靶点,干扰HBV反转录过程,导致病毒无法增殖,然后再利用人体免疫系统清除剩余病毒,特征为HBsAg血清学转阴以及有或无血清学转换,从而获得慢乙肝的功能性根治[32-33]。除此之外针对HBV核衣壳的研究也成为了近几年研究的热点,2017年亚洲太平洋肝病学会年会上报告了一项Ⅰb期研究,其内容主要是AL-3778——一种口服HBV衣壳组装调节剂,其单药或联合Peg-IFNα用于初治HBeAg阳性慢乙肝患者,结果显示随着AL-3778剂量的增加,HBV DNA和HBV RNA定量的下降幅度增大,考虑该药物可以有效干扰HBV RNA核衣壳组装过程。
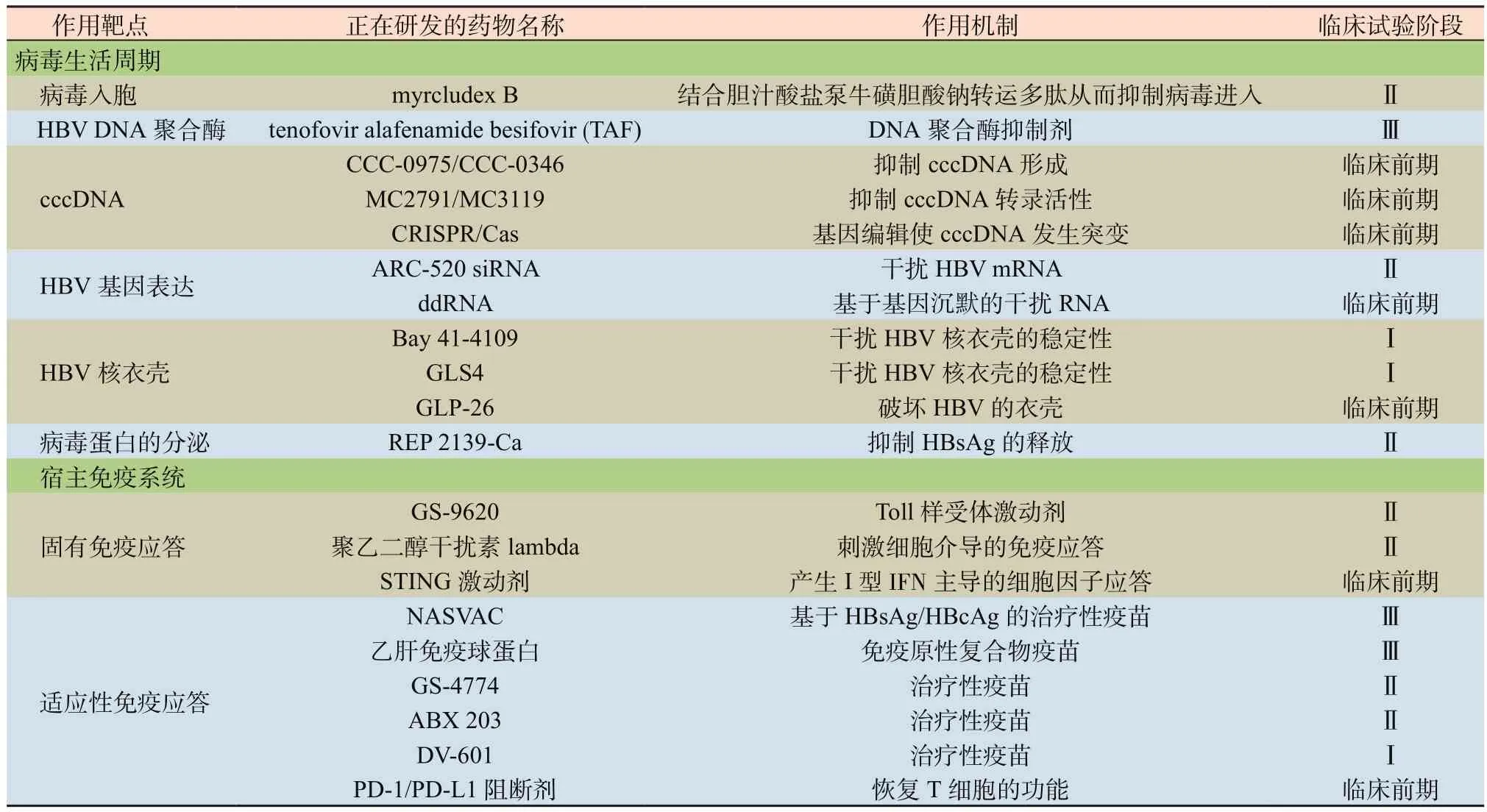
表2 治疗慢乙肝的新型药物汇总[14]Table 2 Emerging drugs for chronic hepatitis B[14]
第二类主要针对宿主免疫系统:包括宿主的固有免疫和适应性免疫两方面,其中主要研究集中在如何增强宿主的适应性免疫和各种治疗性疫苗的研发。其中一项疫苗基本处于临床试验Ⅲ期阶段,相信很快也可以应用于临床。近期维也纳医科大学病理生理学研究所专家在一项II b期试验中发现一种新型的抗草花粉变态反应的疫苗(BM32)能够有效对抗HBV感染,这表明肽-载体融合蛋白的概念或许为今后研发改善慢乙肝的免疫疗法提供新的思路[34]。
除此之外,还有其他未列出的治疗慢乙肝潜在的药物,例如核酸聚合物(nucleic acid polymers, NAPs )在治疗慢乙肝过程中起着重要的抗病毒效应,或还能改善免疫治疗的效果,或将成为未来慢乙肝联合治疗方案中重要的组成部分[35]。
慢乙肝的治疗除以上提及的新型药物之外,还有一些相关生物制剂。近2年国内外比较热门的研究方向主要针对粪便微生物菌群移植(fecal microbiota transplantation, FMT)。肠道微生物菌群在HBV年龄相关性的免疫清除中发挥重要作用[36],既往有多个研究显示肝硬化患者与健康人微生物群是不同的[37-38]。近年来厦门大学附属中山医院Ren团队提出FMT可以诱导相当一部分长期抗病毒治疗后仍表现为HBeAg阳性的患者实现HBeAg清除[39]。这对长期抗病毒治疗HBeAg持续阳性的患者是一个福音。虽然在FMT治疗组中只有5例患者,但可以观察到显著的统计学差异和惊人的结果。该项试验结果提示了调节肠道菌群对慢乙肝治疗是有好处。然而,未来需要进一步的大型临床研究加以证实。
4 展 望
2016年,WHO提出了到2030年消除肝炎危害的目标[40],简称“2030目标”,它已成为全球肝病防治领域的“一号课题”。目前Peg-IFNα和高效低耐药的抗病毒药(ETV、TDF)仍将是临床上治疗慢乙肝的主要药物,但是,在不远的将来,TAF将成为治疗慢乙肝较为安全的长期有效的核苷(酸)类抗病毒药物,同时随着治疗慢乙肝的新型药物和生物制剂的不断发展,在医学届人士的不断付出以及政府机构、非政府组织、社会以及患者个人的共同努力下,2030年可以实现根治慢乙肝这一美好愿望。
[1] Liang TJ, Block TM, McMahon BJ, et al. Present and future therapies of hepatitis B: from discovery to cure[J]. Hepatology, 2015, 62(6):1893-1908.
[2] Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016, 10(1):1-98.
[3] Terrault NA, Bzowej NH, Chang KM, et al. AASLD guidelines for treatment of chronic hepatitis B[J]. Hepatology, 2016, 63(1):261-283.
[4] WHO. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection[J]. http://www.who.int/hiv/ pub/hepatitis/hepatitis-b-guidelines/en/.
[5] 中华医学会肝病学分会,中华医学会感染病学分会.《慢性乙型肝炎防治指南》(2015更新版)[J]. 传染病信息,2015,28(6):321-340.
[6] Fasano M, Ciarallo M, Niro G, et al. HBsAg loss is enough to discontinue long-term nucleos(t)ide analogue therapy in HBeAgnegative chronic hepatitis B patients in real practice? [J]. J Hepatol, 2016, 64(1 Suppl):213-424.
[7] Marcellin P, Lau GK, Bonino F, et al. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B[J]. N Engl J Med, 2004. 351(12):1206-1217.
[8] Lau GK, Piratvisuth T, Luo KX, et al. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2005, 352(26):2682-2695.
[9] Marcellin P, Heathcote EJ, Buti M, et al. Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B[J]. N Engl J Med, 2008, 359(23):2442-2455.
[10] Marcellin P, Ahn SH, Ma X, et al. Combination of tenofovir disoproxil fumarate and peginterferon α-2a increases loss of hepatitis B surface antigen in patients with chronic hepatitis B[J]. Gastroenterology, 2016, 150(1):134-144.
[11] Loomba R, Liang TJ. Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: current concepts, management strategies and future directions[EB/OL].[2017-03-26]. http://dx.doi.org/10.1053/j.gastro.2017.02.009.
[12] Chen G, Wang C, Chen J, et al. Hepatitis B reactivation in hepatitis B and C coinfected patients treated with antiviral agents: A systematic review and meta-analysis[EB/OL]. [2017-03-26]. http:// dx.doi.org/10.1002/j.hep.2016.05.029.
[13] Wang J, Shen T, Huang X, et al. Serum hepatitis B virus RNA is encapsidated pregenome RNA that may be associated with persistence of viral infection and rebound[J]. J Hepatol, 2016, 65(4):700-710.
[14] Chen GF, Wang C, Lau G. Treatment of chronic hepatitis B infection-2017[J]. Liver Int, 2017, 37 (Suppl 1): S59-S66.
[15] Thompson AJ, Nguyen T, Iser D, et al. Serum hepatitis B surface antigen and hepatitis B e antigen titers: disease phase influences correlation with viral load and intrahepatic hepatitis B virus markers[J]. Hepatology, 51(6):1933-1944.
[16] Reijnders JG, Rijckborst V, Sonneveld MJ, et al. Kinetics of hepatitis B surface antigen differ between treatment with peginterferon and entecavir[J]. J Hepatol, 2011, 54(3):449-454.
[17] Marcellin P, Buti M, Krastev Z, et al. Kinetics of hepatitis B surface antigen loss in patients with HBeAg-positive chronic hepatitis B treated with tenofovir disoproxil fumarate[J]. J Hepatol, 2014. 61(6):1228-1237.
[18] Wursthorn K, Jung M, Riva A, et al. Kinetics of hepatitis B surface antigen decline during 3 years of telbivudine treatment in hepatitis B e antigen-positive patients[J]. Hepatology, 2010, 52(5):1611-1620.
[19] Peng CY, Lai HC, Su WP, et al. Early hepatitis B surface antigen decline predicts treatment response to entecavir in patients with chronic hepatitis B[J]. Sci Rep, 2017, 7: 42879.
[20] Cai W, Xie Q, An B, et al. On-treatment serum HBsAg level is predictive of sustained off-treatment virologic response to telbivudine in HBeAg-positive chronic hepatitis B patients[J]. J Clin Virol, 2010, 48(1):22-26.
[21] Chan HL, Wong GL, Chim AM, et al. Prediction of off-treatment response to lamivudine by serum hepatitis B surface antigen quantification in hepatitis B e antigen-negative patients[J]. Antivir Ther, 2011, 16(8):1249-1257.
[22] Chen CH, Lu SN, Hung CH, et al. The role of hepatitis B surface antigen quantification in predicting HBsAg loss and HBV relapse after discontinuation of lamivudine treatment[J]. J Hepatol, 2014, 61(3):515-522.
[23] Chen CH, Hung CH, Hu TH, et al. Association between level of hepatitis B surface antigen and relapse after entecavir therapy for chronic hepatitis B virus infection[J]. Clin Gastroenterol Hepatol, 2015, 13(11):1984-1992.
[24] Köck J, Theilmann L, Galle P, et al. Hepatitis B virus nucleic acids associated with human peripheral blood mononuclear cells do not originate from replicating virus[J]. Hepatology, 1996, 23(3):405-413.
[25] Jansen L, Kootstra NA, van Dort KA, et al. Hepatitis B virus pregenomic RNA is present in virions in plasma and is associated with a response to pegylated interferon alfa-2a and nucleos(t)ide analogues[J]. J Infect Dis, 2016, 213(2):224-232.
[26] van Bömmel F, Bartens A, Mysickova A, et al. Serum hepatitis B virus RNA levels as an early predictor of hepatitis B envelope antigen seroconversion during treatment with polymerase inhibitors[J]. Hepatology, 2015, 61(1):66-76.
[27] 鲁风民,王杰, 陈香梅,等. 乙型肝炎病毒RNA病毒样颗粒的发现及其对抗病毒治疗临床实践的潜在影响[J].中华肝脏病杂志,2017,25(2):105-110.
[28] Chen EQ, Feng S, Wang ML, et al. Serum hepatitis B core-related antigen is a satisfactory surrogate marker of intrahepatic covalently closed circular DNA in chronic hepatitis B[J]. Sci Rep, 2017, 7(1):173.
[29] Bitton Alaluf M, Shlomai A. New therapies for chronic hepatitis B[J]. Liver Int, 2016, 36(6):775-782.
[30] Buti M, Gane E, Seto WK , et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg negative chronic hepatitis B virus infection a randomised double blind phase 3 non inferiority trial[J]. Lancet Gastroenterol hepatol, 2016, 1(3):196-206.
[31] Chan HL, Fung S, Seto WK, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg positive chronic hepatitis B virus infection a randomised double blind phase 3 non inferiority trial[J]. Lancet Gastroenterol Hepatol, 2016, 1(3):185-195.
[32] Liu SH, Seto WK, Lai CL, et al. Hepatitis B: treatment choice and monitoring for response and resistance[J]. Expert RevGastroenterol Hepatol, 2016, 10(6):697-707.
[33] Gish RG, Yuen MF, Chan HL, et al. Synthetic RNAi triggers and their use in chronic hepatitis B therapies with curative intent[J]. Antiviral Res, 2015, 121:97-108.
[34] Cornelius C, Sch neweis K, Georgi F, et al. Immunotherapy with the preS-based grass pollen allergy vaccine BM32 induces antibody responses protecting against hepatitis B infection[J]. EBioMedicine, 2016, 11:58-67.
[35] Al-Mahtab M, Bazinet M, Vaillant A. Safety and efficacy of nucleic acid polymers in monotherapy and combined with immunotherapy in treatment-naive Bangladeshi patients with HBeAg+ chronic hepatitis B infection[J]. PLoS One, 2016, 11(6):e0156667.
[36] Chou HH, Chien WH, Wu LL, et al. Age-related immune clearance of hepatitis B virus infection requires the establishment of gut microbiota[J]. Proc Natl Acad Sci USA, 2015, 112(7):2175-2180.
[37] Chen Y, Yang F, Lu H, et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatology, 2011, 54(2):562-572.
[38] Qin N, Yang F, Li A, et al. Alterations of the human gut microbiome in liver cirrhosis[J]. Nature, 2014, 513(7516):59-64.
[39] Ren YD, Ye ZS, Yang LZ, et al. Fecal microbiota transplantation induces hepatitis B virus e-antigen (HBeAg) clearance in patients with positive HBeAg after long-term antiviral therapy[EB/OL].[2017-03-26]. http://online librarl.wiley.com/doi/10.1002-hep.29008-full.
[40] WHO. Global health sector strategy on viral hepatitis, 2016-2021[EB/OL]. [2017-04-08]. http://www.who.int/hepatitis/ strategy2016-2021/ghss-hep/en/.
(2017-03-26收稿 2017-04-08修回)
(本文编辑 张云辉)
Treatment of chronic hepatitis B infection: status quo and prospect
WANG Jing-jing, CHEN Guo-feng*, LIAO Jia-jie*
Second Liver Cirrhosis Diagnosis and Treatment Center, 302 Military Hospital of China, Beijing 100039, China
HBV infection is the major cause of liver cirrhosis and hepatocellular carcinoma. Over the past two decades, there are currently two classes of drugs approved for the treatment of hepatitis B: a finite antiviral and immunomodulatory treatment with peginterferon or long-term treatment with nucleos (t) ide analogues.While they can potently suppress the virus replication, they have low rate of HBsAg clearance and common virological relapse after the cessation of therapy. So it is difficult to achieve clinical cure or complete cure. Now appearring of new biomarkers may open the way of stopping nucleos (t) ide analogues clinical use safely. Meanwhile various anti-HBV drugs or biological agents are in the development pipeline, which can bring hope to thousands of hepatitis B patients.
hepatitis B; treatment; HBsAg; biomarker
R512.62
A
1007-8134(2017)02-0065-06
10.3969/j.issn.1007-8134.2017.02.001
北京市科委2016年度科技计划重大项目(D161100002716003);国家科技重大专项课题(2013 ZX10002004);北京医学奖励基金资助项目(YJHYXKYJJ-247)
100039 北京,解放军第三〇二医院肝硬化诊疗二中心(王晶晶,陈国凤);香港天下仁心肠胃及肝脏中心(廖家杰)
陈国凤,E-mail: guofengchen302@163.com;廖家杰,E-mail: gkklau@netvigator.com
* Corresponding author. CHEN Guo-feng, E-mail: guofengchen302@163.com; LIAO Jia-jie, E-mail: gkklau@netvigator.com
