重组溶瘤流感病毒靶向杀伤肝癌细胞的实验研究
2017-05-13任天宇段跃强王希良张绍庚杨鹏辉
孙 芳,任天宇,严 锦,段跃强,王希良,张绍庚,杨鹏辉
·论 著·
重组溶瘤流感病毒靶向杀伤肝癌细胞的实验研究
孙 芳,任天宇,严 锦,段跃强,王希良,张绍庚,杨鹏辉
目的拯救获得重组溶瘤流感病毒株rFlu△NS/HCC,对其全面鉴定并评价特异性杀伤肝癌细胞的效果。方法利用流感病毒反向遗传学(reverse genetics, RG)技术,以A/Puerto Rico/8/34(PR8)为载体,将NS基因部分敲除,构建重组质粒pFlu△NS1,与流感病毒PR8的7个质粒pHW191-PB2、pHW192-PB1、pHW193-PA、pHW194-HA、pHW195-NP、pHW196-NA、pHW197-M共转染MDCK和COS-Ⅰ细胞,经拯救、筛选、鉴定获得重组溶瘤流感病毒,命名为rFlu△NS/HCC。重组溶瘤流感病毒株rFlu△NS/HCC经SPF鸡胚扩大培养、超滤浓缩、蔗糖密度梯度离心纯化等步骤获得重组病毒,通过血凝试验、RT-PCR、电镜观察病毒形态等方法对rFlu△NS/HCC进行全面鉴定,并通过MTS细胞活力测定、细胞病变检测评价重组溶瘤流感病毒对不同类型肝癌细胞系的杀伤效果。结果成功拯救重组溶瘤流感病毒rFlu△NS/ HCC,血凝效价为29~10,在HpG2细胞上感染病毒滴度log10TCID50/ml为6.5。MTS和结晶紫染色检测结果显示,重组溶瘤流感病毒rFlu△NS/HCC感染复数(multiplicity of infection, MOI)≥1时,能够显著降低HepG2细胞活力(P均<0.05);MOI≥3时,对SMMC-7721细胞活力影响达显著水平(P均<0.05);而不同MOI值的rFlu△NS/HCC对正常细胞L02无明显影响。结论重组溶瘤流感病毒rFlu△NS/HCC能靶向杀伤肝癌细胞,有望为临床肝癌靶向治疗提供新的治疗策略。
流感病毒;溶瘤病毒;肝癌细胞
肝癌是我国常见的恶性肿瘤,病死率位居第二,每年发病接近40万人[1]。因其恶性度高、病情进展快,临床上发现时大多数患者已处于中晚期,病死率和复发率高,预后差[2]。溶瘤病毒是一类具有复制能力的肿瘤杀伤型病毒,能够靶向在肿瘤细胞中复制和增殖,致肿瘤细胞溶解和死亡,而不影响正常细胞,为临床肿瘤治疗提供了新思路[3-4]。目前已有包括腺病毒、Ⅰ型单纯疱疹病毒、新城疫病毒、牛痘病毒、水疱性口炎病毒和麻疹病毒等在内的10余种溶瘤病毒用于肿瘤临床研究,充分证实了溶瘤病毒在肿瘤治疗领域广阔的应用前景[5-7]。
流感病毒为单股负链、分节段的RNA病毒,反向遗传学(reverse genetics, RG)技术易于操作且不存在潜在DNA安全性问题等优势,为开
发溶瘤病毒药物提供了新思路。在前期本课题组建立了成熟的流感病毒RG平台,基于流感病毒为载体的重组病毒株rFLU-RSV、rFLU-HAdv、rHCV/FLU均在小鼠体内产生良好的黏膜免疫、体液免疫及细胞免疫应答,同时可产生免疫保护效果[8-9]。本研究利用RG技术,以期获得流感病毒PR8为载体的重组溶瘤流感病毒rFlu△NS/ HCC,用MTS、结晶紫染色检测其对肝癌细胞的体外抑制作用,为肝癌的临床治疗提供理论依据和技术支撑。
1 材料与方法
1.1 细胞、质粒、病毒、鸡胚 MDCK细胞、COS-Ⅰ细胞均购自美国ATCC(American Type Culture Collection)细胞库,正常肝细胞(L02)、肝癌细胞系(SMMC-7721、HepG2)由本中心保存;流感病毒8个质粒pHW191-PB2、pHW192-PB1、pHW193-PA、pHW194-HA、pHW195-NP、pHW196-NA、pHW197-M、pHW198-NS均由本中心保存;流感病毒A/Puerto Rico/8/34(PR8)由本中心保存;SPF鸡胚购自北京梅里亚维通动物技术有限公司。
1.2 主要试剂及仪器 DMEM培养基购自美国GIBCO公司;胰酶购自美国GIBCO公司;质粒提取试剂盒和Effectene转染试剂盒购自美国QIAGEN公司;无支原体胎牛血清购自杭州四季青公司;1%鸡红细胞按常规方法自行制备;SolutionⅠ、限制性内切酶、EX Taq聚合酶、DNTP等购自日本TaKaRa公司;基因合成、引物合成及测序均由上海生工公司完成;酶联免疫分析仪购自美国Thermo公司;台式扫描电镜购自荷兰Phenom 公司产品;MTS试剂盒购自美国Promega公司;结晶紫染色试剂购自北京索莱宝公司。
1.3 重组pFlu△NS1质粒构建 根据生物信息学预测分析结合序列优化,将PR8流感病毒的NS基因片段部分缺失,设计的基因序列由上海生工生物工程股份有限公司合成。合成片段与pHW2000载体进行连接,阳性克隆测序验证。
1.4 重组溶瘤流感病毒rFlu△NS/HCC的拯救 依照Effectene转染试剂盒说明书,用MDCK和COS-Ⅰ细胞铺6孔板,细胞3×105个/孔,COS-Ⅰ和MDCK比例为2∶1,2 ml/孔,置37 ℃、5%CO2培养箱培养过夜,待细胞长至单层后即可转染。用重组质粒pFlu△NS1与PR8骨架的7质粒pHW191-PB2、pHW192-PB1、pHW193-PA、pHW194-HA、pHW195-NP、pHW196-NA和pHW197-M均等量混合,各质粒浓度均稀释为250 ng/µl,转染至MDCK和COS-Ⅰ细胞混合液中,72 h后接种鸡胚,测血凝效价。
1.5 重组溶瘤流感病毒rFlu△NS/HCC的鉴定
1.5.1 血凝试验 将转染的上清液于-70 ℃反复冻融1次,接种9 d龄SPF鸡胚,0.2 ml/枚,置37 ℃、5% CO2培养箱培养72 ~96 h后,4 ℃冻死鸡胚,收集尿囊液测定血凝效价。
1.5.2 TCID50检测 用MDCK、L02、SMMC-7721、HepG2细胞分别铺96孔板,每孔2×104个细胞。待细胞长至单层后,重组溶瘤流感病毒rFlu△NS/HCC用无血清DMEM培养基按照10-1、10-2、10-3……稀释,5 d后在显微镜下观察细胞状态,并用1%鸡红细胞检测细胞上清的血凝滴度。
1.5.3 RT-PCR基因鉴定 用TRIZOL法提取重组溶瘤流感病毒rFlu△NS/HCC RNA后,RT-PCR扩增pFlu△NS1、NP、M片段,酶切,胶回收,连接,转化,挑取单克隆菌落,菌液PCR,测序后序列比对分析,并做PR8流感病毒NS阳性对照。
1.5.4 电镜观察 将第三代重组溶瘤流感病毒rFlu△NS/HCC,300 KD膜包超滤浓缩,60%和30%蔗糖密度梯度离心,经脱糖后获得纯化病毒rFlu△NS/HCC。负染处理后,透射电镜观察重组溶瘤流感病毒rFlu△NS/HCC的形态与大小分布。
1.6 重组溶瘤流感病毒rFlu△NS/HCC对肝癌细胞体外抑制效果
1.6.1 MTS检测细胞活性 选用L02、SMMC-7721、HepG2细胞分别铺96孔板,计细胞数1.5×104个/孔,100 μl/孔,置37 ℃、5% CO2培养箱培养过夜,待细胞长至单层后将96孔板内的培养基弃去后,用PBS洗涤3次,加入感染复数(multiplicity of infection, MOI)依次为0.1、1.0、3.0、5.0、10.0的重组溶瘤流感病毒rFlu△NS/HCC并设立阴性对照,吸附1 h后弃液,换新鲜DMEM培养基。按上述感染条件感染48 h、72 h、96 h后,每孔加入预先配好的MTS试剂,30 min后,用酶联免疫检测仪在490 nm处检测OD值。
1.6.2 结晶紫染色检测细胞病变 铺24孔板,选用L02、SMMC-7721、HepG2细胞,7×104个/孔,500 μl/孔,置37 ℃,5% CO2培养箱培养过夜,待细胞长至单层后将24孔板内的培养基弃去,用PBS洗涤3次,加入MOI依次为0.1、1.0、3.0的重组溶瘤流感病毒rFlu△NS/HCC感染细胞并做阴性对照,按照上述条件吸附1 h后弃液,换新鲜DMEM培养基,72 h后加浓度为1%的结晶紫染色液,观察结果。
1.7 统计学处理 用GraphPad Prism 5.0进行数据处理和统计分析。不同MOI值的重组病毒组间肝癌细胞活力差异性比较用单因素方差分析,组间两两比较用SNK-q检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 重组质粒pFlu△NS1的构建 经文献调研、生物信息学分析、序列优化将流感病毒的NS片段部分缺失,构建策略(图1A),合成片段与pHW2000连接,成功构建重组质粒pFlu△NS1(命名为5、7、10、13、14、15),片段大小为478 bp(图1B),测序结果与预期序列相符一致,表明重组质粒构建成功(图1C)。
2.2 重组溶瘤流感病毒rFlu△NS/HCC的拯救 将测序正确的重组质粒pFlu△NS1和PR8流感病毒7质粒pHW191-PB2、pHW192-PB1、pHW193-PA、pHW194-HA、pHW195-NP、pHW196-NA和pHW197-M共转染MDCK和COS-I细胞,成功拯救的重组溶瘤流感病毒命名为rFlu△NS/HCC。重组溶瘤流感病毒rFlu△NS/HCC经鸡胚连续传5代,血凝效价达到29~10,分装置-70 ℃冰箱保存备用。

图1 重组pFlu△NS1质粒的构建及鉴定A.质粒pFlu△NS1构建图;B.质粒跑胶图,5、7、10、13、14、15是构建质粒pFlu△NS1,M是DNA marker ;C. 质粒pFlu△NS1测序图Figure 1 Construction and characterization of recombinant pFlu△NS1 plasmid
2.3 病毒TCID50检测 用MDCK、L02、SMMC-7721、HepG2细胞铺96孔板,每孔2×104个细胞,重组溶瘤流感病毒rFlu△NS/HCC 10-1、10-2、10-3……倍比稀释,5 d后观察细胞病变情况。结果显示,重组溶瘤流感病毒rFlu△NS/HCC在MDCK、L02细胞的感染滴度≤1.0,而在SMMC-7721、HepG2细胞上感染滴度log10TCID50/ml为6.5。
2.4 RT-PCR基因鉴定 经RT-PCR扩增重组溶瘤病毒rFlu△NS/HCC的pFlu△NS1、NP、M片段,并做阳性对照pHW198-NS。扩增的3个片段大小分别是478 bp、1595 bp、1056 bp,阳性对照质粒pHW198- NS PCR扩增片段大小为919 bp(图2)。结果表明,重组溶瘤病毒rFlu△NS/HCC基因片段与预期大小一致,表明重组病毒拯救成功。
2.5 电镜观察重组病毒形态 如图3所示,经负染透射电镜观察可见重组溶瘤流感病毒rFlu△NS/ HCC的病毒颗粒多数为球型,可见包膜、基质蛋白、核心,颗粒直径大小约80~120 nm,表明重组溶瘤流感病毒rFlu△NS/HCC的病毒形态分布和颗粒大小符合流感病毒的典型特征,约80%病毒分布在80~120 nm之间。
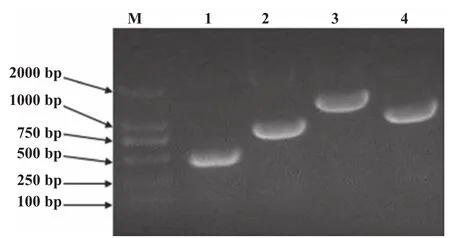
图2 RT-PCR基因鉴定重组病毒rFlu△NS/HCC基因片段M. DNA marker;1. PCR pFlu△NS1片段;2. PCR pHW198-NS片段;3. PCR NP片段;4. PCR M片段Figure 2 Gene segments of rFlu△NS/HCC amplified by RT-PCR
2.6 MTS检测细胞活力 用MOI依次为0.1、1.0、3.0、5.0、10.0的重组溶瘤流感病毒rFlu△NS/ HCC分别感染肝癌细胞 SMMC-7721和HepG2,如图4所示,在病毒感染SMMC-7721细胞后48 h,MOI为 0.1和1.0的病毒对细胞活力无明显影响,而MOI 为3.0、5.0、10.0的病毒使细胞活力分别减少至50%、30%、12%(F=1.247,P=0.001;MOI 0.1组与MOI 1.0组比较,P>0.05,MOI 3.0、5.0、10.0 3组间两两比较,P均<0.05);在病毒感染后72 h(F =1.468,P=0.001)和96 h(F=2.577,P=0.001),显示了同样变化趋势。同样,在病毒感染HepG2细胞后48 h,MOI为0.1的病毒对细胞活力无明显影响,而MOI为1.0、3.0、5.0、10.0的病毒使细胞活力分别减少至25%,20%,15%,10%(F=143.8,P=0.000;组间两两比较,P均<0.05);在病毒感染后72 h(F=135.1, P=0.000)和96 h(F=107.5,P=0.000),显示了同样变化趋势。各感染剂量重组病毒、不同时间点均对正常肝细胞L02无明显杀伤作用。结果表明,重组溶瘤流感病毒rFlu△NS/HCC可选择性杀伤肝癌细胞,随着时间的延迟,肝癌细胞病变更加明显。
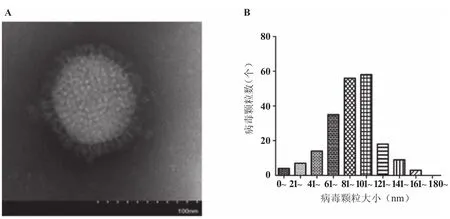
图3 电镜观察重组病毒rFlu△NS/HCC的病毒样颗粒及病毒大小分布A. 电镜观察重组病毒rFlu△NS/HCC形态;B. 病毒颗粒大小分布Figure 3 Virus-like particle size and distribution of recombinant virus of rFlu△NS/HCC by electron microscope
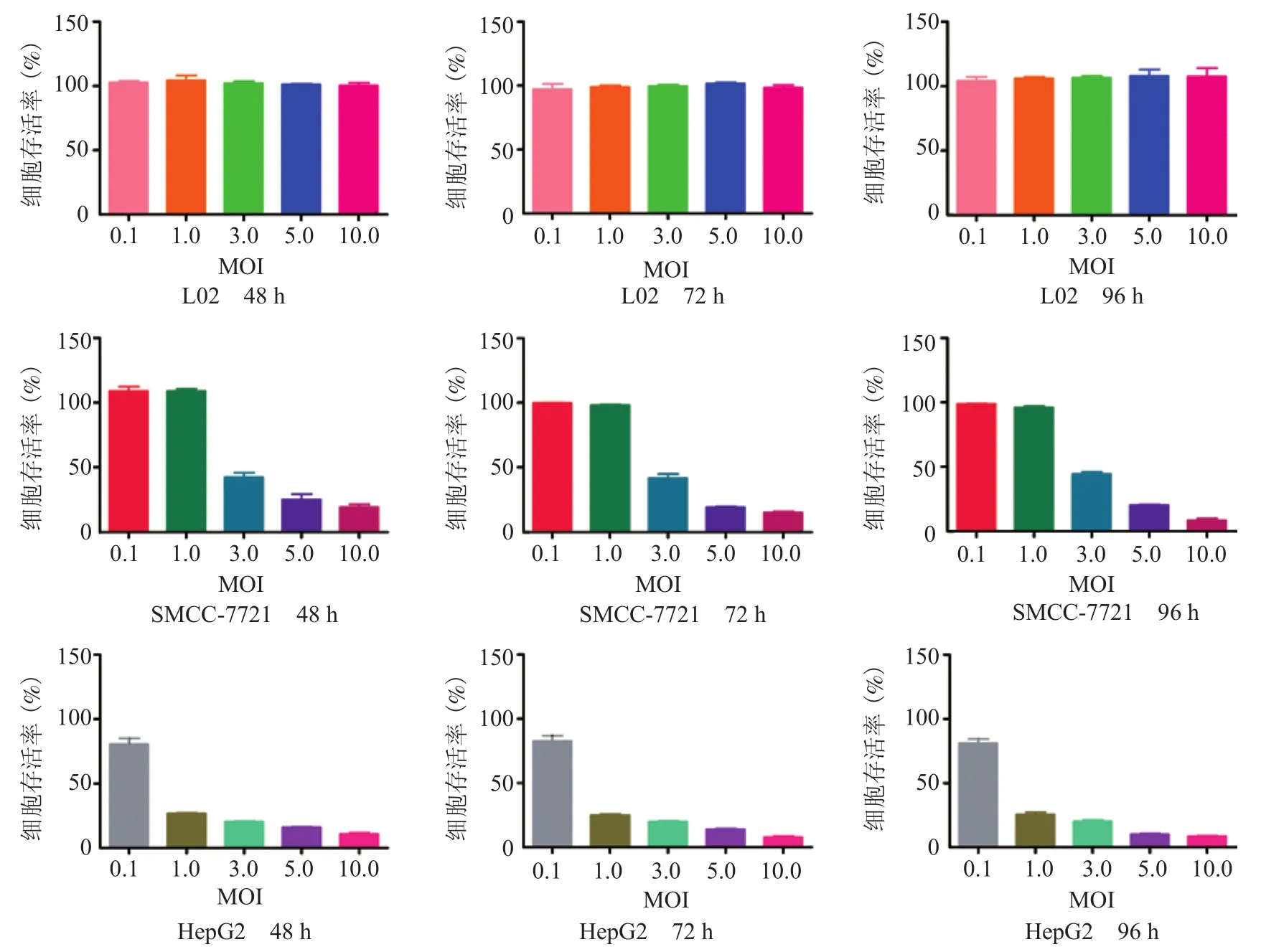
图4 重组溶瘤流感病毒在不同细胞上MTS检测结果Figure 4 Cytopathic assay of recombinant virus of rFlu△NS/HCC on different cells
2.7 细胞病变检测 如图5所示,在感染剂量为3.0 MOI时,SMMC-7721细胞病变超过90%;在感染剂量为0.1、1.0、3.0 MOI时,HepG2细胞病变均超过70%,表明rFlu△NS/HCC对SMMC-7721、HepG2细胞有明显的抑制作用;而各感染剂量在病毒感染后48 h对正常肝细胞L02无明显杀伤作用,该结果与MTS结果相一致。进一步证实了,重组溶瘤流感病毒rFlu△NS/HCC对肝癌细胞有选择性杀伤作用,而对正常细胞无明显影响。
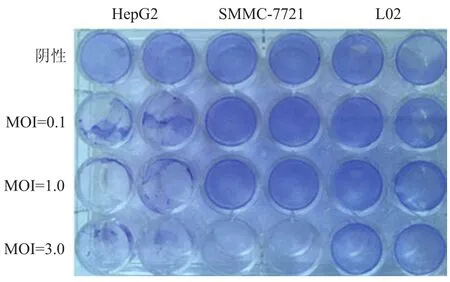
图5 不同细胞上结晶紫染色检测结果Figure 5 Crystal violet of recombinant virus of rFlu△NS/HCC on different cells
3 讨 论
肝癌是我国高发的、危害性极大的恶性肿瘤,严重威胁人类健康,其发病率和死亡率持续上升[10]。目前的常规治疗手段主要包括手术切除、肝移植、局部消融治疗、经肝动脉化学栓塞、放疗、分子靶向治疗、综合治疗等,但治疗效果往往不尽人意[11-12]。因此,寻找对肿瘤组织能选择性杀伤、不良反应低的肝癌治疗新策略,将为肝癌的靶向性治疗提供里程碑式的新思路[13-14]。2015年,美国FDA首次批准以单纯疱疹病毒为载体的溶瘤病毒T-VEC用于黑色素瘤治疗[15-16]。 而以流感病毒为载体的溶瘤病毒对肝癌细胞的选择性杀伤作用未见报道,因此,本研究基于前期成熟的RG技术,创新性开展重组溶瘤流感病毒研究,并评价该病毒对肝癌细胞的选择性杀伤效果。
我们首先对流感病毒A/Puerto Rico/8/34(PR8)的非结构蛋白(NS)进行基因改造,通过RG技术以流感病毒为载体,采用“7+1”转染模式共转染MDCK和COS-Ⅰ细胞,成功拯救出重组溶瘤流感病毒rFlu△NS/HCC。经血凝试验、RT-PCR、TCID50、电镜等方法证实拯救的重组溶瘤流感病毒为rFlu△NS/HCC,血凝效价达到29~10,能够在鸡胚上稳定传代,RT-PCR测序结果与预期序列完全一致。经超滤浓缩、密度梯度离心纯化后,电镜观察重组病毒颗粒形态结构及大小分布,rFlu△NS/HCC符合流感病毒典型特征,并测得滴度达6.5 log10TCID50/ml。经MTS检测细胞活性、细胞病变检测等,对溶瘤流感病毒感染肝癌细胞SMMC-7721、 HepG2、正常肝细胞 L02 的杀伤效果进行评价。结果表明,溶瘤流感病毒可选择性杀伤肝癌细胞,而对正常肝细胞无明显影响。
近年来,溶瘤病毒包括新城疫病毒、单纯疱疹病毒及腺病毒等一系列可用于肿瘤治疗的临床研究如火如荼,有一定的临床治疗效果,但是溶瘤病毒用于肿瘤治疗面临巨大挑战。流感病毒RG技术迅猛发展,为肿瘤治疗提供了新的病毒载体[17-18]。然而,人们对流感病毒的生物学特性并未完全认识,比如经基因改造后的病毒是否回复突变以及是否致癌尚未得到验证。此外,机体对流感病毒存在预存免疫现象,体内存在的抗体会中和病毒,易导致治疗效果不理想。本研究采用RG技术重组的溶瘤流感病毒rFlu△NS/HCC能够选择性杀伤肝癌细胞,而对正常肝组织未造成明显影响。后续研究中我们将深入研究重组溶瘤流感病毒在荷瘤裸鼠体内的抑瘤效果和分子机制。
综上所述,本研究通过RG技术成功拯救获得流感病毒为载体的重组溶瘤流感病毒rFlu△NS/ HCC,该重组病毒在体外能够选择性杀伤肝癌细胞系,而对正常肝细胞无明显杀伤效果,这为肝癌靶向治疗基因工程药物研发奠定基础。最终重组溶瘤流感病毒的单一或联合化疗药物应用方案将有望用于肝癌临床治疗,并为其他肿瘤治疗提供新思路。
[1] Schlachterman A, Craft WW Jr, Hilgenfeldt E, et al. Current and future treatments for hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(28):8478-8491.
[2] Hajarizadeh B, Grebely J, Dore GJ. Epidemiology and natural history of HCV infection[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(9):553-562.
[3] Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cells in the tumor microenvironment[J]. Nat Immunol, 2013, 14(10):1014–1022.
[4] Kanerva, A. Nokisalmi P, Diaconu I, et al. Antiviral and antitumor Tcell immunity in patients treated with GMCSF-coding oncolytic adenovirus[J]. Clin Cancer Res, 2013, 19(10):2734-2744.
[5] Zamarin D, Holmqaard RB, Subudhi SK, et al. Localized oncolytic virotherapy overcomes systemic tumor resistance to immune checkpoint blockade immunotherapy[J]. Sci Transl Med, 2014, 6(226):226ra32.
[6] Almadge JE, Gabrilovich DI. History of myeloid-derived suppressor cells[J]. Nat Rev Cancer, 2013, 13(10):739-752.
[7] Uchida H, Malzulli M, Nakano K, et al. Effective treatment of an orthotopic xenograft model of human glioblastoma using an EGFR-retargeted oncolytic herpes simplex virus[J]. Mol Ther, 2013, 21(3):561-569.
[8] Bian C, Liu S, Liu N, et al. Influenza virus vaccine expressing fusion and attachment protein epitopes of respiratory syncytial virus induces protective antibodies in BALB/c mice[J]. Antiviral Res,2014, 104:110-117.
[9] Yang P, Li T, Liu N, et al. Recombinant influenza virus carrying human adenovirus epitopes elicits protective immunity in mice[J]. Antiviral Res, 2015, 121:145-151.
[10] Wang P, Song W, Li H, et al. Association between donor and recipient smoothened gene polymorphisms and the risk of hepatocellular carcinoma recurrence following orthotopic liver transplantation in a Han Chinese population[J]. Tumour Biol, 2015, 36(10):7807-7815.
[11] Ling CQ, Wang LN, Wang Y, et al. The roles of traditional Chinese medicine in gene therapy[J]. J Integr Med, 2014, 12(2):67-75.
[12] Gentschev I, Muller M, Adelfinger M, et al. Efficient colonization and therapy of human hepatocellular carcinoma (HCC) using the oncolytic vaccinia virus strain GLV-1h68[J]. PLoS One, 2011, 6(7): e22069.
[13] Alvarez-Breckenridge CA. Yu J, Price R, et al. NK cells impede glioblastoma virotherapy through NKp30 and NKp46 natural cytotoxicity receptors[J]. Nat Med, 2012.18(2):1827-1834.
[14] Ruffell B, Affara NI, Coussens LM. Differential macrophage programming in the tumor microenvironment [J]. Trends Immunol, 2012, 33(3):119-126.
[15] Coffin R. Interview with Robert Coffin, inventor of T-VEC: the first oncolytic immunotherapy approved for the treatment of cancer[J]. Immunotherapy, 2016, 8(2):103-106.
[16] Zhang SX. Turning killer into cure-the story of oncolytic herpes simplex viruses[J]. Discov Med, 2015, 20(111):303-309.
[17] Fournier P, Bian H, Szeberenyi J, et al. Analysis of three properties of newcastle disease virus for fighting cancer: tumor-selective replication, antitumor cytotoxicity, and immunostimulation[J]. Methods Mol Biol, 2012, 797:177-204.
[18] Eager RM, Nemunaitis J. Clinical development directions in oncolytic viral therapy[J]. Cancer Gene Ther, 2011, 18(5):305-317.
(2017-01-02收稿 2017-02-10修回)
(本文编辑 张云辉)
Experiment of recombinant oncolytic influenza virus targecting effects on liver carcinoma cells
SUN Fang, REN Tian-yu, YAN Jin, DUAN Yue-qiang, WANG Xi-liang, ZHANG Shao-geng, YANG Peng-hui*
First Center of Hepatobiliary Surgery, 302 Military Hospital of China, Beijing 100039, China
ObjectiveTo investigate the characterization and selective anti-tumor effects of the recombinant oncolytic virus rFlu△NS/HCC on liver carcinoma cells.MethodsBy using reverse genetics (RG), a recombinant oncolytic influenza virus rFlu△NS/HCC was rescued and identified in the backbone of A/Puerto Rico/8/34 (PR8). rFlu△NS1 based on partial deletion of NS(deNS1)was constructed, which was cotransfected with the influenza virus remaining seven plasmids of PB2, PB1, PA, HA, NP, NA and M into MDCK and COS-Ⅰcells. Recombinant rFlu△NS/HCC virus were amplified by SPF chicken embryos, purified by sucrose gradient, then morphological characteristics of virus were detected with electron microscope, hemagglutination titers and viral titers. MTS and cytopathic assay were used to investigate the oncolytic targeting effects of the recombinant rFlu△NS/HCC virus on liver carcinoma cells and normal liver cells.ResultsThe hemagglutination titers of recombinant rFlu△NS/HCC virus was 29-10and the log10TCID 50/ml was 6.5 of rFlu/RSV/F virus in HepG2 cells. The results were measured by MTS assay and cytopathic assay. The recombinant rFlu△NS/HCC virus could induce selective cytotoxicity in liver carcinoma cells HepG2 at MOI of 1(P<0.01), and SMMC-7721 at MOI of 3 (P<0.001), without effect in the normal liver cell line (L02). In summary, the recombinant rFlu△NS/HCC virus with differment MOI didn´t effect the normal liver cell line (L02).ConclusionsThe recombinant oncolytic rFlu△NS/HCC virus can induce selective cytotoxicity in liver carcinoma cells and provide a new theoretical strategy for the clinical therapy of cancer.
influenza virus; oncolytic virus; liver carcinoma cells
R575.2
A
1007-8134(2017)02-0086-06
10.3969/j.issn.1007-8134.2017.02.005
国家“863”计划青年科学家专题(SS2015AA020924)
100039 北京,解放军第三〇二医院肝胆外科一中心(孙芳、任天宇、严锦、张绍庚、杨鹏辉);100071 北京,军事医学科学院微生物流行病研究所(段跃强、王希良、杨鹏辉)
杨鹏辉,E-mail: ypenghuiamms@hotmail.com
*Corresponding author, E-mail: ypenghuiamms@hotmail.com
