低温胁迫对黄姑鱼(Nibea albiflora)抗氧化酶、Na+/-K+-ATP酶及Hsp70蛋白含量的影响
2017-05-13罗胜玉徐冬冬楼宝陈睿毅詹炜毛国民
罗胜玉,徐冬冬,楼宝,陈睿毅,詹炜,毛国民
(1.浙江海洋大学,浙江舟山316004;2.浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山316100)
低温胁迫对黄姑鱼(Nibea albiflora)抗氧化酶、Na+/-K+-ATP酶及Hsp70蛋白含量的影响
罗胜玉1,2,徐冬冬2,楼宝2,陈睿毅2,詹炜2,毛国民2
(1.浙江海洋大学,浙江舟山316004;2.浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山316100)
为探讨低温处理对黄姑鱼幼鱼生理机能的影响,以18℃为对照组,设置8℃、10℃和14℃3个低温胁迫组,测定不同温度急性胁迫对黄姑鱼幼鱼(Nibea albiflora)超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、Na+/-K+-ATP酶活力以及热休克蛋白70(Hsp70)蛋白含量的影响。研究结果表明,低温胁迫组(8℃、10℃和14℃)的SOD和CAT酶活力随着胁迫温度的降低及其胁迫时间的延长呈先升高后降低的趋势,在72 h时恢复到对照组水平。肌肉中的Na+/-K+-ATP酶活力则随处理时间的延长呈现先降低后升高的趋势,10℃和14℃组能够在72 h时恢复到对照组水平,而8℃组则在72 h仍显著低于对照组。低温胁迫下黄姑鱼肌肉的Hsp70含量随着处理时间的延长呈先升高后降低趋势,10℃和14℃组能够在72 h时恢复到对照组水平,而8℃组则在72 h仍显著高于对照组。由此说明,SOD、CAT、Na+/-K+-ATP以及Hsp70蛋白参与了黄姑鱼低温胁迫应答过程,可以作为其低温胁迫应答的标志物。
微低温胁迫;黄姑鱼;SOD酶;CAT酶;Na+/-K+-ATP酶;Hsp70
黄姑鱼(Nibea albiflora)是我国重要的海水经济鱼类,具有生长快、抗逆性强、繁殖力强等特点,是开展近海网箱和池塘养殖的适宜品种(雷霁霖等,1992)。随着黄姑鱼繁育技术日趋成熟,其养殖规模在浙江、福建沿海迅速扩大,成为我国东南沿海重要的养殖鱼种。但是,近年来由于全球环境破坏导致气候异常变化,我国沿海地区冬季常遭寒潮侵袭,致使养殖的黄姑鱼大量冻死,尤以浙江沿海地区为甚,导致巨大的经济损失,严重制约了养殖产业的发展。因此,提高养殖黄姑鱼的耐低温能力,培育耐寒品种具有重要意义。
鱼类作为变温动物,其生理状况与温度变化密切相关,对低温的适应过程也是一系列细胞应答、逐级调控全身系统参与抵御的复杂生理过程(Donaldson et al,2008)。低温胁迫是研究鱼类耐寒机理的重要手段,从生理、生化等角度寻找与响应低温适应的标志物是研究鱼类低温响应过程并解析其低温适应机制的可行途径。一般而言,与免疫、代谢等相关的酶在鱼类低温胁迫应答中起到十分重要的作用,受到研究者的关注,其中,抗氧化酶、热休克蛋白、三磷酸腺苷酶等常常作为检测鱼类低温胁迫应答的标志物。Heise等(2006)研究了北海绵鳚(Zoarces viviparous)低温胁迫后抗氧化酶活力变化;Mladineo等(2009)研究了金枪鱼在低温和高温胁迫下的Hsp70和Na+/K+-ATPase在高温和低温适应的表达模式;刘波等(2011)研究了低温应激对肝脏Hsp70基因表达及吉富罗非鱼血清生化指标的影响。
目前,关于黄姑鱼的研究主要集中在苗种繁育、养殖技术、生态毒理、病害和雌核发育等方面(雷霁霖等,1992;徐冬冬等,2013;杨育凯等,2013),而关于黄姑鱼低温适应方面的研究较少涉及。本文通过研究低温胁迫下黄姑鱼幼鱼超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶以及Hsp70和Na+/K+-ATPase的变化,探讨低温处理对黄姑鱼幼鱼生理机能的影响,以期为研究黄姑鱼对环境温度的适应机制和健康养殖提供必要的理论依据和数据支持,并为黄姑鱼耐寒品种的选育奠定基础。
1 材料与方法
1.1实验材料
实验用黄姑鱼由浙江省海洋水产研究所西轩渔业科技岛人工培育,体长为(18.25±2.10)cm,体重为(120.15±2.36)g。实验开始前于(18.0± 1.0)℃海水暂养2周。所用海水经过沙滤,盐度28,pH 8.2~8.6,溶氧≥6 mg/L,连续充气,每日换水1次,换水量50%。
1.2实验方法
预实验发现黄姑鱼由18℃移至6℃后短时间内出现死亡,而移至8℃后未发现死亡℃,因此设置18℃、14℃、10℃、8℃4个温度组,每组设置2个平行。每个平行组即1个桶(500 L)放置30尾鱼,当水温降至设定温度后迅速将鱼放入实验桶内,水温由海水制冷机循环系统调控,温度误差控制±0.2℃。
在0 h、2 h、6 h、12 h、24 h、48 h、72 h分别取样,每个处理组随机取3尾,解剖取其鳃丝、肌肉和肝脏,用生理盐水洗净,保存于RNA保护液中备用。蛋白含量以牛血清蛋白为标准,采用考马斯亮兰法测定。所有酶活力及Hsp70含量均采用南京建成生物公司的试剂盒测定,操作步骤参照说明书。SOD酶活力单位定义为每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。CAT活力单位定义:每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为一个活力单位(U)。Na+/-K+-ATP酶活力的单位定义:规定每小时每毫克组织蛋白的组织中ATP酶分解ATP产生1 μmol无机磷的量为一个ATP酶活力单位(U),即微摩尔磷/毫克蛋白/小时(μmolPi/mgprot/h)。Hsp70含量单位为ng/mgprot。
1.3实验数据处
所得数据均以平均值±标准差的形式表示,各组数据经统计软件SPSS 22.1中的方差分析(ANOVA)和Duncan氏检验法进行显著性分析,显著水平设置为P=0.05。采用EXCEL 2007软件作图。
2 结果
2.1不同温度处理的黄姑鱼组织的SOD酶活力比较
胁迫温度和胁迫持续时间显著影响肝脏、鳃和肌肉组织中的SOD酶活力(Two-way ANOVA,P<0.01)(如图1)。8℃处理组中肝脏组织的SOD酶活力在2 h时急剧升高,之后随胁迫时间延长逐渐下降,在72 h时与对照组无显著性差异(P> 0.05);鳃和肌肉中的SOD酶活力则在6 h时达到最高,随后逐渐降低,在72 h恢复到对照组水平。10℃处理组中,肝脏和肌肉SOD酶活力在6 h最高,鳃中SOD酶活力则在12 h最高,随后逐渐降低至对照组水平。14℃处理组中,肝脏SOD酶活力在6 h最高,而鳃和肌肉SOD酶活力则在12 h最高。3种组织中SOD酶活力均呈先升高后下降的趋势,在72 h与正常对照组无显著性差异(ANOVA,P>0.05)。
2.2不同温度处理的黄姑鱼组织中CAT酶活力比较
不同低温胁迫处理组黄姑鱼幼鱼组织中CAT酶活力的比较(如图2)。胁迫温度和胁迫持续时间显著影响3种组织中的CAT酶活力(Two-way ANOVA,P<0.05)。3种组织的CAT酶活力随胁迫时间延长呈先升高后下降的趋势,在72 h恢复至正常对照组水平。8℃、10℃和14℃处理组的肝脏和肌肉组织的CAT活力在胁迫6 h后达到最高,其后逐渐下降,在72 h时与正常对照组无显著性差异。在鳃组织中,8℃和10℃处理组的CAT酶活力在胁迫2 h后达最高,其后下降至对照组水平。
2.3不同温度处理黄姑鱼的肌肉中Na+/-K+-ATP酶活力比较
不同低温处理组的黄姑鱼幼鱼肌肉中Na+/-K+-ATP酶活力比较(如图3)。8℃组的肌肉组织中Na+/-K+-ATP酶活力随时间呈先下降后上升的趋势,Na+/-K+-ATP酶活力在胁迫12 h达到最低,其后酶活力有所升高,但在72 h仍显著低于对照组(P<0.05)。10℃和14℃组的Na+/-K+-ATP酶活力随胁迫时间延长呈现先降低后上升的趋势,10℃和14℃分别在胁迫后12 h和6 h最低,在72 h时与对照组的Na+/-K+-ATP酶活力无显著性差异(P> 0.05)。

图1 低温胁迫下黄姑鱼肝脏、鳃和肌肉等组织SOD酶活力
2.4不同温度处理的黄姑鱼肌肉中Hsp70含量比较
胁迫温度和胁迫时间显著影响黄姑鱼肌肉中的Hsp70含量(Two-way ANOVA,P<0.05)。8℃组肌肉中Hsp70含量在6 h内急剧升高,其后随胁迫时间延长而降低,在72 h时仍显著高于对照组(P>0.05)。10℃组和14℃组随着胁迫时间的延长呈现先升高后降低的趋势,10℃组Hsp70含量在6 h时最高,14℃组在Hsp70含量在12 h时最高,在72 h时,两组的Hsp70含量与对照组无显著性差异(P>0.05)。
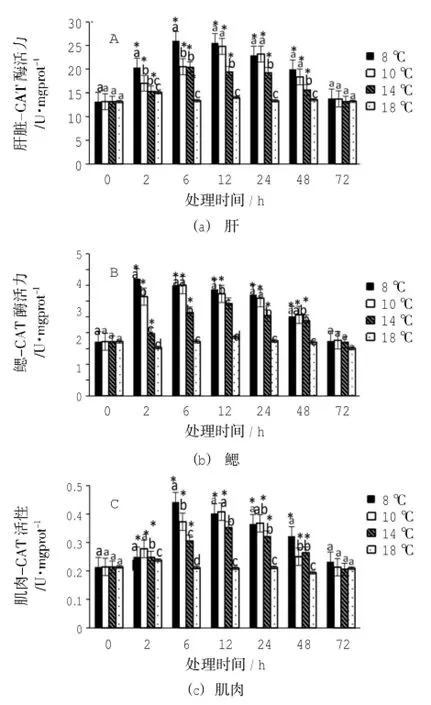
图2 低温胁迫下黄姑鱼肝脏、鳃和肌肉等组织CAT酶活力
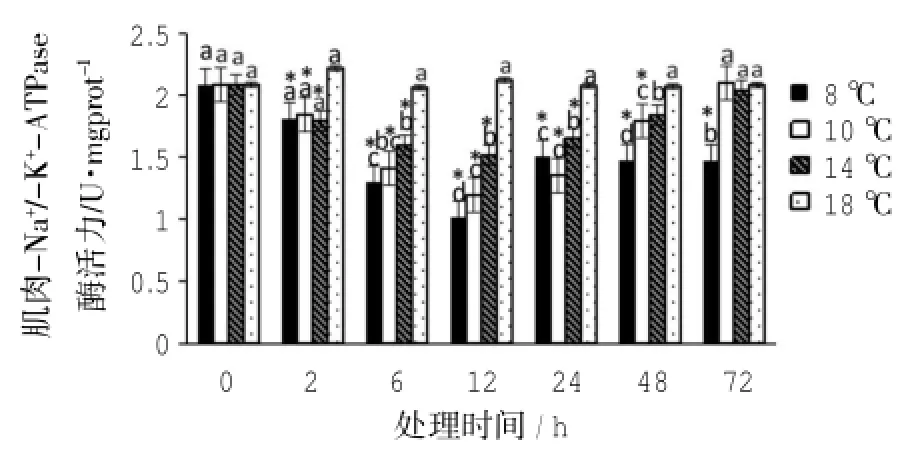
图3 低温胁迫下黄姑鱼肌肉Na+/-K+-ATP酶活力
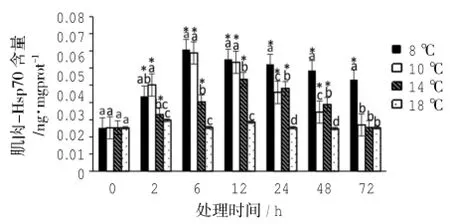
图4 低温胁迫下黄姑鱼肌肉Hsp70含量
3 讨论
3.1低温胁迫对黄姑鱼抗氧化酶活性的影响
低温胁迫可造成自由基在体内快速大量积累,导致正常细胞和组织的损坏,引发膜脂质过氧化反应,从而引起疾病(Adams et al,1985;Pascual et al,2003;Morales et al,2004;Martínez-Álvarez et al,2005;谢妙,2012)。超氧化物歧化化酶(SOD)和过氧化氢酶(CAT)是自由基清除体系中的两种关键酶类,其动态变化可以准确地反映机体内自由基的代谢及组织的氧化损伤情况,对判断机体的健康状况及免疫防御能力具有重要的参考价值(严建伟,1998;洪美玲等,2007;谢妙,2012)。本研究中,低温胁迫对黄姑鱼肝脏、鳃和肌肉组织的SOD和CAT氧化酶活力具有显著影响,在胁迫初期两种氧化酶活力显著升高,表明黄姑鱼在受到温度胁迫后,其体内的抗氧化还原酶活力会产生相应的响应变化,其他研究中也表明了这点。如卵形鲳鲹(Trachinotusovatus)受到低温胁迫后,其体内的SOD和CAT等抗氧化还原酶活性在24 h内显著升高(刘汝建等,2013);对北海绵鳚(Zoarcesviviparous)进行急性冷刺激也发现其肝脏SOD活性显著增加(Heise et al,2006)。SOD、CAT等酶活力的升高的原因可能是低温引起体内活性氧自由基(ROS)急剧升高有关,由此诱导机体内抗氧化酶活力逐渐升高以清除体内多余ROS。随着低温胁迫时间的延长,各温度组的SOD和CAT酶活力恢复到对照组水平,表明随着胁迫时间的延长,黄姑鱼幼鱼体内的抗氧化酶能够消除体内自由基的累积,建立新的适应机制,从而SOD和CAT酶活力恢复到到正常水平(Martínez-Álvarez et al,2005)。就肝脏、鳃和肾脏三种组织而言,SOD和CAT酶活力受低温影响的程度在不同组织存在差异,但低温胁迫后SOD和CAT酶活力均呈现出先升高后降低的趋势。
3.2低温胁迫对黄姑鱼肌肉中Na+/-K+-ATPase活力的影响
Na+/-K+-ATPase属于膜束缚酶,低温能够引起细胞膜结构的变化从而引起膜的半透性和膜束缚酶的活性等一系列生理过程的改变(徐德立,2002)。Na+/-K+-ATPase酶(又称Na-K泵)是细胞膜固有的一种蛋白脂质复合体,其主要生理功能是维持生物体正常的生理代谢和能量代谢。许多研究表明,低温能够改变Na+/-K+-ATPase酶活力(Haque et al,2011;Galarza-Muñoz et al,2011;Kang et al,2015),因此,Na+/-K+-ATPase酶常作为评价环境压力的指标。本研究中,低温胁迫组的Na+/-K+-ATPase酶活力显著低于对照组,表明低温能够显著影响黄姑鱼Na+/-K+-ATPase酶活力,这与其他水产动物如克氏原螯虾、吉富罗非鱼等的研究结果一致(郭春雨等,2007;王海贞等,2012)。在低温胁迫的12h内,黄姑鱼肌肉的Na+/-K+-ATPase酶活力显著降低,此后随胁迫时间的延长各低温胁迫组的酶活力逐渐升高,10℃和14℃组在72 h达到对照组水平。黄姑鱼体内Na+/-K+-ATPase的酶活力变化与抗氧化酶活力变化呈现不同趋势。Na+/-K+-ATPase酶活力变化一方面可能是由于在低温胁迫的最初阶段,黄姑鱼受到冷刺激后生物膜流动性降低,引起膜束缚酶活性降低,从而导致Na+/-K+-ATPase酶活力降低,另一方面可能是由于低温刺激本身也可使ATPase构象发生改变,进而使其活力下降;其后,随着胁迫时间延长,鱼体逐渐适应周围环境,调节体内的适应机制达到新的平衡,故Na+/-K+-ATPase酶活性升高(Kang et al,2015)。然而,8℃组Na+/-K+-ATPase酶活力在急剧升高后有所降低,但在胁迫过程中显著高于18℃组,该组黄姑鱼表现出游动减少、行动缓慢,推测可能是过低的温度破坏了细胞膜流动性,无法在鱼体内建立新的平衡,导致Na+/-K+-ATPase酶活力降低。
3.3低温胁迫对黄姑鱼Hsp70的影响
热休克蛋白Hsp70在机体内作为一种分子伴侣而对机体起到保护作用,可调节细胞的生理功能,提高细胞对应激反应的耐受性(谢妙,2012),因此,Hsp70常作为机体受到应激刺激时反映其细胞功能状态和抗应激能力的指标之一。Hsp70根据其表达情况可以分为组成型和诱导型,前者存在于非应激状态的正常细胞中,在正常情况下即表达,应激后不变或稍有增加;后者在正常细胞中,表达水平较低甚至无法检测到,而在应激后则明显升高(王美垚,2009)。本研究测定了黄姑鱼细胞内总的Hsp70蛋白表达量,Hsp70蛋白含量随胁迫温度和胁迫时间表现显著差异,表明低温诱导了黄姑鱼Hsp70蛋白的表达。在实验中,黄姑鱼受到低温胁迫后肌肉中Hsp70含量在6 h内迅速升高,其他鱼类如金枪鱼、罗非鱼、大西洋鲑(Salmo salar)等在受到冷刺激后其体内Hsp70蛋白表达量有所升高(Takle et al,2005;Mladineo et al,2009;王美垚,2009),这可能与鱼体受到刺激后产生诱导Hsp70蛋白合成以提高机体耐受性有关,是鱼体对外界环境进行自主适应的生理表现。随着胁迫时间的延长,14℃组和10℃组能够降至18℃组水平,表明在鱼体内受到低温刺激后建立新的平衡;但是8℃组却没能恢复到18℃组水平,这可能是由于黄姑鱼无法建立适应低温环境的生理平衡,无法应对过冷的刺激。热休克蛋白合成的调节包括转录水平和翻译水平的调节。本研究仅从蛋白水平研究Hsp70低温应答的表达模式,对其低温胁迫后的基因表达模式及其调节机制还需要进一步的研究。
综上,低温胁迫下黄姑鱼体内SOD、CAT、Na+/-K+-ATPase的酶活力以及Hsp70含量呈现规律性的变化趋势,表明上述几种酶参与了黄姑鱼低温胁迫应答过程,可以作为检测其应答低温胁迫的标志物。随着低温胁迫时间的延长,黄姑鱼体内能够建立适应低温的生理平衡,其体内的抗氧化酶以及Na+/-K+-ATPase的酶活力和Hsp70含量能够恢复;但在极端温度下如8℃,由于低温造成的损伤严重,Na+/-K+-ATPase的酶活力和Hsp70含量无法恢复导致其正常的生理活动无法维持。
致谢:浙江海洋学院孙连莲、平洪领以及浙江省海洋水产研究所试验场徐麒祥、马涛等多人参与实验与取样工作,在此一并致谢。
Adams S M,Mclean R B,1985.Estimation of largemouth bass, Micropterus salmoides Lacépède,growth using the liver somatic index and physiological variables.Journal of Fish Biology,26(2): 111-126.
Donaldson M R,Cooke S J,Patterson D A,et al,2008.Cold shock and fish.Journal of Fish Biology,73(7):1491-1530.
Galarza-Muñoz G,Soto-Morales S I,Holmgren M,et al,2011. Physiological adaptation of an Antarctic Na+/K+-ATPase to the cold.The Journal of experimental biology,214(13):2164-2174.
Haque M S,Roy S K,Shahjahan M,2011.Arsenic impairs the effect of low temperature on the regulation of Na+-K+-ATPase activity in skeletal muscle of fish(Channa punctata).Turkish Journal of Fisheries and Aquatic Sciences,11(3):339-344.
Heise K,Puntarulo S,Nikinmaa M,et al,2006.Oxidative stress and HIF-1 DNA binding during stressful cold exposure and recovery in the North Sea eelpout(Zoarces viviparus).Comparative Biochemistry& Physiology Part A:Molecular&Integrative Physiology,143(4): 494-503.
Kang C K,Chen Y C,Chang C H,et al,2015.Seawater-acclimation abates cold effects on Na+K+-ATPase activity in gills of the juvenile milkfish,Chanos chanos.Aquaculture,446:67-73.
Martínez-Álvarez R M,Morales A E,Sanz A,2005.Antioxidant Defenses in Fish:Biotic and Abiotic Factors.Reviews in Fish Biology& Fisheries,15(1-2):75-88.
Mladineo I,Block B A,2009.Expression of Hsp70,Na+/K+ATP-ase, HIF-1α,IL-1β and TNF-α in captive Pacific bluefintuna (Thunnus orientalis)after chronic warm and cold exposure.Journal of Experimental Marine Biology&Ecology,374(1):51-57.
Morales A E,Pérez-Jiménez A,Hidalgo M C,et al,2004.Oxidative stress and antioxidant defenses af8er prolonged starvation in Dentex dentex liver.ComparativeBiochemistry&PhysiologyToxicology& Pharmacology,139(1-3):153-161.
Pascual P,Pedrajas J R,Toribio F,et al,2003.Effect of food deprivation on oxidative stress biomarkers in fish(Sparus aurata).Chemicobiological interactions,145(2):191-199.
Takle H,Baeverfjord G,Lunde M,et al,2005.The effect of heat and cold exposure on Hsp70 expression and development of deformities during embryogenesis of Atlantic salmon(Salmo salar).Aquaculture, 249(1):515-524.
郭春雨,管越强,刘波兰,2007.温度、pH和盐度对克氏原螯虾鳃Na+-K+-ATPase活性的影响.动物学杂志,42(6):96-102.
洪美玲,陈立侨,顾顺樟,等,2007.不同温度胁迫方式对中华绒螯蟹免疫化学指标的影响.应用与环境生物学报,13(6):818-822.
雷霁霖,陈超,徐延康,等,1992.黄姑鱼工厂化育苗技术研究.海洋科学,11(6):5-10.
刘波,王美垚,谢骏,等,2011.低温应激对吉富罗非鱼血清生化指标及肝脏Hsp70基因表达的影响.生态学报,31(17): 4866-4873.
刘汝建,区又君,李加儿,等,2013.盐度、温度对卵形鲳鲹选育群体肝抗氧化酶活力的影响.动物学杂志,48(3):428-436.
王海贞,王辉,强俊,等,2012.温度和盐度对吉富品系尼罗罗非鱼幼鱼鳃Na+-K+-ATPase活力的联合效应.生态学报,32(3):898-906.
王美垚,2009.急性低温胁迫及恢复对吉富罗非鱼血清生化、免疫以及应激蛋白Hsp70基因表达的影响.南京农业大学.
谢妙,2012.低温胁迫对斜带石斑鱼生理、生化、脂肪酸的影响.广东海洋大学.
徐德立,2002.低温胁迫对草鱼ZC-7901细胞系和淡水白鲳CBS细胞系某些细胞功能影响的研究.浙江大学.
徐冬冬,楼宝,薛宝贵,等,2013.黄姑鱼(Nibea albiflora)雌核发育的人工诱导及鉴定.海洋与湖沼,44(2):310-317.
严建伟,阮积惠,1998.生物体系中自由基检测方法评述.浙江大学学报:理学版,25(3):75-80.
杨育凯,简林江,王志勇,等,2013.黄姑鱼正常二倍体和雌核发育体胚胎发育及早期生长的比较研究.上海海洋大学学报,22(5):690-697.
(本文编辑:袁泽轶)
Effects of low temperature stress on activities of antioxidant enzymes,Na+/-K+-ATP enzyme and Hsp70 content of Nibea albiflora
LUO Sheng-yu1,XU Dong-dong2,LOU Bao2,CHEN Rui-yi2,ZHAN Wei2,MAO Guo-ming2
(1.ZhejiangOcean University,Zhoushan 316004,China;2.Zhejiang Province Key Lab of MaricultureandEnhancement, Marine Fishery Institute of Zhejiang Province,Zhoushan 316021,China)
In order to investigate the effects of low temperature treatment on the physiological function of juvenile Nibea albiflora,we investigated the effect of cold stress on activities of antioxidant enzymes,Na+/-K+-ATP enzyme and Hsp70 content in juvenile Nibeaalbiflora.Four treatments were set up,and 18℃was as the control and 8℃,10℃and 14℃groups were as experimental groups.We measured the activities of antioxidant enzymes,Na+K+-ATP enzymes and Hsp70 content of N.albiflora at different temperatures.The results showed that the temperature significantly influenced the SOD and CAT enzyme activities,and Na+/-K+-ATP enzyme activities and Hsp70 content of N.albiflora.The results showed that antioxidant enzyme activities increased in the beginning and then decreased under the low temperature stress,and at 72 h post-stress, antioxidant enzyme activities in low temperature treatments were at the same level as the control(P>0.05).Na+/-K+-ATP enzyme activities in the muscles of low temperature treatments showed the trend of decreasing firstly and then rising during the process of cold temperature stress.The Na+/-K+-ATP enzyme activities of 10℃and 14℃treatments could recover and have no significant differences at 72 h post-stress compared with the 18℃treatment,but the activities of Na+/-K+-ATP enzyme in 8℃treatment remained lower at 72 h post-stress.The Hsp70 contents in different treatments were also impacted by the low temperature,and showed the trend of increasing firstly and then decreasing during the process of cold temperaturestress.Compared with the control,the Hsp70 contents of 10℃and 14℃treatments recovered and showed insignificant differences at 72 h post-stress.However,the Hsp70 contents remained higher than that of control at 72 h post-stress. Therefore,SOD,CAT,Na+/-K+-ATPase and Hsp70 were involved in the process when N.albiflora was responding to low temperature stress,and they could be the markers corresponding to cold stress in N.albiflora.
low temperature stress;Nibea albiflora;superoxide dismutase enzyme;catalase enzyme;Na+/-K+-ATP enzyme;heat shock protein 70
P735
A
1001-6932(2017)02-0189-06
10.11840/j.issn.1001-6392.2017.02.010
2015-12-31;
2016-04-06
国家自然科学基金(41476127);浙江省科技计划项目(2012C12907-8;2015F10001)。
罗胜玉(1990-),男,硕士研究生,主要从事水产动物遗传育种研究。电子邮箱:548559704@qq.com。
徐冬冬,教授级高工。电子邮箱:xudong0580@163.com;楼宝,研究员。电子邮箱:loubao6577@163.com。
