单环刺螠Bcl-xL基因的鉴定及对硫化物的应激反应
2017-05-13马晓玉刘晓龙魏茂凯谢跃洋张志峰
马晓玉,刘晓龙,魏茂凯,谢跃洋,张志峰
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
单环刺螠Bcl-xL基因的鉴定及对硫化物的应激反应
马晓玉,刘晓龙,魏茂凯,谢跃洋,张志峰
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
Bcl-xL是Bcl-2家族中一类重要的抗凋亡因子,其功能主要是抑制细胞凋亡、促进肿瘤发生。为了探知Bcl-xL在生物硫化物应激中的作用,本实验以耐硫生物单环刺螠(Urechis unicinctus)为研究对象,RACE扩增获得一个长度为1 426 bp的单环刺螠Bcl-xL全长cDNA序列,推导的氨基酸序列包含Bcl-xL4个保守的BH结构域和1个跨膜区域。使用该cDNA的完整开放阅读框序列,构建了原核表达载体pET28a-Bcl-xL,体外诱导表达该重组蛋白;镍柱纯化得到纯度为90%的纯化蛋白,并制备多克隆抗体。Western blotting结果显示:单环刺螠暴露于50 μmol/L硫化物中2 h-24 h内其呼吸肠中Bcl-xL含量显著增加(P<0.05),然而在150 μmol/L硫化物中48 h-72 h内其呼吸肠Bcl-xL含量显著降低(P<0.05),暗示Bcl-xL抑制细胞凋亡途径在单环刺螠应对低浓度硫化物暴露时发挥作用,而在高浓度硫化物暴露下Bcl-xL不能发挥抑制细胞凋亡的作用。
单环刺螠;Bcl-xL;细胞凋亡;硫化物
Bcl-2家族成员可以分为3类:第Ⅰ类含有4个Bcl-2同源结构域(BH1、BH2、BH3、BH4),具有抗凋亡的作用;第Ⅱ类含有3个Bcl-2同源结构域(BH1、BH2和BH3),具有促凋亡的作用;第Ⅲ类只含有BH3结构域,具有促凋亡的作用(Cory et al,2003;郭文娟等,2008;Fulda et al,2010)。Bcl-xL属于第Ⅰ类Bcl-2蛋白,它可通过3个途径抑制细胞的凋亡。①Bcl-xL与线粒体凋亡通路(内源性凋亡途径)中的Apaf-1分子结合,阻止Apaf-1的寡聚化,进而抑制Caspase9的活化和细胞的凋亡(Hu et al,1998);②Bcl-xL通过阻断Bax(第II类Bcl-2蛋白)对线粒体外膜的破坏发挥抗凋亡作用(Breckenridge et al,2004);③Bcl-xL通过干扰死亡诱导信号复合体DISC的组装,抑制半胱氨酸天冬氨酸蛋白酶Casepase-8的活性从而抑制凋亡(Wang et al,2004)。
在应对各种环境因子时,Bcl-xL的反应不同。四环素可以上调人HT1080纤维肉瘤细胞中的BclxL表达,进而抑制细胞凋亡(Chen et al,2000)。然而,绿茶多元酚EGGC却导致人肝细胞瘤HLE细胞中Bcl-xL的下调表达,诱导其发生细胞凋亡(Nishikawa et al,2006)。在人前列腺癌细胞中,二乙胺一氧化氮亲核复合体可以抑制Bcl-xL表达,从而抑制肿瘤的增长(Huerta-Yepez et al,2013)。由此,可以通过检测Bcl-xL表达水平的改变反应细胞应激下的凋亡状态。
单环刺螠(Urechis unicinctus)俗称“海肠子”,隶属螠虫动物门(Echiurioidea)、螠纲(Echiurida)、无管螠目(Xenopneusta)、刺螠科(Urchidae),主要栖息在近岸潮间带或潮下带泥沙底质中。单环刺螠的硫化物耐受性以及线粒体硫化物氧化解毒机制已经被阐述(张志峰等,2006;蒲晓强等,2009;Wang et al,2010;Ma et al,2012a; Ma et al,2012b;Huang et al,2013;Zhang et al,2013)。最近,Liu等(2015)采用数字基因差异表达技术揭示硫化物的暴露可以引起单环刺螠组织细胞中MAPKs、NF-κB和凋亡等信号通路中的多个信号分子表达发生改变。本实验我们克隆获得单环刺螠抗凋亡基因Bcl-xL的全长cDNA序列;使用体外原核表达的Bcl-xL重组蛋白制备多克隆抗体,Western blotting确定不同浓度硫化物应激下单环刺螠呼吸肠中Bcl-xL的表达,以期探讨该基因在单环刺螠应对硫化物中的作用,为解释生物耐受硫化物的分子机制提供新的认识。
1 材料与方法
1.1实验动物
单环刺螠购自青岛市四方路水产市场,产地为烟台沿海。选择体表无伤痕,体态均一的健康个体(33.4±10.4 g),于充气的海水(17.6±0.3°C,pH 8.01±0.02,盐度32 PSU)中暂养3 d,每日换水2次,每次换水1/2。
1.2实验分组与取样
实验分为2个实验组[50 μmol/L硫化物(适度应激浓度)和150 μmol/L硫化物(损伤应激浓度)]和1个对照组(不添加硫化物),每组设3个玻璃培养缸,每缸盛有30 L过滤海水,每缸投放10只单环刺螠,使用双层保鲜膜密封玻璃缸口。实验组的硫化物以母液(10 mmol/L NaHS,pH 8.0)形式加入,采用亚甲基蓝标定法(Cline,1969;张际标等,2014)测定硫化物浓度,根据预实验结果,每隔2 h添加一次硫化物以维持硫化物浓度的相对恒定。在硫化物处理0 min、30 min、60 min、90 min、120 min、6 h、24 h、48 h、72 h时分别于各个玻璃缸中取出1只单环刺螠(每组3只),解剖虫体取其呼吸肠,PBS(pH 7.4)漂洗后,于液氮中速冻,存于-80℃冰箱中备用。
1.3总RNA提取和cDNA合成
1.4 RACE扩增
从单环刺螠转录组(www.ncbi.nlm.nih.gov/ Traces/sra/sra.cgi,accession number:SRA122323)中得到Bcl-xL部分片段序列,设计5′及3′RACE特异引物(5′RACE引物:5′-ATCGAATGCATCCCAGCCGCCTTGT-3′和5′巢式引物:5′-GGTTCTCCGAAGGGTAATGGCGTGC-3′;3′RACE引物:5′-ATCAGCTCGCCATTACCCTTCGGAG-3′和3′巢式引物:5′-GGTTCTCCGAAGGGTAATGGCGTGC-3°)。使用SMARTTMRACE cDNA试剂盒并按照操作指南分别扩增目的cDNA的5′和3′端序列。循环参数为94℃5 min;94℃30 s,66℃30 s,72℃30 s,35个循环;72℃10 min。
1.5目的基因的生物信息学分析
使用DNASTAR对5′RACE和3′RACE片段进行拼接,搜索开放阅读框(Open reading frame,ORF)并预测氨基酸序列。将测序结果与GenBank数据库中的已知序列进行Blastx同源性分析。使用Clustal X 2.0和DNAMAN进行序列比对分析,使用MEGA 5.0.1邻位相连(Neighbor-joining)法构建进化树,bootstrap为1000个循环。
1.6原核表达载体的构建
根据目的基因全长cDNA序列设计一对引物(P1:5'-GAGCTCATGGATGTAACAGACT-3'(下划线标识处为SacⅠ酶切位点)和P2:5'-CTCGAGTCTCACAGCTACCATC-3'(下划线标识处为XhoⅠ酶切位点),以扩增目的基因的ORF cDNA序列。PCR产物经1.2%琼脂糖凝胶电泳鉴定、回收和纯化后,连接到pMD18-T载体,再转入DH5α感受态细胞中,送至华大基因进行测序。
将含有目的基因ORF cDNA序列的pMD18-T载体与pET28a载体分别用SacⅠ和XhoⅠ双酶切,回收片段后连接、转化大肠杆菌BL21感受态细胞,37℃倒置培养过夜。
1.7目的基因诱导表达及鉴定
阳性菌株在卡那霉素的LB培养基中37℃震荡过夜,次日以1∶100接种扩大培养,当OD值在600 nm波长下达到0.5时,加入IPTG至终浓度为1 mmol/L,诱导表达4 h,离心收集总蛋白。超声破碎后离心取上清和沉淀进行SDS-PAGE分析。
1.8重组蛋白的纯化
取100 mL诱导表达的菌液,4℃,5 000 g离心10 min,去上清,收集菌体。用8 mL预冷的PBS(pH 8.0)重悬,冰浴中超声15 min(功率20%,超声4 s,停顿9 s)。将溶液4℃13 700 g离心10 min。去上清,收集沉淀,溶于8 ml Buffer B,冰水中磁力搅拌器搅拌5 h。溶液4℃2 400 g离心10 min,取上清。按说明书用镍柱纯化BclxL蛋白,SDS-PAGE分析鉴定洗脱液中蛋白成分。将纯化后的Bcl-xL送生工生物工程(上海)股份有限公司制备多克隆抗体。Western blotting检验抗体特异性。
1.9组织总蛋白提取和含量测定
取上述各组单环刺螠呼吸肠冻存组织,分别在冰浴中用电动匀浆器(Pro Scientific PRO 200,美国)匀浆。利用蛋白提取试剂盒(康为,北京)并按照说明书提取呼吸肠总蛋白,于13700 g离心,取上清即为总蛋白。总蛋白含量以牛血清蛋白为标准,采用考马斯亮蓝法测定(Bradford,1976)。
1.10 Westernblotting检测
取各组呼吸肠总蛋白50 μg进行SDS-PAGE电泳分离,用转膜仪(Biorad,美国)在5 mA/cm2的稳流条件下转膜20 min将目的蛋白转至PVDF膜(Roche,美国)上,5%脱脂奶粉室温封闭1.5 h,然后加入Bcl-xL一抗,4℃孵育过夜,次日用TBST(pH 8.0)洗膜5次,每次5 min,再加入辣根过氧化物酶标记羊抗兔二抗(BBI,上海),室温孵育1.5 h,超敏ECL化学发光液显色,于ChemiDoc MP imaging system(Biorad,美国)上拍照。用Image Lab软件将图像转换成灰度值,以β-actin作为内参调平各样本的总蛋白量,取目的蛋白与β-actin灰度值的比值作为蛋白的含量。
1.11数据分析
各组样品中目的蛋白含量使用平均值±标准误(n=3)表示。显著性差异使用SPSS 18.0软件进行独立样本T检验和单因素方差分析计算,P<0.05代表具有显著性差异。
2 结果
2.1单环刺螠Bcl-xL cDNA序列特征
5′和3′RACE扩增片段组装后获得一个全长为1426bp的cDNA序列(GenBank注册号:KT999395),其中ORF长705 bp,编码234个氨基酸;5′非翻译区(Untanslated Regions,UTR)为150 bp,3′UTR为571 bp。生物信息学预测该蛋白的分子质量为26.47 kDa,理论等电点8.676;推导的氨基酸序列包含Bcl-xL家族成员共有的4个BH保守结构域和1个跨膜区(图1A);该氨基酸序列与已报道的Bcl-xL氨基酸序列同源,与太平洋牡蛎(Crassostreagigas)的一致性为41%,与菲律宾蛤仔(Ruditapes philippinarum)的一致性为39%。所构建的系统进化树结果表明,单环刺螠Bcl-xL首先与两种贝类(菲律宾蛤仔和太平洋牡蛎)的Bcl-xL聚类,然后依次与紫海胆、脊椎动物聚类(图1B)。

图1 不同物种Bcl-xL蛋白的氨基酸多序列比对(A)和聚类分析(B)
2.2 Bcl-xL重组蛋白的诱导表达和纯化
将含有单环刺螠Bcl-xL ORF序列的pET28a-Bcl-xL载体转入大肠杆菌中,1 mmol/L IPTG诱导4 h获得包涵体形式的重组蛋白。Ni2+-NTA纯化后得到纯度约为90%的单环刺螠Bcl-xL蛋白,其分子质量约为29 kDa,与预期蛋白大小一致(图2)。使用纯化的单环刺螠Bcl-xL制备多克隆抗体,Western blotting检测,该抗体在单环刺螠呼吸肠总蛋白中显示单一的特异性条带(图2)。
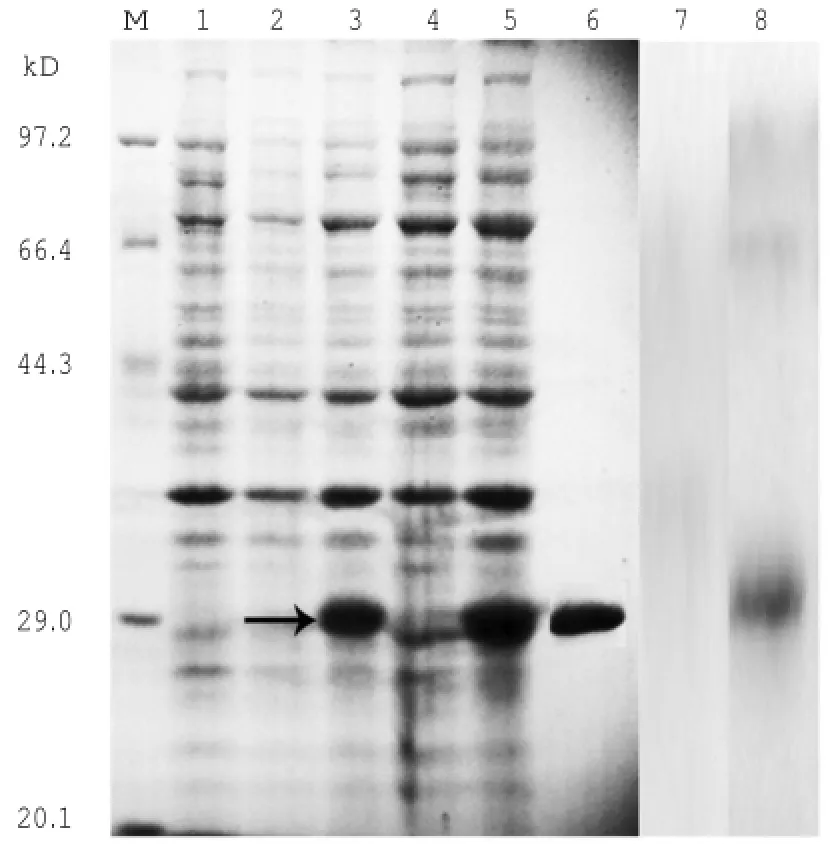
图2 单环刺螠Bcl-xL重组蛋白的诱导表达纯化及抗体特异性检测
2.3硫化物应激下Bcl-xL蛋白表达量的变化
Western blotting结果显示,单环刺螠暴露在不同浓度硫化物环境中,其呼吸肠细胞Bcl-xL的应激反应不同(图3)。实验期间,对照组中Bcl-xL的表达量未见显著性变化。
单环刺螠在50 μmol/L硫化物中暴露1.5 h内,其呼吸肠细胞中Bcl-xL表达量基本稳定;当虫体在50 μmol/L硫化物中暴露2~24 h时,其呼吸肠中Bcl-xL表达量显著增加(P<0.05),并且以暴露2 h时呼吸肠中Bcl-xL表达量为最高,较1.5 h硫化物组高2.1倍,较相同时间对照组高2倍;随后Bcl-xL表达量显著降低,并在暴露48~72 h期间,表达量恢复到对照水平(图3B)。
单环刺螠暴露在150 μmol/L硫化物中24 h内,其呼吸肠细胞中Bcl-xL的表达量呈小幅波动,但未见显著性差异;当暴露48 h时,Bcl-xL表达量较相同时间对照组显著降低(P<0.05),仅为对照组的68%,是24 h硫化物组的75%,随后继续降低,至暴露72 h时达到最低值,仅是对照组相同时间的63%(图3C)。
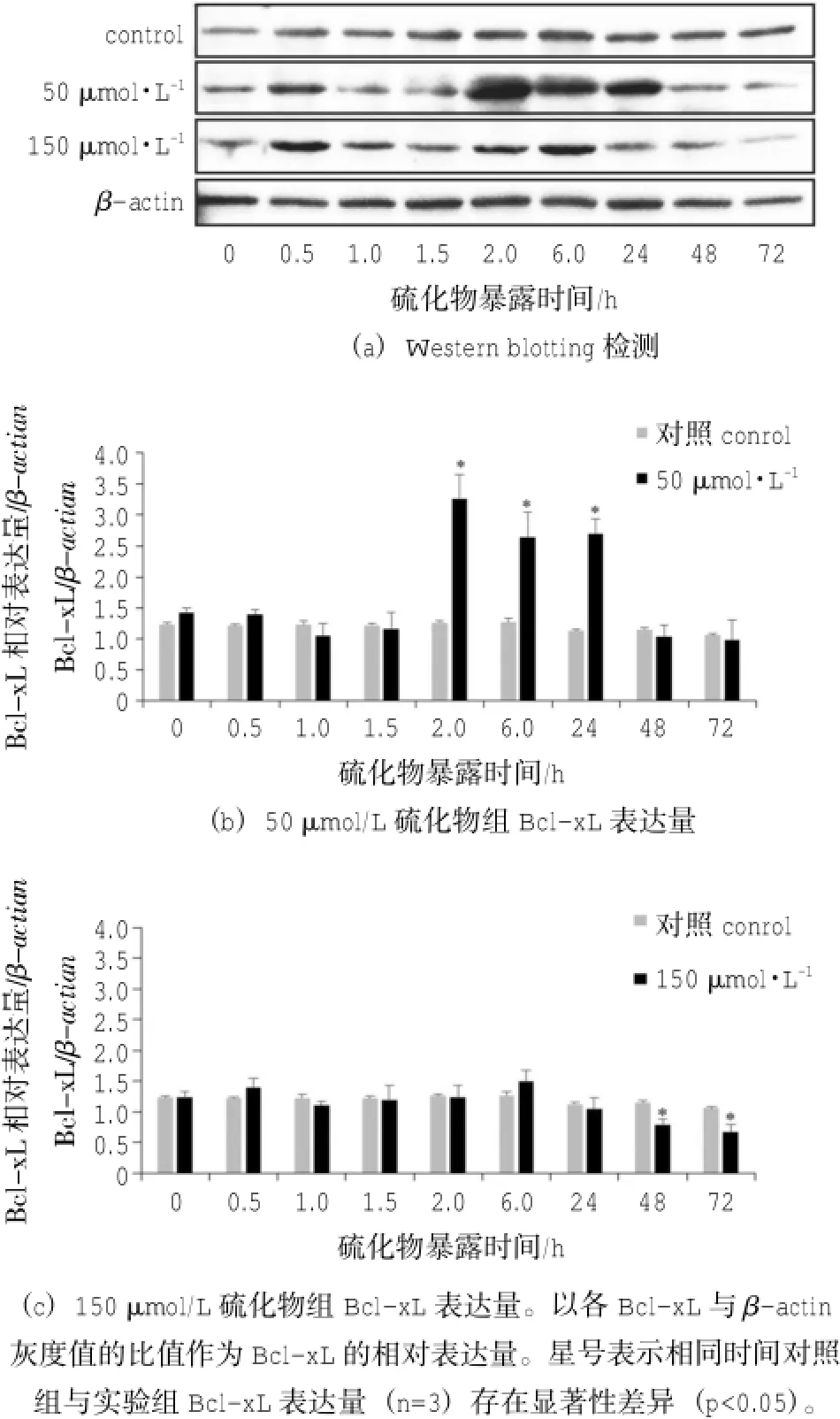
图3 硫化物应激下单环刺螠呼吸肠Bcl-xL含量的Westernblotting检测
3 讨论
Bcl-xL作为一个重要的抗凋亡分子,其序列已在许多物种中报道,它们均以保守的结构域(BH1、BH2、BH3、BH4)而被鉴定(Chipuk et al,2010)。本实验获得一个单环刺螠全长cDNA序列,推导的氨基酸序列中包含4个保守的BH结构域,并与其他物种的Bcl-xL聚类,初步确定该序列为单环刺螠Bcl-xL全长cDNA序列。Blastx分析已报道物种的Bcl-xL同源性,发现进化地位越高的物种其Bcl-xL序列的一致性在同一类的各物种之间越高,哺乳动物中Bcl-xLs的一致性最高,约为98%;鸟类中Bcl-xLs的一致性约为70%;鱼类中Bcl-xL的一致性仅为50%左右;软体动物中一致性更低,为30%左右。由于本实验所得Bcl-xL是螠虫动物门中的首个序列,所以无法进行同门动物Bcl-xL的同源性比对。我们将单环刺螠Bcl-xL与已报道的其他物种Bcl-xL同源性进行比对,发现一致性普遍较低,如:与太平洋牡蛎一致性为41%,与其它物种一致性基本为30%左右,一定程度上体现了低等动物中Bcl-xLs的一致性较低的特点。
重组蛋白的原核体外表达受很多因素影响,其中表达载体、诱导剂的浓度和诱导表达的时间是影响体外表达蛋白的重要因子(马玉彬等,2010)。pET28a是常见的表达载体,其含有组氨酸标签,该标签对蛋白正常折叠影响小,而且还可以与Ni2+-NTA层析介质特异性结合,利于纯化表达的重组蛋白,所以被广泛运用于原核表达。吴任等(2006)报道,诱导剂IPTG浓度在0.1~1 mmol/L的范围内均适于重组蛋白的诱导表达,并且在1 mmol/L IPTG时目的蛋白表达量最高(韩俊英等,2011)。本实验中,我们使用表达载体pET28a,在1 mmol/L IPTG和37℃条件下,成功获得了单环刺螠Bcl-xL重组表达蛋白。该蛋白的表达量随诱导时间的增加逐渐增加,并在4 h达到最高。
Bcl-xL在应对各种内外因子的过程中表现不同。外源IL-5基因的导入,引起鼠嗜酸性粒细胞中Bcl-xL蛋白表达量显著上调,并促进细胞存活(Schwartz et al,2015)。H2S可以引起老鼠心脏中Bcl-xL蛋白上调表达,抑制细胞凋亡(Calvert et al,2009)。当在感染虹彩病毒的金目鲈斑鳍细胞系细胞中过表达Bcl-xL时,细胞的线粒体分解减少,细胞活力增强(Chen et al,2015)。相反,二甲氧基酮可引起肝癌细胞中Bcl-xL下调表达,促进肝癌细胞凋亡,从而改善肿瘤损伤(Khan et al,2011)。绿茶多元酚EGCG的应激可下调HLE细胞(Nishikawa et al,2006)和A549细胞(Sonoda et al,2014)中Bcl-xL mRNA和蛋白的表达量,诱导细胞凋亡,且随着绿茶多元酚处理浓度的增加,对Bcl-xL表达抑制效应逐渐增强。由此可见,Bcl-xL的上调表达,可促进细胞的存活;而其下调表达,将导致细胞凋亡。本实验当单环刺螠暴露在50 μmol/L硫化物中2 h-24 h期间,其呼吸肠细胞中的Bcl-xL蛋白水平显著上调(P<0.05),暗示呼吸肠细胞通过提高Bcl-xL的表达以抵抗硫化物暴露可能引起的细胞凋亡,维持机体的正常生理状态;但是,当硫化物暴露时间延长至48 h以后,单环刺螠呼吸肠中的Bcl-xL应激抗凋亡作用减弱甚至消失。
毛地黄黄酮处理人肿瘤细胞,引起Bcl-xL蛋白表达量的下调同时提高了Bax蛋白的表达量,提出Bax/Bcl-xL比例的提高可促进细胞凋亡(Chang et al,2005)。Cao等(2006)报道,尽管10 μM NaHS处理3 h的鼠胰腺泡细胞中Bcl-xL蛋白的表达量未发生改变,但其Bax蛋白表达显著上调,也导致了细胞的凋亡。本实验,单环刺螠暴露在150 μmol/L硫化物中24 h内未见呼吸肠中Bcl-xL表达量发生明显的变化,但在暴露48 h和72 h时呼吸肠中Bcl-xL的表达量显著下降(P<0.05),暗示单环刺螠在高浓度(150 μmol/L)硫化物中其Bcl-xL抗凋亡作用受到抑制。张志峰等(2006)报道,单环刺螠对低浓度硫化物具有较强的耐受能力,而对高浓度硫化物的长期暴露耐受力明显减弱。由此我们推测,高浓度硫化物的长期暴露,可能导致机体细胞的严重损伤而不能自我修复。
Bradford M M,1976.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding.Analytical Biochemistry,72:248-254.
Breckenridge D G,Xue D,2004.Regulation of mitochondrial membrane permeabilization by BCL-2 family proteins and caspases.Current Opinion in Cell Biology,16(6):647-652.
Calvert J W,Jha S,Gundewar S,et al,2009.Hydrogen Sulfide Mediates Cardioprotection through Nrf2 Signaling.Circulation Research,105 (4):365-374.
Cao Y,Adhikari S,Ang A D,et al,2006.Mechanism of induction of pancreatic acinar cell apoptosis by hydrogen sulfide.American Journal of Physiology-Cell Physiology,291(3):C503-C510.
Chang J S,Hsu Y L,Kuo P L,et al,2005.Increase of Bax/Bcl-XL ratio and arrest of cell cycle by luteolin in immortalized human hepatoma cell line.Life Sciences,76(16):1 883-1 893.
Chen C,Edelstein L C,Gelinas C,2000.The Rel/NF-κB family directly activates expression of the apoptosis inhibitor Bcl-xL.Molecular and Cell Biology,20(8):2 687-2 695.
Chen X Y,Wen C M,Hui C F,et al,2015.Giant seaperch iridovirus infection upregulates Bas and Bak expression,leading to apoptotic death of fish cells.Fish&Shellfish Immunology,45(2):848-857.
Chipuk J E,Moldoveanu T,Llambi F,et al,2010.The BCL-2 family reunion.Molecular Cell,37(3):299-310.
Cline J D,1969.Spectrophotometric determination of hydrogen sulfide in natural waters.Limnology and Oceanography,14(3):454-458.
Cory S,Huang D C S,Adams J M,2003.The Bcl-2 family:roles in cell survival and oncogenesis.Oncogene,22(53):8 590-8 607.
Fulda S,Gorman A M.,Hori O,et al,2010.Cellular stress responses:cell survival and cell death.International Journal of Cell Biology, 214074.
Hu Y,Benedict M A,Wu D,et al,1998.Bcl-XL interacts with Apaf-1 and inhibits Apaf-1-dependent caspase-9 activation.Proceedings of the National Academy of Sciences,95(8):4 386-4 391.
Huang J,Zhang L,Li J,et al,2013.Proposed function of alternative oxidase in mitochondrial sulphide oxidation detoxification in the Echiuran worm,Urechis unicinctus.Journal of the Marine Biological Association of the United Kingdom,93(8):2 145-2 154.
Huerta-Yepez S,Baritaki S,Baay-Guzman G,et al,2013.Contribution of either YY1 or BclXL-induced inhibition by the NO-donor DETANONOate in the reversal of drug resistance,both in vitro and in vivo.YY1 and BclXL are overexpressed in prostate cancer.Nitric Oxide,29:17-24.
Khan M S.,Halagowder D,Devaraj S N,2011.Methylated chrysin induces coordinated attenuation of the canonical Wnt and NF-κB signaling pathway and upregulates apoptotic gene expression in the early hepatocarcinogenesis rat model.Chemico-Biological Interactions,193(1):12-21.
Liu X,Zhang L,Zhang Z,et al,2015.Transcriptional response to sulfide in the Echiuran Worm Urechis unicinctus by digital gene expression analysis.BMC Genomics,16(1):1.
Ma Y B,Zhang Z F,Shao M Y,et al,2012a.Function of the anal sacs and mid-gut in mitochondrial sulfide metabolism in the echiuran worm Urechisunicinctus.MarineBiologyResearch,8(10):1026-1031.
Ma Y B,Zhang Z F,Shao M Y,et al,2012b.Response of sulfide:quinone oxidoreductase to sulfide exposure in the echiuran worm Urechis unicinctus.Marine Biotechnology,14(2):245-251.
Nishikawa T,Nakajima T,Moriguchi M,et al,2006.A green tea polyphenol,epigalocatechin-3-gallate,induces apoptosis of human hepatocellular carcinoma,possibly through inhibition of Bcl-2 family proteins.Journal of Hepatology,44(6):1 074-1 082.
Schwartz C,Willebrand R,Huber S,et al,2015.Eosinophil-specific deletion of IκBα in mice reveals a critical role of NF-κB-induced Bcl-xL for inhibition of apoptosis.Blood,125(25):3 896-3 904.
Sonoda J I,Ikeda R,Baba Y,et al,2014.Green tea catechin,epigallocatechin 3 gallate,attenuates the cell viability of human non small cell lung cancer A549 cells via reducing Bcl xL expression.Experimental and Therapeutic Medicine,8(1):59-63.
Wang S,Zhang Z,Cui H,et al,2010.The effect of toxic sulfide exposure on oxygen consumption and oxidation products in Urechis unicinctus(Echiura:Urechidae).Periodical of Ocean University of China, 9(2):157-161.
Wang X,Zhang J,Kim H P,et al,2004.Bcl-XL disrupts death-inducing signal complex formation in plasma membrane induced by hypoxia/ reoxygenation.The FASEB journal,18(15):1 826-1 833.
Zhang L,Liu X,Liu J,et al,2013.Characteristics and function of sulfur dioxygenase in echiuran worm Urechis unicinctus.Plos One,8 (12):e81885.
郭文娟,王爱英,2008.凋亡抑制基因Bcl-xL的研究进展.世界华人消化杂志,16(25):2 871-2 876.
韩俊英,李建,李吉涛,等,2011.脊尾白虾热休克蛋白HSP90基因的原核表达与鉴定.渔业科学进展,32(5):44-50.
马玉彬,谭志,张志峰,2010.单环刺螠硫醌氧化还原酶的表达、纯化和复性.中国海洋大学学报:自然科学版,40(6):081-086.
蒲晓强,钟少军,刘飞,等,2009.胶州湾李村河口沉积物中酸可溶硫化物与活性金属分布特征.海洋通报,28(3):37-44.
吴任,谢数涛,孙勇,等,2006.凡纳滨对虾热休克蛋白70的原核高效表达.中国水产科学,13(2):305-309.
张际标,刘加飞,姚兼辉,等,2014.湛江东海岛潮间带沉积物硫化物(AVS)和重金属(SEM)及其生物毒效性评估.海洋通报,33(4):405-412.
张志峰,王思峰,霍继革,等,2006.单环刺螠对硫化物暴露的呼吸代谢适应.中国海洋大学学报:自然科学版,36(4):639-664.
(本文编辑:袁泽轶)
Identification of Bcl-xL gene and its response to sulfide stress in Urechis Unicinctus
MA Xiao-yu,LIU Xiao-long,WEI Mao-kai,XIE Yue-yang,ZHANG Zhi-feng
(Ministry of EducationKey Laboratory of Marine GeneticsandBreeding,Ocean University of China,Qingdao266003,China)
Bcl-xL,a member of Bcl-2 family is an important anti-apoptosis factor participating in the inhibition of cell apoptosis and promotion of tumour forming.In the present study,we employed Urechis unicinctus,a sulfide-tolerant Echiuran worm to investigate the role of Bcl-xL in the response to sulfide exposure.A full-length cDNA of 1,426 bp from U. unicinctus Bcl-xL was cloned by RACE amplification,and the deduced amino acid sequence included 4 conserved BH domains and a transmembrane domain found in all Bcl-xL.A prokaryotic expression vector,pET28a-Bcl-xL was constructed using the open reading frame sequence of U.unicinctus Bcl-xL,and the recombination protein of Bcl-xL was inductively expressed in vitro.The protein of 90%purity was obtained by nickel column purification and the polyclonal antibody was made.Western blotting showed that content of Bcl-xL increased significantly(P<0.05)in the hindgut tissue of U. unicinctus exposed to 50 μmol/L sulfide from 2 h to 24 h,while decreased significantly(P<0.05)in that of 150 μmol/L sulfide from 48 h to 72 h,implying that the Bcl-xL inhibiting apoptosis pathway played a role in U.unicinctus resisting the exposure of lower concentration sulfide,while no apoptosis inhibition of Bcl-xL occurred in the higher concentration sulfide.
Urechis unicinctus;Bcl-xL;cell apotosis;sulfide
Q78
A
1001-6932(2017)02-0182-07
10.11840/j.issn.1001-6392.2017.02.009
2015-12-10;
2016-03-05
国家自然科学基金(31372506)。
马晓玉(1990-),硕士研究生,主要从事海洋动物应激反应研究。电子邮箱:XiaoyuMa@126.com。
张志峰,教授。电子邮箱:zzfp107@ouc.edu.cn。
