水解度对麦胚清蛋白酶解物功能特性和抗氧化力影响
2017-05-12胡莉丽王炳智钟昔阳罗水忠姜绍通
胡莉丽,王炳智,钟昔阳,罗水忠,姜绍通,郑 志
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
水解度对麦胚清蛋白酶解物功能特性和抗氧化力影响
胡莉丽,王炳智,钟昔阳,罗水忠,姜绍通,郑 志*
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽合肥 230009)
利用碱性蛋白酶限制性酶解麦胚清蛋白,研究不同水解度(degree of hydrolysis,DH)酶解物的溶解性、乳化性等功能特性,及对DPPH自由基和羟自由基清除等抗氧化能力。实验结果表明,水解后清蛋白酶解物的溶解性得到改善,DH越高溶解性越好。DH为8.34%时,等电点处的溶解度从未水解时的49.52%提高到74.09%。而乳化性和乳化稳定性随DH的增加而降低。当DH低于7.54%时,酶解物对DPPH自由基和对羟自由基的清除率随DH的提高而增强。浓度为100 mg/mL,DH为7.54%时的酶解物对DPPH自由基清除率达到59.68%。浓度为5 mg/mL时,DH为7.54%时的酶解物对羟自由基清除率达50.23%。
麦胚清蛋白,水解度,酶解物,功能特性,抗氧化力
小麦胚芽(简称麦胚)是小麦的主要副产物,我国年麦胚潜藏量高达280万吨[1]。麦胚含有丰富的蛋白质、脂肪、酶、维生素、矿物质及多种微量生理活性物质,被称为小麦籽粒生命的源泉[2]。目前针对麦芽产品的开发主要集中在胚芽蛋白、胚芽油、VE、凝集素和谷胱甘肽提取等方面[3]。麦胚中蛋白质含量高达30%左右,其中清蛋白占30.2%,球蛋白占18.9%[4]。李天文等人对麦胚中各种蛋白进行研究,发现麦胚清蛋白所含的氨基酸总量最高,且有较高的持水性[5]。贾俊强等人对麦胚蛋白分级提取得到的清蛋白、球蛋白、醇溶蛋白和谷蛋白进行了研究,证明了清蛋白具有最好的抗氧化性[6]。
近年来植物源蛋白酶解制备多肽的研究成为热点。这些多肽尤其是一些小分子肽不仅比蛋白质更好被人体消化吸收[7],还具有免疫调节、降血压、抗疲劳和抗氧化等有生物活性[8]。如草鱼鱼鳞多肽具有清除羟自由基能力[9];花生蛋白肽具有抑制ACE的活性[10];秋刀鱼蛋白肽具有抗氧化和抗疲劳活性[11]。对麦胚清蛋白酶解物的研究目前较多集中在酶解工艺优化方面,而在酶解物的性质方面探究较少。研究表明,酶解物的溶解性、乳化性等功能特性和抗氧化力等生理活性与水解度有密切关系[12],酶解过程中控制合适的水解度很有必要。
本文通过研究水解度对麦胚清蛋白酶解物功能特性和抗氧化力的影响,比较不同水解度的酶解物的溶解性、乳化性及乳化稳定性、清除DPPH自由基能力和清除羟自由基能力,便于控制合适的水解度以制备相关产物,研究结果可为麦胚清蛋白酶解物在食品、药品及其他行业的应用提供参考。
1 材料与方法
1.1 材料与仪器
脱脂小麦胚芽粉(蛋白含量31.51%) 购于河南鲲华生物技术有限公司;碱性蛋白酶(酶活2×105U/g)、木瓜蛋白酶(酶活8×105U/g)、中性蛋白酶(酶活2×105U/g)、复合风味酶(酶活1.5×104U/g) 购于南宁庞博生物工程有限公司;胰蛋白酶(酶活2.5×105U/g) 购于北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 购于国药集团化工试剂有限公司;氢氧化钠、盐酸、95%乙醇、磷酸氢二钠、磷酸二氢钾、磷酸二氢钠、硫酸亚铁、水杨酸、过氧化氢、亚硝酸钠、邻苯三酚等 均为国产分析纯。
HH-4型数显恒温水浴锅 国华电器有限公司;JJ-1型数显电动搅拌器 金城国胜实验仪器厂;KDC-160HR型高速冷冻离心机 安徽中科中佳科学仪器有限公司;721G型可见分光光度计 上海精科;FD-1-50台式冷冻干燥机 北京博医康实验仪器有限公司;FA-25型高速分散器 上海佑一仪器有限公司;UDK-142 型全自动凯氏定氮仪 香港嘉盛科技有限公司。
1.2 实验方法
1.2.1 清蛋白的提取 清蛋白的提取参考朱科学等人[13]的方法略有改动。取100 g脱脂小麦胚粉于烧杯中,加入1000 mL去离子水,室温下搅拌浸提2 h后以8000 r/min离心20 min,取上清液,其沉淀中再加入500 mL去离子水进行相同的水提操作,合并两次上清液冷冻干燥后即为麦胚清蛋白(蛋白含量76.87%)。
1.2.2 蛋白酶的选择 制备浓度2%的清蛋白悬浮液,90 ℃热处理10 min,按照不同蛋白酶的最适条件,酶与底物比8000 U/g加入不同蛋白酶,用1 mol/L NaOH调至一定pH并在最适温度下反应1 h,测定不同酶反应1 h时的水解度,比较得出水解度高的蛋白酶用以制备样品。
实验中采用的不同蛋白酶解条件为:碱性蛋白酶pH9.0,温度55 ℃;中性蛋白酶pH7.5,温度55 ℃;木瓜蛋白酶pH8.0,温度55 ℃;复合风味酶pH7.0,温度50 ℃;胰蛋白酶pH8.0,温度37 ℃。
1.2.3 不同水解度酶解物的制备 制备浓度2%的清蛋白悬浮液,90 ℃热处理10 min,酶与底物比8000 U/g加入碱性蛋白酶,在pH9.0,温度55 ℃进行水解反应,分别收集反应时间为20、40、60、80、100 min的酶解物(用0.5 mol/L NaOH使体系pH稳定),收集后立即沸水浴灭酶10 min,快速冷却后以8000 r/min离心15 min,取上清液冷冻干燥,即得不同水解度的固态酶解物,以此为原料,测定并比较其功能特性和抗氧化力。
1.3 分析方法
1.3.1 水解度DH的测定 水解过程中滴加0.5 mol/L NaOH溶液控制体系pH为最适值不变,用pH-Stat[14]法测定DH,公式如下:
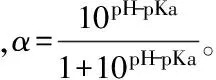
1.3.2 溶解度的测定 蛋白质的溶解度通常用氮溶指数NSI表示[15],即该蛋白质中能溶解于水的蛋白质氮量占该蛋白质氮总量的百分比。用蒸馏水配制50 mL浓度为0.1%的不同水解度酶解物溶液,用1 mol/L HCl或NaOH溶液调节溶液的pH分别至2.0、4.0、6.0、8.0和10.0,静置30 min后,将调好pH的溶液置于水浴摇床内室温振荡30 min,以5000 r/min离心20 min,采用Folin法测定上清液中蛋白质含量,凯氏定氮法测定冻干酶解物样品中总的氮含量,按下式计算氮溶指数NSI:
1.3.3 乳化性及乳化稳定性的测定 乳化性和乳化稳定性的测定采用贺楠[16]等人的方法。用蒸馏水配制90 mL浓度为0.2%的不同水解度酶解物溶液,用1 mol/L HCl或NaOH溶液调pH分别至2.0、4.0、6.0、8.0和10.0,分别加入30 mL植物油,用高速分散器以10000 r/min均质1 min后,立即从底部取100 μL乳化液稀释于20 mL 0.01%的SDS液中,以0.01% SDS溶液为空白参比,500 nm测吸光值A,乳化值EA用吸光值表示。
测定后的乳液在室温下放置24 h后在80 ℃加热30 min,冷却至室温,摇匀,按上述方法测定乳化性记为EAb。乳化稳定性ES按下式计算:
式中:EAb为放置24 h后的乳化性;EA为刚反应完溶液的乳化性。
1.3.4 对DPPH自由基清除率的测定 DPPH自由基清除率测定参照Chen N[17]等人的方法作了修改。取25支试管,各加入2 mL 125 μmol/L的DPPH无水甲醇溶液,每个水解度的酶解液各配5个浓度,取1 mL加入试管,加无水甲醇至4 mL(多肽在反应体系中浓度分别为0.0065%、0.0125%、0.025%、0.055%和0.1%),振荡后在黑暗中放置30 min。以无水甲醇为空白在517 nm测其吸光度A,同时测2 mL DPPH溶液和2 mL无水甲醇混合液的吸光值A0。并测多肽液加无水甲醇混合液的吸光值Ab,按下式计算清除率:
式中:A为多肽液、DPPH溶液和无水甲醇混合液的吸光值;A0为2 mL DPPH溶液和2 mL无水甲醇混合液的吸光值;Ab为多肽液加无水甲醇混合液的吸光值。
1.3.5 对羟自由基清除率的测定 采用水杨酸法测定酶解物对羟自由基清除率[18]。试管中加入 0.5 mL浓度为9 mmol/L的水杨酸-乙醇溶液,0.5 mL 浓度9 mmol/L FeSO4溶液,0.5 mL各水解时间下不同浓度的多肽液(浓度分别为1,2,3,4,5 mg/L),8 mL蒸馏水,加入0.5 mL 8.8 mmol/L H2O2启动Fenton反应,摇匀后于510 nm处测定吸光值A1;取0.5 mL蒸馏水代替FeSO4溶液测得吸光值A2;取0.5 mL蒸馏水代替多肽液测得吸光值A3,按下面公式计算清除率:
式中:A1为加了样品液的吸光值;A2为蒸馏水代替FeSO4的吸光值;A3为蒸馏水代替样品液的吸光值。
1.4 数据统计及分析
数据采用Excel 2007软件进行分析处理,SPSS 22.0软件进行数据差异显著性分析,Origin 9.0软件作图。
2 结果与分析
2.1 蛋白酶的选择
碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、复合风味酶和胰蛋白酶这五种蛋白酶分别在最适水解条件下水解麦胚清蛋白1 h,水解度如图1所示。
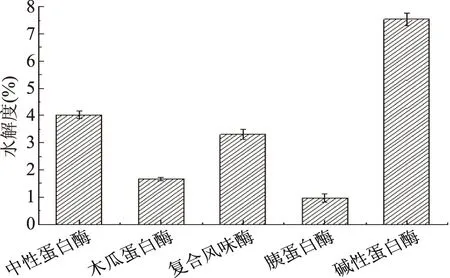
图1 不同蛋白酶水解麦胚清蛋白的DHFig.1 The DH of wheat germ albumin treated with different proteases
不同蛋白酶对同一种蛋白质底物作用的酶切位点不同,这直接导致酶解物中多肽的分子链长度、结构、组成、活性等不同[19]。用不同的蛋白酶对麦胚清蛋白进行酶解实验,由图1可知反应1 h时碱性蛋白酶的DH最高,达到7.54%,而中性蛋白酶和复合风味酶的DH相对较低,仅在4%左右。因此选用碱性蛋白酶作为本实验的后续水解酶。
2.2 不同水解度碱性蛋白酶酶解物的制备
以碱性蛋白酶水解麦胚清蛋白,通过控制水解时间来进行不同水解度酶解物的制备,水解度随时间变化如图2所示。
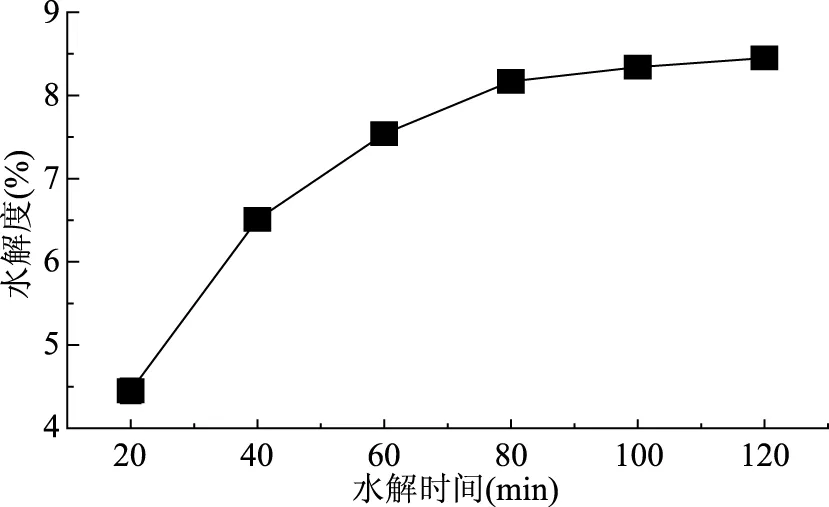
图2 碱性蛋白酶水解麦胚清蛋白的进程Fig.2 Hydrolysis process of wheat germ albumin treated with alkaline protease
从图2可以看出,水解开始的前60 min,随着时间增加,碱性蛋白酶酶解清蛋白的水解度急剧增大;60 min后随着水解的进行,DH的增加变缓,这主要是因为碱性蛋白酶是一种专一性较强的酶[20],有其特定的肽键作用位点,随着水解的进行,蛋白底物中特定的肽键会越来越少。此外有部分蛋白酶会失活,并伴随产物积累对酶的竞争性抑制,所以水解速度会越来越慢。水解100 min后,DH趋于平缓。水解过程中收集了20、40、60、80、100 min的酶解物,其DH分别为4.45%、6.51%、7.54%、8.17%和8.34%。
2.3 不同水解度酶解物的溶解性
碱性蛋白酶制备的不同水解度酶解物在不同pH下的溶解度如图3所示。

图3 DH与麦胚清蛋白酶解物溶解性的关系Fig.3 Effect of DH on solubility of wheat germ albumin hydrolysates
由图3可见,在不同的pH下,各水解度酶解物的溶解性均好于未水解清蛋白,这是因为水解过程中形成的小肽极性较强,分子间相互排斥作用增强,从而亲水性增强,提高了溶解性[15]。同一pH下,随着DH增大,溶解度也在变大,这在清蛋白等电点附近表现得较为明显。等电点附近时,蛋白质分子所带静电荷少,分子间的静电排斥作用力也小,因此蛋白质容易发生聚集、沉淀的现象[21]。
2.4 不同水解度酶解物的乳化性和乳化稳定性
不同水解度的酶解物溶液乳化性及乳化稳定性如图4(a、b)所示。
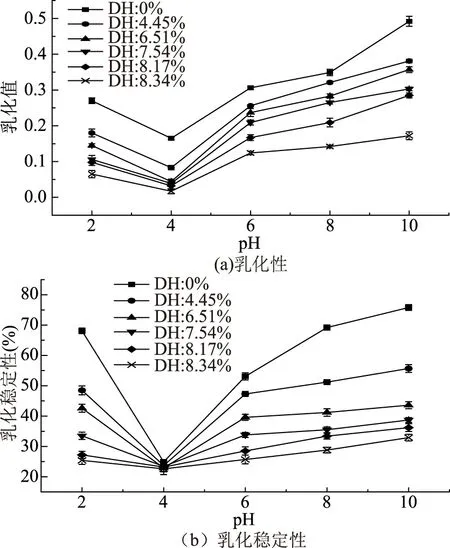
图4 DH与麦胚清蛋白酶解物乳化性及乳化稳定性的关系Fig.4 Effect of DH on emulsifying activity and emulsifying stability of wheat germ albumin hydrolysates
由图4(a、b)可知,随着DH的增加,麦胚清蛋白酶解物乳化性和乳化稳定性都逐渐下降。乳化反应的机制是溶液吸附到油滴的表面,从而形成保护膜以防止液滴聚结[22]。水解过程中的产物多数是小肽和氨基酸,尽管小肽在界面处吸附能力强,但由于没有什么折叠能力,它们不能像大分子蛋白质一样在界面上可以展开并适应界面张力[23]。此外,水解时蛋白质分子中维持蛋白质稳定结构的氢键和其他离子键也受到不同程度的破坏,所以溶液的乳化值随水解度提高而下降。
2.5 不同水解度酶解物清除DPPH自由基活性
不同水解度的清蛋白酶解物对DPPH自由基清除能力见图5。
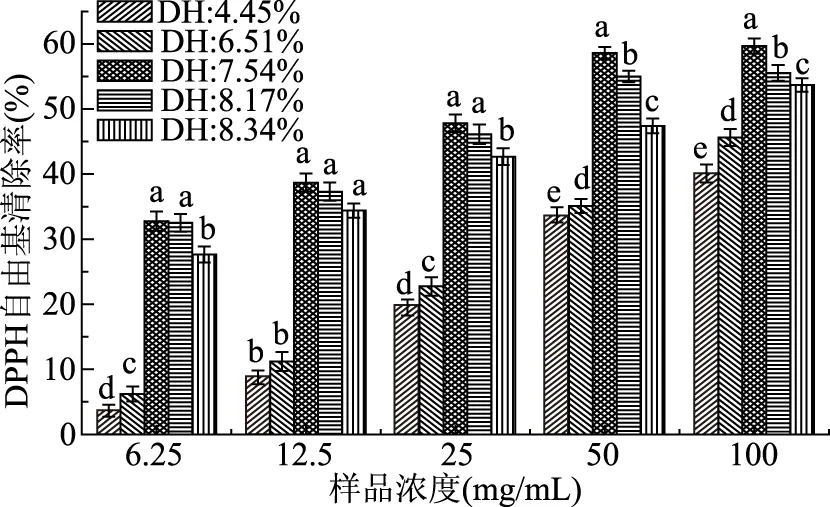
图5 不同DH酶解物对DPPH自由基清除率Fig.5 The DPPH radical scavenging activity of hydrolysates with different DH注:不同小写字母表示不同水解度相同浓度样品间差异显著(p<0.05);图6同。
由图5可知,所有DH的酶解物对DPPH自由基都有清除作用,而且表现出明显的剂量效应。当酶解物浓度仅为6.25 mg/mL时,水解时间60 min的酶解物DH为7.54%,其对DPPH自由基清除率已高达32.761%。浓度为100 mg/mL时,DH为7.54%的水解物对DPPH自由基清除率达到59.68%。在DH低于7.54%时,清除能力随着DH的提高而增强。但当水解继续进行,酶解物对DPPH自由基的清除能力逐渐减弱,这可能是因为酶解物对DPPH自由基的清除能力在于酶解物中某些肽的积累,而当水解继续进行,对自由基有清除能力的肽会被水解而失去清除能力。可见清蛋白酶解物对DPPH自由基的清除率与DH并不是完全线性关系。
2.6 不同水解度酶解物清除羟自由基活性
不同水解度的清蛋白酶解物对羟自由基清除能力如图6所示。
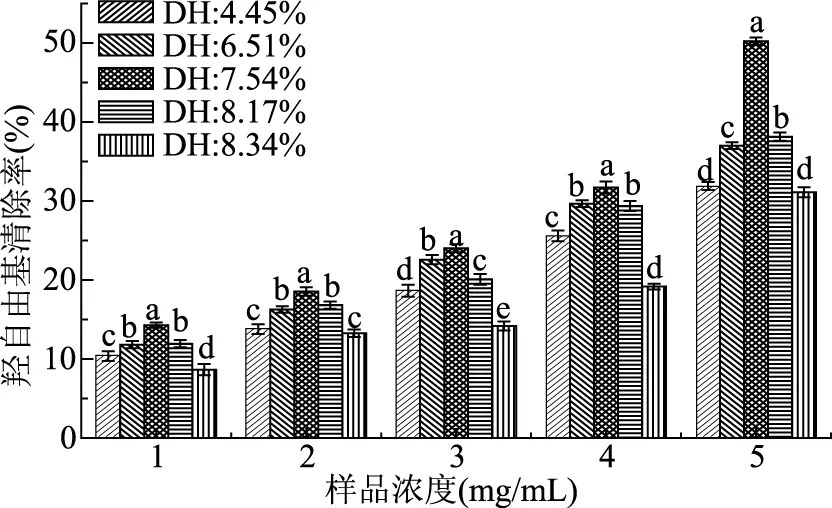
图6 不同DH酶解物对羟自由基清除率Fig.6 The hydroxyl radical scavenging activity of hydrolysates with different DH
所有DH的酶解物对羟自由基都有清除作用,也都表现出明显的剂量效应,浓度越大,清除率越高。低浓度时所有DH的清蛋白酶解物对羟自由基清除率都较低,在20%以下;随着样品浓度增大,不同DH的酶解物对羟自由基清除率也逐渐增大,可达30%以上。浓度为5 mg/mL时,水解时间为60 min的酶解物DH为7.54%,其对羟自由基清除率高达50.23%,远远超过其他DH的酶解物。DH继续增大,清除率随之下降。由图6可看出,不同DH的清蛋白酶解物对羟自由基清除作用和对DPPH自由基作用的变化趋势相似,这说明DH对麦胚清蛋白酶解物的抗氧化力有很大影响。
3 结论
本文通过实验选择了碱性蛋白酶作为麦胚清蛋白的水解酶,研究了水解度对麦胚清蛋白酶解物功能特性和抗氧化力的影响。结果表明,麦胚清蛋白酶解物的溶解度随水解度增加而大幅提高,等电点处尤为明显;乳化性和乳化稳定性随水解度增加而降低。酶解物对DPPH自由基清除活性和对羟自由基清除活性先随着水解度增加而变大,当水解时间超过60 min后,水解度高于7.54%,酶解物对自由基清除率降低。
[1]徐斌,苗文娟,董英,等. 中国小麦胚芽资源分布及深加工相关品质[J]. 农业工程学报,2012,28(2):244-249.
[2]黄永军,周建新,沈新春. 小麦胚在食品工业中的研究进展与前景[J]. 粮食与饲料工业,2016(2):23-26.
[3]王茜,马娇,陶海腾,等. 小麦胚芽营养价值分析及开发利用[J]. 农产品加工:创新版,2013,13(3):13-15.
[4]王成忠,高超,赵乃峰. 复合酶结合碱法制备麦胚多肽的研究[J].食品工业科技,2012,33(14):210-213.
[5]李天文. 麦胚蛋白的分级提取及其理化和功能特性研究[D]. 哈尔滨:黑龙江八一农垦大学,2009.
[6]贾俊强,马海乐,赵伟睿,等. 小麦胚芽蛋白组分酶解物降血压和抗氧化作用[J]. 营养学报,2010,32(1):55-59.
[7]张丽萍,毛晶晶,刁静静,等. 麦胚蛋白水解物抗氧化活性及其作用模式[J]. 中国粮油学报,2012,27(6):14-19.
[8]鞠兴荣,胡蓉,王丹丹. 不同酶水解菜籽蛋白的水解物的抗氧化活性研究[J]. 中国粮油学报,2011,26(4):47-51.
[9]杜云建,赵玉巧,李念念. 酶解法制备草鱼鱼鳞多肽及其清除羟自由基的研究[J]. 食品科学,2010,31(7):168-172.
[10]何东平,刘丽娜,张声华. 花生蛋白水解产物ACE抑制活性的研究[J]. 中国粮油学报,2007,22(3):94-96.
[11]刘丹. 秋刀鱼蛋白抗氧化肽的分离纯化及其抗疲劳功效研究[D]. 广州:华南理工大学,2015.
[12]Klompong V,Benjaqul S,Kantachote D,et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroidesleptolepis)as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry,2007,102(4):1317-1327.
[13]朱科学,周惠明. 麦胚球蛋白的分离制备及功能特性研究[J]. 中国粮油学报,2005,20(6):15-18.
[14]Adler-nissen J. Enzymic Hydrolysis of Food Proteins[M]. New York:Elsevier Applied Science Publishers,1986:132-133.
[15]李秀川,迟玉杰. 大豆分离蛋白溶解性能与水解度相关的研究[J]. 中国粮油学报,2009,24(7):37-40.
[16]贺楠,徐怀德. 魔芋飞粉蛋白质提取及乳化性研究[J]. 食品科学,2013,34(16):120-124.
[17]Chen N,Yang H,Sun Y,et al. Purification and identification of antioxidant peptides from walnut(JuglansregiaL.)protein hydrolysates[J]. Peptides,2012,38(2):344-349.
[18]罗红玉,郁军,岳鹏翔,等. 茶渣多肽制备及其对羟自由基的清除能力[J]. 食品科学,2011(14):61-66.
[19]谢正军,金征宇. 苜蓿叶蛋白抗氧化肽水解用酶的筛选研究[J]. 食品科学,2007,28(7):342-346.
[20]武莹浣. 大豆分离蛋白的碱性蛋白酶酶解条件研究[J]. 中国酿造,2012,31(5):141-143.
[21]Foh M B K,Amadou I,Foh B M,et al. Functionality and antioxidant properties of tilapia(Oreochromisniloticus)as influenced by the degree of hydrolysis[J]. International Journal of Molecular Sciences,2010,11(4):1851-1869.
[22]孙哲浩,黄剑波,赵谋明. 小分子乳化剂对食物蛋白质乳化特性的影响[J]. 食品工业科技,2006,27(5):189-194.
[23]Gbogouri G A,Linder M,Fanni J,et al. Influence of hydrolysis degree on the functional properties of salmon byproducts hydrolysates[J]. Journal of Food Science,2004,69(8):C615-C622.
Effect of degree of hydrolysis on functional characteristics and antioxidant properties of wheat germ albumin hydrolysates
HU Li-li,WANG Bing-zhi,ZHONG Xi-yang,LUO Shui-zhong,JIANG Shao-tong,ZHENG Zhi*
(Key Laboratory for Agriculture Products Processing of Anhui Province,School of Food Science and Engineering,Hefei University of Technology,Hefei 230009,China)
Alkaline protease was used to digest wheat germ albumin restrictively. The effects of DH on the hydrolysates’ functional characteristics and antioxidant activity were studied,including solubility,emulsifying,DPPH radical-scavenging activity and hydroxyl radical-scavenging activity. The results showed that the solubility of the hydrolysate was improved after hydrolysis. The higher the DH,the better the solubility. The solubility at the soelectric point increased from 49.52% to 74.09% when the DH was 0 and 8.34%,respectively. The emulsifying properties decreased with the increase of DH. When the DH was lower than 7.54%,the DPPH radical-scavenging activity and hydroxyl radical-cavenging activity of the hydrolysates increased with the DH. When the DH was 7.54% and the concentration was 100 mg/mL,the DPPH radical-scavenging rate was 59.68%. When the DH was 7.54% and the concentration was 5 mg/mL,the hydroxyl radical-cavenging rate was 50.23%.
wheat germ albumin;degree of hydrolysis;hydrolysates;functional characteristics;antioxidant activity
2016-10-14
胡莉丽(1992-),女,硕士研究生,研究方向:食品资源综合利用,E-mail: hulily_y@163.com。
*通讯作者:郑志(1971-),男,博士,教授,研究方向:农产品加工及贮藏工程,E-mail:zhengzhi@hfut.edu.cn。
国家高技术研究发展计划(863计划)课题(2013AA102201);安徽省科技重大专项项目(16030701082);安徽省科技攻关项目(1301031031、15czz03096)。
TS210.1
A
1002-0306(2017)08-0072-05
10.13386/j.issn1002-0306.2017.08.006
