调节性T细胞在小鼠抗肾小球基底膜型肾小球肾炎模型中的免疫调节机制研究
2017-05-12周焕张新何泳彭清平王晓慧
周焕 张新 何泳 彭清平 王晓慧
·实验研究·
调节性T细胞在小鼠抗肾小球基底膜型肾小球肾炎模型中的免疫调节机制研究
周焕 张新 何泳 彭清平 王晓慧
目的 探讨在小鼠抗肾小球基底膜型肾小球肾炎(抗GBM肾炎)模型的肾炎进展中调节性T细胞(regulatory T cell, Treg)免疫调节机制,为早期干预免疫反应,减轻病理损害提供理论依据。方法 将C57BL/6小鼠随机分为2组即正常对照组和抗GBM肾炎模型组。在建模不同时间点即建模的第7、14、21、28天将小鼠处死后收集并检测血清中的肌酐 (serum creatinine, SCr)、尿素氮 (blood urea nitrogen, BUN) 及尿蛋白含量,随机尿中尿蛋白/肌酐比值(albumin-to-creatinine ratio, ACR)变化;留取肾脏标本检测病理改变。流式细胞术(fluorescence-activated cell sorting,FACS)检测脾脏中Treg细胞表达情况;免疫印迹法 (Western blot) 检测肾脏组织中DNA结合抑制因子3(Id3)和Foxp3等蛋白表达情况。结果 与正常对照组小鼠相比,抗GBM肾炎模型组小鼠肾脏病理示GBM不规则弥漫增厚甚至部分断裂、系膜细胞和基质增生、新月体形成;免疫荧光示鼠IgG和兔IgG在基底膜呈线性沉积;SCr、BUN、尿蛋白和ACR增加明显(P<0.05);抗GBM肾炎模型组中细胞和蛋白水平检测到的相关因子均呈规律性表达:与正常对照组相比,随着病情进展抗GBM肾炎模型组中Th17细胞的表达比例呈现先上升后下降的趋势,而与此同时Treg细胞则从第7天开始即出现升高的趋势,差异具有统计学意义(P<0.05或P<0.01);抗GBM肾炎模型组小鼠肾脏组织中Foxp3及Id3的蛋白表达均较正常对照组明显增加,差异均具有统计学意义(P<0.05或P<0.01);Id3的蛋白表达与Treg细胞特异性转录因子水平相关。结论 在抗GBM肾炎的免疫进程中,Treg发挥重要作用,这种作用可能与转录调节因子Id3有关。
调节性T细胞;抗肾小球基底膜型肾小球肾炎;DNA结合抑制因子3
抗肾小球基底膜型肾小球肾炎(抗GBM肾炎)是急进性肾小球肾炎中病情进展迅速、治疗预后最差的一种自身免疫性疾病[1-2],因此对于抗GBM肾炎早期的免疫细胞研究,将有助于全面了解其发病机制,为早期干预其免疫反应,阻断病理进程提供依据。T细胞的免疫应答是抗GBM肾炎进展过程中最重要的一个环节[3]。未分化的CD4+T 细胞能够分化发育为不同的细胞亚型如 Th1 细胞、Th2 细胞、Th17 细胞和调节性T细胞(regulatory T cell, Treg)等,这些细胞均以不同的方式参与介导多种疾病免疫应答反应[4-5]。其中CD4+CD25+FOXP3+的Treg细胞作为一个特殊的T细胞亚群,在疾病免疫应答中起了免疫抑制作用[6]。那么Treg细胞在抗GBM肾炎的病程进展中究竟是如何变化的及在其免疫应答中起了怎样的作用至今仍未有效的定论。DNA结合抑制因子3(Id3)是一种相对分子质量仅为13 000的核蛋白,受到T细胞抗原受体(T cell receptor,TCR)或B细胞抗原受体(B cell receptor,BCR)介导信号的刺激后能在多种细胞的核内广泛表达,从而调节多个细胞的生长和分化。有研究证实在自身免疫性疾病哮喘模型中Id3可在转录水平对Treg细胞的分化进行调控[7-9]。本研究着重探讨小鼠抗GBM肾炎模型的肾炎进展中Treg细胞免疫调节作用及其相关机制。
材料与方法
一、材料与试剂
SPF级健康雄性C57BL/6小鼠,周龄5~8周,体质量15~20 g,由北京华阜康公司提供,饲养于同济医学院动物实验中心;兔抗小鼠 GBM 多克隆血清(南京金斯瑞公司制备);兔IgG、弗氏佐剂、FITC-羊抗兔-IgG、FITC-羊抗鼠-IgG(美国Sigma公司);小鼠血尿肌酐、尿素氮检测试剂盒(美国Biovision公司);流式抗体、红细胞裂解液、固定剂和破膜剂、Foxp3专用固定剂和破膜剂(美国 eBioscience);BCA蛋白检测试剂盒、总蛋白及核蛋白提取试剂盒(中国碧云天公司);LaminA/C核内参抗体(美国Abcam公司);Anti-Id3抗体(美国BD公司);Anti-Foxp3抗体(美国 Abgent 公司)。
二、仪器与设备
组织脱水机、石蜡包埋机、石蜡切片机(德国Leica公司);流式细胞仪(美国BD公司);荧光定量聚合酶链式反应(PCR)仪(德国 Biometra 公司)等。
三、方法
1.提取小鼠GBM抗原及制备兔抗小鼠GBM多克隆血清 取SPF级C57BL/6小鼠40只,颈椎脱臼法处死,取其双侧肾脏,剥除肾包膜,剪取肾脏皮质,于1×酶抑制剂(50×酶抑制剂加1×PBS配制)中研磨。利用筛网法取肾小球并超声粉碎,离心,取沉淀,检测抗原纯度。纯度达标的抗原即为所需的小鼠GBM抗原。然后将上述抗原注射2只新爱尔兰大白兔体内,使其致敏,2周后重复注射,共注射3~5次直至酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 检测血清效价较高后,处死家兔最终获得80 ml的血清,其效价分别为1∶64 000和1∶128 000。该过程由南京金斯瑞公司完成。
2.小鼠抗GBM新月体肾炎模型的建立及检测 SPF级C57BL/6小鼠适应性喂养2周后随机分为2组即正常对照组和抗GBM肾炎模型组(模型组),2组均给予兔IgG和完全弗氏佐剂等体积腹腔注射,于第10天开始模型组每2~3 d腹腔注射兔抗小鼠GBM血清;而正常对照组则给予兔正常血清。分别于建模第7、14、21、28天处死小鼠收集血、尿和新鲜的脾脏、肾脏待检,观察病理损害的进展情况。检测正常对照组及模型组不同时间点尿蛋白含量;利用肌酐、尿素氮检测试剂盒,按照说明书分别检测血中各生化指标的浓度;小鼠肾脏皮质,1/4用包埋剂包埋,切片后,经直接免疫荧光法染色,检测荧光情况。1/4肾皮质用固定剂固定、脱水、包埋、切片后行过 雪夫染色(Periodic Acid-Schiff stain, PAS)染色,观察肾脏的病理改变。
3.免疫印迹法(Western blot) 取少许小鼠肾脏组织,研磨后按照组织核蛋白提取试剂盒说明书提取肾脏组织核蛋白,并按照BCA法蛋白检测试剂盒说明书测定蛋白浓度。取30 μg蛋白样品加入1/4体积的5×蛋白上样缓冲液于EP管中,震荡混匀后瞬时离心,置于100 ℃的水浴箱中变性失活10 min。经过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和转膜后。将LaminA/C核内参抗体;Anti-Id3抗体;Anti-Foxp3抗体,按照说明书稀释到一定比例后与膜蛋白孵育,4 ℃过夜。用封闭液按1∶2 000浓度配制二抗,37 ℃摇床上孵育1 h后进行化学发光法显影,Image J 软件对其条带进行定量分析。以LaminA/C作为核内参抗体,检测Id3和Foxp3的蛋白表达情况。
4.流式细胞术(fluorescence-activated cell sorting,FACS)检测 取小鼠新鲜脾脏组织,分离单个细胞悬液,淋巴细胞分离液获取所需脾脏单细胞悬液。根据Treg细胞流式抗体说明书进行标记,1 h内进行流式检测。
四、统计学处理
所有的实验重复至少3次。采用SPSS 18.0统计软件分析,实验数据以均数±标准差表示,多组实验数据之间比较采用方差(ANOVA)分析,2组数据比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、成功建立小鼠抗GBM肾炎的模型 肾脏光镜病理结果显示,相对于正常对照组,模型组从病变的第7天开始就出现肾脏病理的改变,如基底膜的增厚断裂、系膜细胞和基质的增生及肾小管的扩张,甚至新月体的形成。选取病变第28天这一时间点,肾脏受损程度逐渐加重;免疫荧光显示,病变从免疫后第7天开始模型组小鼠的肾小球内可见鼠IgG沿GBM呈线性沉积,且随着病变的进展荧光强度逐渐增强(图1A);与此同时,亦可见兔IgG沿GBM的线性沉积,且随着病情的进展荧光强度逐渐减弱,系膜区也可见荧光的沉积(图1B)。各组小鼠的生化指标检测结果也显示该模型的建立成功:各阶段的血尿素氮(图2A)、血肌酐(图2B)、尿蛋白(图2C)以及尿蛋白/肌酐比值(图2D)均较正常对照组高,差异有统计学意义(P<0.01)。
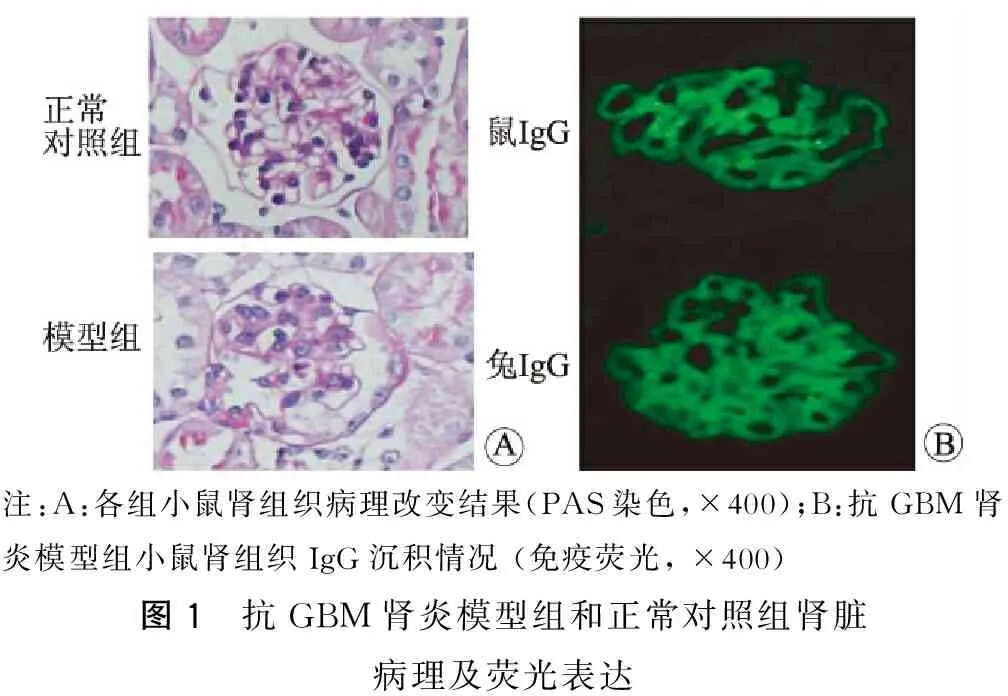
注:A:各组小鼠肾组织病理改变结果(PAS染色,×400);B:抗GBM肾炎模型组小鼠肾组织IgG沉积情况(免疫荧光,×400)图1 抗GBM肾炎模型组和正常对照组肾脏病理及荧光表达
二、Th17和Treg细胞在模型组中的表达水平
与正常对照组相比,随着病情进展抗GBM肾炎模型组中Th17细胞的表达比例呈现先上升后下降的趋势,而与此同时,Treg细胞则从第7天开始即出现升高的趋势,差异均具有统计学意义(P<0.05或P<0.01)(图3A、图3B);但检测外周血中白细胞介素17、转化生长因子β和白细胞介素10的变化趋势却与上述不同(图中未列出)。
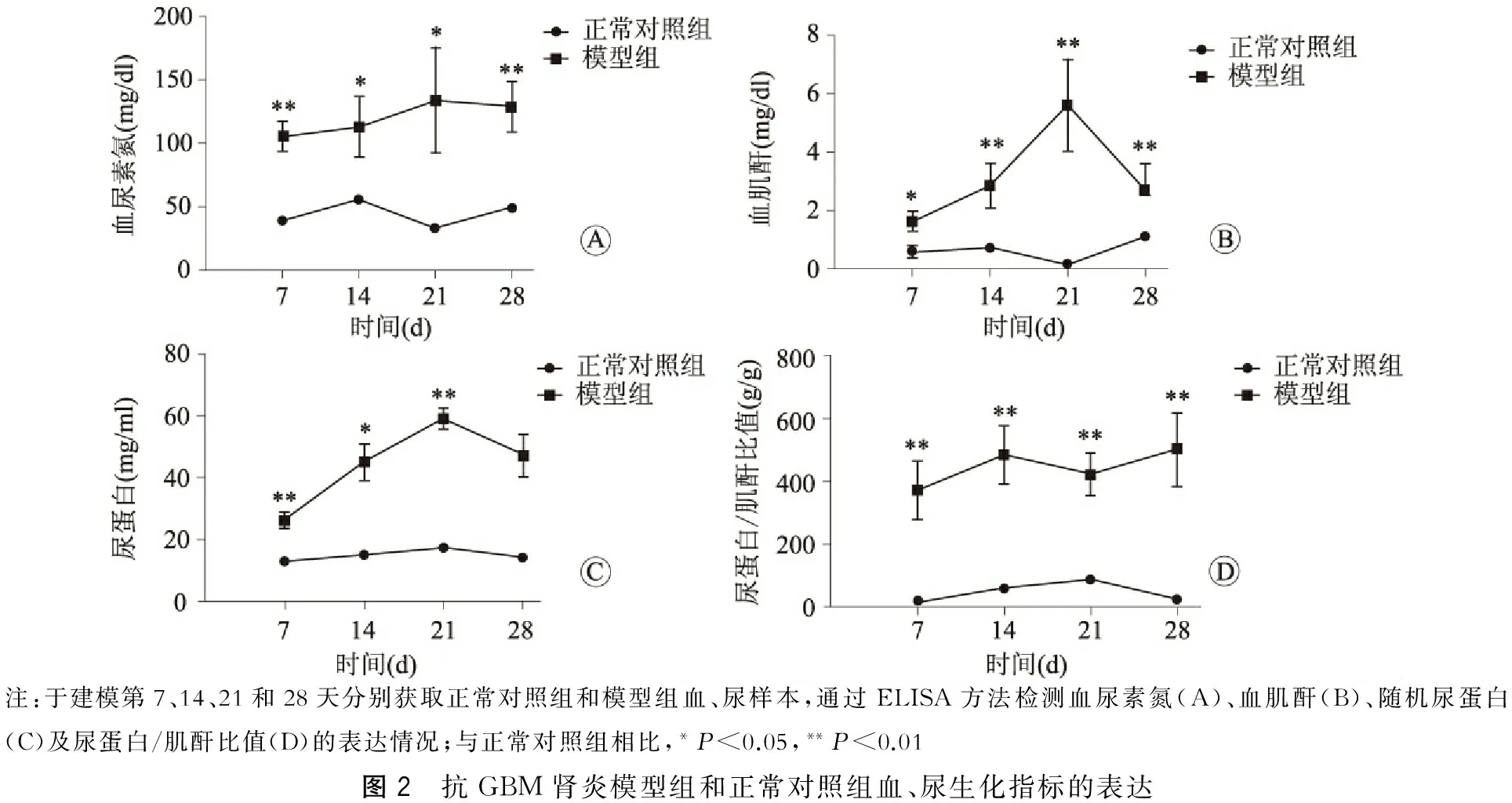
注:于建模第7、14、21和28天分别获取正常对照组和模型组血、尿样本,通过ELISA方法检测血尿素氮(A)、血肌酐(B)、随机尿蛋白(C)及尿蛋白/肌酐比值(D)的表达情况;与正常对照组相比,*P<0.05,**P<0.01图2 抗GBM肾炎模型组和正常对照组血、尿生化指标的表达
三、在模型组肾脏组织中Id3、Foxp3的表达
提取正常对照组和模型组小鼠肾脏组织中的核蛋白,通过Western blot的方法检测Treg细胞转录因子Foxp3及Id3的蛋白表达情况,结果见图4A、图4B。结果显示模型组小鼠肾脏组织中Foxp3及Id3的蛋白表达均较正常对照组明显增加,差异均有统计学意义(P<0.05或P<0.01)。
讨 论
炎症免疫反应是抗GBM肾小球肾炎病理进展和转归的重要环节,本研究从免疫细胞Treg细胞入手进行探讨,我们发现:①在抗GBM 肾炎早期,随着病情的进展,Treg细胞的表达量上调,且表现为时间依赖性的特点;②在抗GBM肾炎模型中Treg细胞特异性转录因子Foxp3水平变化与Id3相关。
关于抗GBM肾炎的认识主要来自实验动物模型。抗GBM肾炎的动物模型的制备有多种方法,比较成熟的有以下三种:实验性自体免疫肾小球肾炎模型、肾毒血清肾炎模型及实验性自体免疫脉管炎模型[10]。在研究中根据不同的研究目的使用不同的实验模型。本实验主要研究在新月体肾炎发病机制中T细胞的免疫作用,故采用肾毒血清肾炎模型[11]。通过采用经典的建模方法[12],无论是从免疫荧光、光镜病理还是尿蛋白、生化指标来看,我们都已成功建立了抗GBM肾炎的动物模型:与正常对照组小鼠相比,抗GBM肾炎模型组小鼠肾脏光镜病理显示GBM不规则弥漫增厚甚至部分断裂、系膜细胞和基质增生、新月体形成;免疫荧光显示鼠IgG和兔IgG在基底膜呈线性沉积;血肌酐、血尿素氮、随机尿蛋白及随机尿中尿蛋白/肌酐比值增加明显。成功的动物模型为我们后续探索新月体肾炎发病机制奠定坚实的基础。
作为一种具有免疫调节作用的T淋巴细胞亚群,Treg细胞在维持自身免疫耐受方面发挥着重要作用[13]。在前言中,我们已经了解到Treg细胞与自身免疫性疾病之间的关系密切。通过输注Treg细胞可以达到减轻病理损害、改善临床症状的目的[14]。在本研究中,我们发现相对于正常对照组而言,抗GBM肾炎模型组的Treg细胞比例增加,至观察的28天为止Treg细胞比例一直处于增加的趋势(图4)。说明在抗GBM肾炎病情进展过程中,抑制炎症反应Treg细胞发挥重要作用。
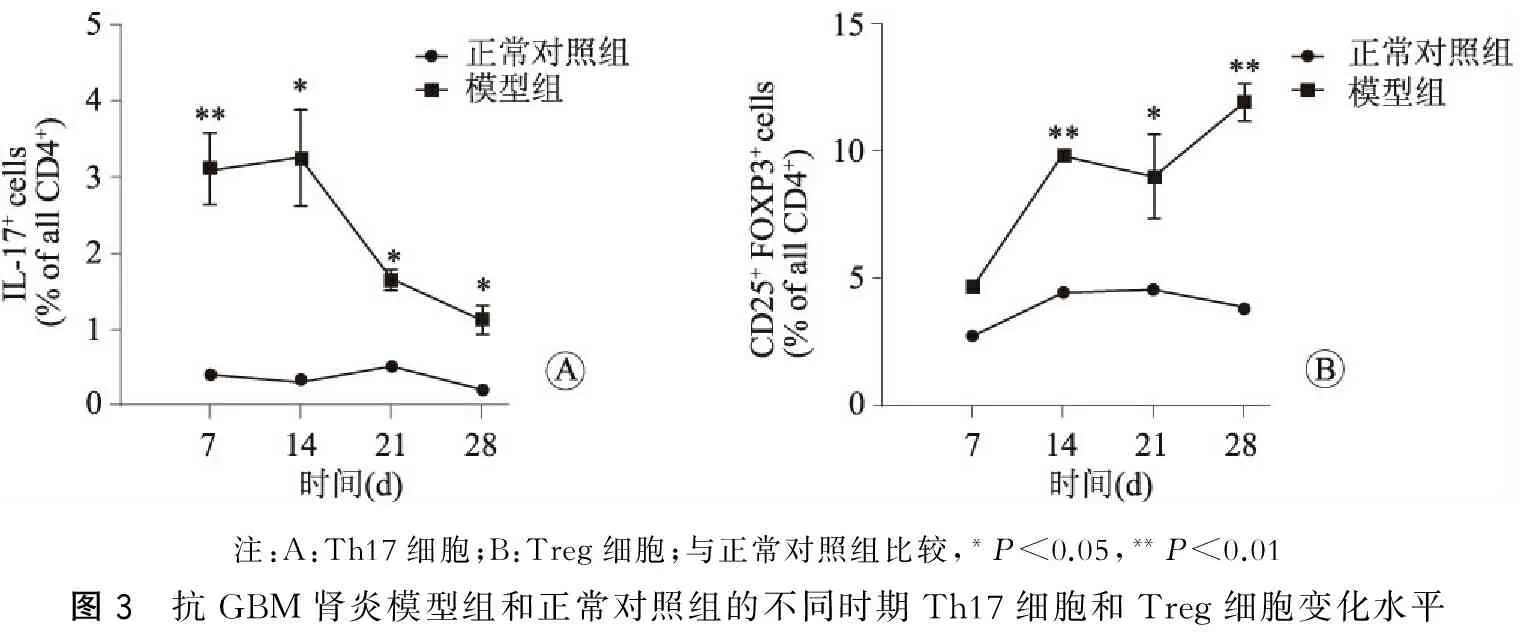
注:A:Th17细胞;B:Treg细胞;与正常对照组比较,*P<0.05,**P<0.01图3 抗GBM肾炎模型组和正常对照组的不同时期Th17细胞和Treg细胞变化水平

注:Ctrl:正常对照组;7d、14d、21d:抗GBM肾炎模型组不同阶段;各组肾脏组织中Id3(图A)和Foxp3(图B)的核蛋白表达情况;与正常对照组比较,*P<0.05,**P<0.01图4 肾脏组织中Id3、Foxp3的表达
既然在自身免疫性疾病病情进展过程中Treg细胞如此重要,那么对其发育和分化调节的研究则首当其冲成为人们研究的重点。目前比较公认的机制有以下几方面:参与淋巴细胞发育的双阴性选择和β选择过程中转录因子Id3/E2A;GATA3和RUNT相关转录因子(RUNX)即遵循Notch信号传导途径;其他转录因子如B细胞淋巴瘤/白血病11b(BCL11b);成髓细胞瘤病毒癌基因同源基因(Myb)等[15]。本研究中我们注意到Id3的调节机制。
Id3蛋白属于螺旋-环-螺旋(HLH)蛋白家族。因其缺乏基础DNA结合域,只能形成非DNA结合型二聚体复合物,与另一种HLH蛋白家族E2a发生竞争抑制,从而影响靶基因的表达[6]。有研究证实在自身免疫性疾病哮喘模型中Id3能在转录水平调节Th17细胞和Treg细胞的分化,且在Id3敲除鼠中,Th17细胞蛋白比例明显升高而Treg细胞显著降低,同时哮喘模型病理损害加重[16-20]。所以在研究自身免疫性疾病新月体肾炎的发病机制时,我们主要研究Id3的调节机制。我们发现在肾脏组织中,抗GBM肾炎病变的早期Id3的表达量就有增加(图4)。由此可以肯定Th17/Treg细胞失衡及其转录因子变化与Id3表达水平的改变相关。当然,在体内环境下,不能排除其他因素影响淋巴细胞水平的变化,若能将相关淋巴细胞分离出来在体外单独研究,将会更有利于对其进行研究,这也是我们下步研究的重点。
我们的研究首次发现了Id3在T细胞介导的新月体型抗GBM 肾炎发病过程中的重要作用,为预防和治疗新月体肾炎提供新的靶点。当然,本研究对于Id3是调控Treg细胞表达仍有许多未研究的方面,如具体的机制和信号通路以及Id3对于其他淋巴细胞的影响等,将在以后的研究中进一步探讨和完善。
[1] Zou J, Hannier S. Healthy individuals have Goodpasture autoantigen-reactive T cells [J]. Am Soc Nephrol, 2008, 19(2): 396-404.
[2] 梁亮, 王红. Th17细胞与自身免疫性疾病[J]. 免疫学杂志, 2010, 26(3): 264-270.
[3] 计子瑶, 李硕, 冯辉. T淋巴细胞在新月体肾小球肾炎发病中作用的研究进展[J]. 2016,32(10): 1419-1422.
[4] Caza T, Landas S. Functional and phenotypic plasticity of CD4+T cell subsets [J]. Biomed Res Int,2015, 2015:521957.
[5] Vieira Braga FA, Hertoghs KM, van Lier RA, et al. Molecular characterization of HCMV-specific immune responses: Parallels between CD8+T cells, CD4+T cells, and NK cells[J].Eur J Immunol, 2015, 45(9): 2433-2445.
[6] Belkaid Y, Piccirillo CA, Mendez S, et al. CD4+CD25+regulatory T cells control Leishmania major persistence and immunity [J]. Nature, 2002, 420(6915): 502-507.
[7] Nutt SL, Kee BL. The transcriptional regulation of B cell lineage commitment. Immunity, 2007, 26(6): 715-725.
[8] Massari ME, Murre C. Helix-loop-helix proteins: regulators of transcription in eucaryotic organisms[J]. Mol Cell Biol, 2000, 20(2): 429-440.
[9] Murre C. Helix-loop-helix proteins and lymphocyte development[J]. Nat Immunol, 2005, 6(11): 1079-1086.
[10]韦凤美, 金玉. 急进性肾小球肾炎动物模型研究进展[J]. 中国实验动物学报, 2010, 18(5): 441-445.
[11]Tipping PG, Holdsworth SR. T cells in crescentic glomerulonephritis[J]. J Am Soc Nephrol, 2006, 17(5): 1253-1263.
[12]Odobasic D, Kitching AR, Semple TJ, et al. Inducible co-stimulatory molecule ligand is protective during the induction and effector phases of crescentic glomerulonephritis[J]. J Am Soc Nephrol, 2006, 17(4): 1044-1053.
[13]Hu D, Miller SC. Evidence of a lineage shift between natural (NK) killer cells and T lymphocytes in the spleen and blood of neonatally thymectomized, young adult C3H mice[J]. Cur Pedia Res, 2014, 18(1): 43-47.
[14]Wolf D, Hochegger K, Wolf AM, et al. CD4+CD25+regulatory T cells inhibit experimental anti-glomerular basement membrane glomerulonephritis in mice[J]. J Am Soc Nephrol, 2005,16(5): 1360-1370.
[15]Naito T, Tanaka H, Naoe Y, et al. Transcriptional control of T-cell development[J]. Int Immunol, 2011, 23(11): 661-668.
[16]Maruyama T, Li J, Vaque JP, et al. Control of the differentiation of regulatory T cells and T(H)17 cells by the DNA-binding inhibitor Id3[J]. Nat Immunol, 2011, 12(1): 86-95.
[17]Jones ME, Zhuang Y. Acquisition of a functional T cell receptor during T lymphocyte development is enforced by HEB and E2A transcription factors[J]. Immunity, 2007, 27(6): 860-870.
[18]Rivera RR, Johns CP, Quan J, et al. Thymocyte selection is regulated by the helix-loop-helix inhibitor protein, Id3[J]. Immunity, 2000, 12(1): 17-26.
[19]Zhou L, Lopes JE, Chong MM, et al. TGF-β-induced Foxp3 inhibits TH17 cell differentiation by antagonizing Rorγt function[J]. Nature, 2008, 453(7192): 236-240.
[20]Bain G, Cravatt CB, Loomans C, et al. Regulation of the helix-loop-helix proteins, E2A and Id3, by the Ras-ERK MAPK cascade[J]. Nat Immunol, 2001, 2(2): 165-171.
Immunoregulation mechanism of Treg cells in anti-GBM glomerulonephritis model of mice
ZHOUHuan,ZHANGXin,HEYong,PENGQing-ping,WANGXiao-hui.
DivisionofNephrology,DepartmentofInternalMedicine,WuhanFifthHospital,Wuhan430050,China
WANGXiao-hui,E-mail: 390638252@qq.com
Objective To explore the immunoregulation mechanism of Treg cells in anti-GBM glomerulonephritis model of mice, and provide theoretical basis for early intervention of immune response and alleviating pathologic damage.Methods C57BL/6 mice were randomly divided into nephritic group and normal control group. The anti-GBM glomerulonephritis model was established in the mice of the nephritic group. At different time points of 7th, 14th, 21st and 28th day, mice were sacrificed. The serum was collected, and creatinine (SCr), blood urea nitrogen (BUN), urine albumin and albumin-to-creatinine ratio (ACR) were tested. Renal pathological changes were observed. Treg cells in the spleen were examined by fluorescence-activated cell sorting (FACS). Western blotting was used to detect the expression of Id3 and Foxp3 protein in the renal tissues.Results The irregular thickening and breakage of GBM, glomerular mesangial cells, matrix proliferation, and crescent formation were observed in nephritic group. Immunofluorescence showed rabbit IgG and mouse IgG linearly deposited along the GBM in nephritic group. SCr, BUN, urine albumin and ACR increased significantly in nephritic group as compared with normal control group (P<0.05). The anti-GBM glomerulonephritis model group of cells, and protein expression levels of relevant indicators show the law:FACS showed Th17 cells declined after increased, while Tregs increased significantly from 7th day (P<0.05 orP<0.01); The protein expression levels of Id3 and the transcription factors Foxp3 in anti-GBM glomerulonephritis group were increased significantly(P<0.05 orP<0.01). The expression levels of Id3 protein were positive correlated with the Tregs′ transcription factors.Conclusions In the immune process of anti-GBM nephritis, Treg plays an important role, which may be related to the transcriptional regulator Id3.
Treg cells; Anti-GBM glomerulonephritis; Id3
10.3969/j.issn.1671-2390.2017.03.009
武汉市卫计委科研项目(WX16C09)
430050 武汉市第五医院肾内科(周焕,张新,何泳,彭清平,王晓慧);作者周焕与张新并列为第一作者
王晓慧,E-mail:390638252@qq.com
2017-02-03
2017-03-07)
