哇巴因诱导人足细胞凋亡的作用机制
2017-05-12娄美玉刘昌璇陈文莉
娄美玉 刘昌璇 陈文莉
·论著·
哇巴因诱导人足细胞凋亡的作用机制
娄美玉 刘昌璇 陈文莉
目的 足细胞凋亡在狼疮肾炎(lupus nephritis,LN)发病过程中有重要作用。内源性哇巴因为强心甾类固醇中的一种,在慢性肾脏病(chronic kidney disease,CKD)患者体内表达上调,在5/6肾切除所模拟的慢性肾衰竭大鼠模型体内可诱导肾间质细胞转分化。本研究主要探讨哇巴因在LN中诱导人足细胞(human podocytecell,HPC)凋亡的作用机制。方法 ①体内实验:选取肾脏肿瘤患者被切除的正常肾组织作为对照组,系统性红斑狼疮疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)评分大于5分的活动性LN患者的肾组织作为研究组,通过免疫组织化学检测肾活检组织中nephrin的表达改变。②体外实验:培养HPC,以不同浓度哇巴因(0 nmol/L,0.1 nmol/L,1 nmol/L,5 nmol/L,10 nmol/L,100 nmol/L)刺激HPC不同时间(24 h、48 h、72 h)后,用MTT法观察并测定哇巴因对HPC增殖凋亡的影响;以不同浓度哇巴因处理HPC 24 h后,采用Hoechst-33258染色检测细胞凋亡;收集各个浓度哇巴因处理的细胞,用蛋白免疫印迹法检测钠钾ATP酶α1(Na+-K+-ATPase α1,NKAα1)、p-Src、nephrin的表达情况。③HPC用Src激酶抑制剂PP2(1 μmol/L)提前1 h预处理,随后加入不同浓度哇巴因孵育24 h,收集蛋白,行蛋白免疫印迹,检测p-Src、nephrin的表达。结果 ①哇巴因以剂量和时间依赖方式诱导HPC凋亡。②正常对照肾组织中nephrin的表达沿肾小球基底膜外侧呈均匀、线状分布,且表达强;LN组肾组织中nephrin在肾小球的分布不均,且表达较正常肾组织明显减弱。③随着哇巴因浓度增加,HPC细胞中NKAα1、p-Src的表达先上调再下降,同时可检测到nephrin蛋白表达逐渐减少。④PP2预处理HPC,阻断哇巴因对Src的活化,使得p-Src表达下调,逆转上述效应,逐渐恢复nephrin的表达,使nephrin表达增加。结论 哇巴因通过NKAα1/Src下调nephrin蛋白的表达参与HPC凋亡。
哇巴因;足细胞;凋亡;狼疮肾炎;钠钾ATP酶
狼疮肾炎(lupus nephritis,LN)是系统性红斑狼疮的常见及严重的并发症之一。足细胞损伤与足细胞源性的蛋白尿相关,在LN发病过程中有重要作用[1],甚至有学者提出足细胞的靶向治疗可能是LN治疗的新途径[2]。nephrin的合成或分布异常是肾小球疾病蛋白尿形成机制中关键的因素之一。强心甾类固醇(cardiotonicsteroids,CTS)可以抑制钠钾ATP酶(Na+-K+-ATPase,NKA)的活性,在泵功能上影响细胞的浓度梯度的分布。近来发现CTS可以通过与NKA结合后,激活信号转导通路(如NKA/Src复合体等),进而调节细胞生长、分化、凋亡和纤维化,在心血管疾病、肾脏疾病中发挥作用。内源性哇巴因为CTS中的一种,本研究主要探讨LN中哇巴因诱导人足细胞(human podocyte cell, HPC)凋亡中的作用机制,为治疗LN患者足细胞源性的蛋白尿提供新的可能靶点。
材料与方法
一、实验材料
本实验所用的细胞系为条件永生性的HPC,来源于美国纽约Mount Sinai医学院Peter Mundel教授惠赠。
正常肾脏组织来源于肾肿瘤切除中的正常组织(光学显微镜及免疫荧光均提示正常)。LN患者的肾组织来源于肾穿刺活检病理确诊为LN患者的肾活检,肾穿刺活检前均未使用过激素或免疫抑制剂类药物,且系统性红斑狼疮疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)评分大于5分的活动性LN患者。系统性红斑狼疮的诊断标准参照2009年美国风湿病学会(ACR)新修订的SLICC-SLE诊断标准。本研究通过武汉市中心医院伦理委员会批准,所有研究受试对象均签署知情同意书。
二、方法
1.免疫组织化学检测LN患者肾活检组织中nephrin的表达及分布 以肾脏肿瘤患者被切除正常肾脏组织为正常对照,肾穿刺活检病理确诊为LN患者的肾组织为LN组,采用二步法免疫组织化学检测nephrin表达及分布情况(检测试剂盒,北京中杉金桥)。其中,一抗工作浓度为1∶50兔抗人nephrin(英国abcam公司)。实验步骤和试剂剂量严格按照试剂操作说明书进行。
2.细胞培养与分组
(1)细胞培养:未分化足细胞用含10 U/ml γ干扰素的培养基在5% CO2、33 ℃培养孵育箱传代培养,待达70%融合时,换用37℃培养基(不含γ干扰素),转入37 ℃、5% CO2培养孵箱分化培养10~14 d,刺激前改用1%血清培养基同步化12 h。
(2)实验分组:①不同浓度哇巴因[0 nmol/L(对照),0.1 nmol/L,1 nmol/L,5 nmol/L,10 nmol/L,100 nmol/L]刺激不同时间(24 h、48 h、72 h);②对照组、0.1 nmol/L哇巴因组刺激24 h;③0 nmol/L哇巴因(对照组)、0.1 nmol/L哇巴因组、10 nmol/L哇巴因组、1 μmol/L PP2(Src激酶抑制剂的一种)组、1 μmol/L PP2+0.1 nmol/L哇巴因组、1 μmol/L PP2+10 nmol/L哇巴因组。
3.MTT法检测HPC的增殖和凋亡 37 ℃体外培养的HPC,将细胞重悬成单个细胞悬液并计数,接种到3个96孔板,次日血清饥饿同步化后加入不同浓度的哇巴因(0 nmol/L,0.1 nmol/L,1 nmol/L,5 nmol/L,10 nmol/L,100 nmol/L),分别培养24 h、48 h、72 h,培养终止前4 h每孔加入20 μl 5 mg/ml的MTT,吸去孔内培养液后,再加入150 μl DMSO酶标仪490 nm检测吸光度值(A值)。
4.Hoechst33258检测细胞凋亡 取泡酸高压后的洁净干燥盖玻片,将盖玻片置入6孔板内,种入HPC细胞培养,次日血清饥饿同步化后分为对照组和哇巴因组(10 nmol/L),培养达24 h,吸尽培养液,加入1 ml固定液固定后,采用Hoechst 33258检测细胞凋亡,实验步骤和试剂剂量严格按照试剂操作说明书进行。采用倒置荧光显微镜观察细胞核染色情况。
5.蛋白免疫印迹法检测NKA、p-Src、nephrin蛋白的表达 HPC用Src激酶抑制剂PP2(1 μmol/L)提前1 h预处理,随后加入0.1 nmol/L或10 nmol/L哇巴因孵育24 h,收集各组细胞提取总蛋白,BCA法测定蛋白浓度。制备10% SDS-PAGE胶,20 μg/孔上样,恒压电泳后恒流转膜,5%脱脂奶粉TBST溶液室温封闭1 h。分别用抗NKAα1抗体1∶5 000(德国Milipore公司),抗p-Src抗体1∶2 000(英国abcam公司),抗nephrin抗体1∶400(英国abcam公司),4 ℃孵育过夜,次日用1‰ TBST溶液洗膜,HRP标记的二抗1∶5 000(美国Dako公司),室温孵育1 h,TBST洗膜,ECL发光试剂盒(美国GE公司)显影。应用GAPDH(德国Milipore公司)作为内参照,稀释浓度为1∶5 000。Quatity one软件分析蛋白条带的灰度值。
三、统计学处理
应用GraphPad Prism 5统计软件进行分析,符合正态分布的计量资料用均数±标准差表示,2组间比较用两样本t检验,多组间两两比较用方差分析(one-way ANOVA)中SNK检验,P<0.05为差异有统计学意义。
结 果
一、正常肾组织与LN肾组织nephrin的表达
采用免疫组织化学法检测nephrin表达及分布情况,并在显微镜下观察、拍照,可观察到肾组织中nephrin免疫组织化学染色阳性呈棕黄色,正常对照肾组织中nephrin的表达沿肾小球基底膜外侧呈均匀、线状分布,且染色深,LN组肾组织中nephrin在肾小球的分布不均,甚至出现线性消失,且染色较正常肾组织明显减弱(图1)。
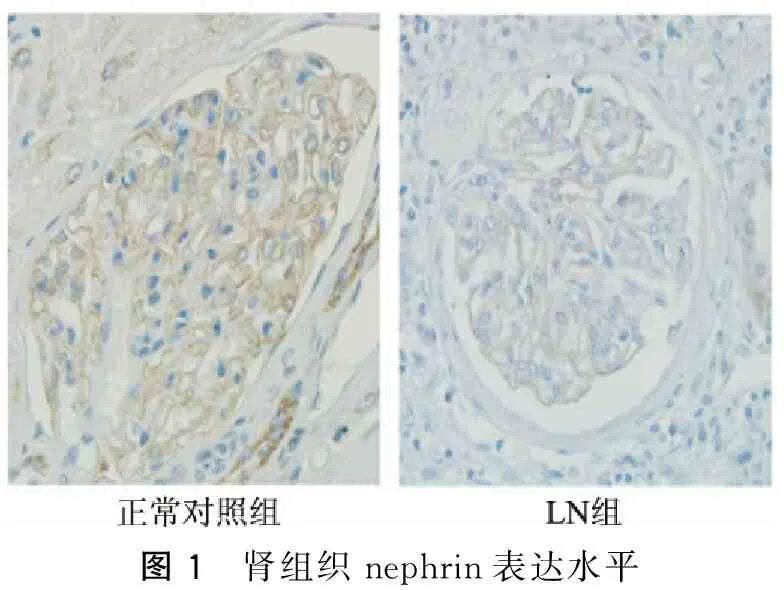
图1 肾组织nephrin表达水平
二、哇巴因可诱导HPC凋亡
HPC用不同浓度的哇巴因(0 nmol/L,0.1 nmol/L,1 nmol/L,5 nmol/L,10 nmol/L,100 nmol/L)孵育24 h、48 h及72 h后,用MTT法检测细胞的增殖和凋亡。可观察到随着哇巴因浓度的增加,细胞受到抑制亦逐渐明显,并且随着时间延长,抑制愈明显。由图2和表1可见,与对照组相比,除了0.1 nmol/L哇巴因刺激HPC 24 h后差异无统计学意义外,哇巴因各浓度组作用24、48、72 h后,A值显著下降,差异均有统计学意义(P<0.05)。
HPC分为对照组和哇巴因组(10 nmol/L),培养达24 h,Hoechst 33258染色后,在荧光显微镜下,正常细胞的细胞核呈正常的蓝色,而10 nmol/L哇巴因组的细胞中有核固缩现象发生。(图3)

注:与对照组(0nmol/L哇巴因)比较,aP<0.05,bP<0.01,cP<0.001图2 不同浓度哇巴因不同作用时间对HPC增殖、凋亡的影响
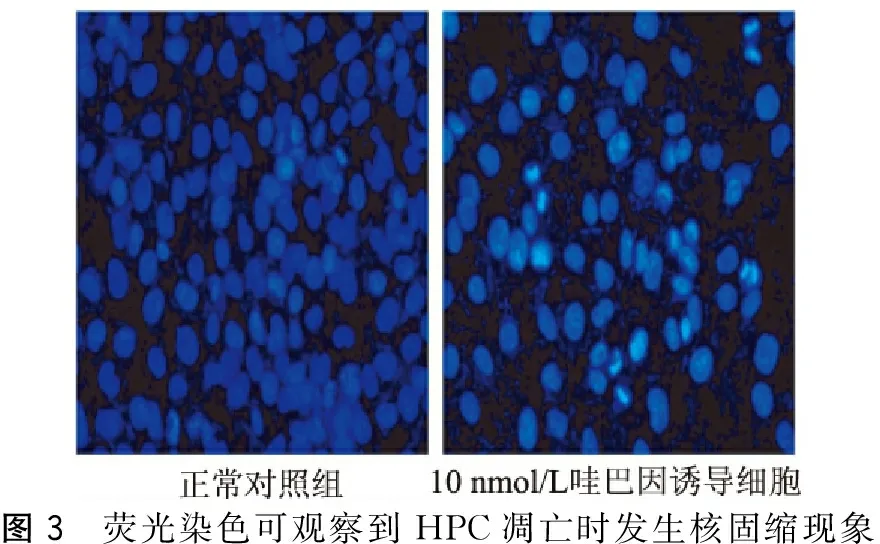
图3 荧光染色可观察到HPC凋亡时发生核固缩现象
表1 不同浓度的哇巴因不同培养时间对HPC增殖和凋亡作用
注:与对照组(0 nmol/L哇巴因)比较,aP<0.05,bP<0.01,cP<0.001
三、哇巴因活化NKAα1/Src诱导nephrin的表达下调
不同浓度(0 nmol/L,0.1 nmol/L,1 nmol/L,10 nmol/L,100 nmol/L)哇巴因刺激HPC 24 h后,收集各个浓度的细胞,采用蛋白免疫印迹法检测NKAα1、p-Src、nephrin的表达情况。可观察到哇巴因不同浓度诱导HPC中NKAα1、p-Src的表达先上调再下降,同时可观察到nephrin蛋白表达逐渐减少。(图4)
四、PP2阻断Src活化、抑制nephrin的表达下调
采用蛋白免疫印迹检测p-Src、nephrin蛋白表达,可观察到PP2提前干预HPC后,p-Src蛋白表达下调,并可逆转哇巴因诱导的nephrin蛋白表达下调,增加nephrin表达量。(图5)
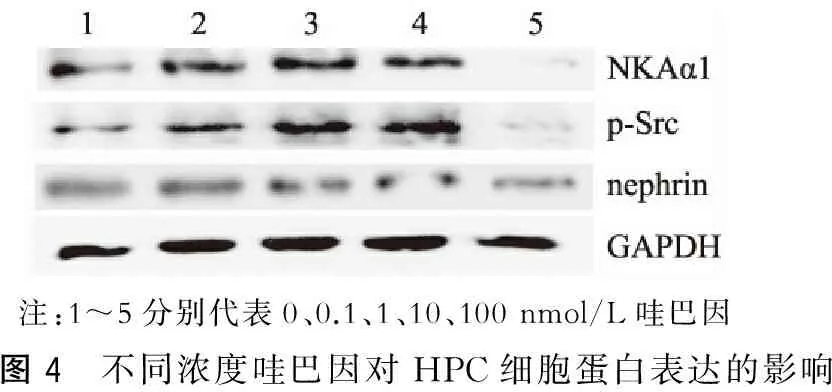
注:1~5分别代表0、0.1、1、10、100nmol/L哇巴因图4 不同浓度哇巴因对HPC细胞蛋白表达的影响

注:1为对照组(0nmol/L哇巴因);2为0.1nmol/L哇巴因组;3为10nmol/L哇巴因组;4为1μmol/LPP2组;5为1μmol/LPP2+0.1nmol/L哇巴因组;6为1μmol/LPP2+10nmol/L哇巴因组图5 Src激酶抑制剂PP2对HPC蛋白表达的影响
讨 论
CTS又称洋地黄类物质,包括植物来源的地高辛、哇巴因和动物来源的布法林(Bufalin)、海蟾蜍毒素(marinobufagenin,MBG)等两大类,近年来发现人体内亦存在该类物质(如哇巴因、MBG等),称为内源性CTS。CTS存在于心、肝、肾、脑等组织及血浆、尿液与脑脊液中,在体内主要由肾上腺、下丘脑及胎盘等产生和分泌,其产生和分泌受到多种生理和病理因素的调节,比如盐摄入增加、妊娠,血管紧张素Ⅱ、促肾上腺皮质激素刺激等。CTS在血浆中主要以游离形式和与蛋白质结合形式存在,游离状态CTS在体内具有生物学活性,主要通过与NKA特异性结合,抑制NKA活性,即在泵功能上影响细胞的浓度梯度分布[3]。NKA是一种广泛存在于真核细胞膜上的膜结合蛋白,主要由四个α亚基(α1、α2、α3、α4)、3个β亚基(β1、β2、β3)和γ亚基组成,每个亚基发挥着不同的生理作用,α亚基是催化酶反应的亚基,在组织中特异表达,其中,α1亚基是占据主导地位的,几乎在高等动物所有细胞都有表达,β亚基的主要功能是在细胞质膜上稳定α亚基的蛋白构型以及调节α亚基的活性,γ亚基对已结合的αβ二聚体发挥调节作用。近来发现NKA除了其经典的泵功能,即参与Na+和K+的跨膜转运外,还具有信号转导功能[4],其信号转导功能主要由α亚基尤其是α1亚基参与。Src家族激酶是膜相关的非受体酪氨酸蛋白激酶,在NKA和Src结合的复合物中NKA的α亚基与CTS结合后,Src的激酶结构域被释放出,Src得以活化,进而激活下游信号级联。在这个过程中,可以把NKA/Src复合物看作一种“二元”受体,受到CTS作用后间接地影响下游蛋白的磷酸化过程,从而介导信号转导[5],参与心脏及肾脏相关疾病的发病过程。
CTS对细胞生长具有重要的调节作用,研究显示CTS在调节细胞生长、分化、凋亡及纤维化中具有重要作用。目前已有研究证实CTS与NKA结合后可激活一系列下游信号通路,从而选择性抑制肿瘤细胞增殖或促进肿瘤细胞凋亡[6-7],而正常细胞不受影响,因此具有抗肿瘤活性。在多种血管平滑肌细胞系、猪肾小管上皮细胞-LLC-PK1细胞系等,CTS可刺激细胞增殖[6,8]。因此,CTS对不同细胞的生长具有特异性,既可以调节细胞的增殖,也可以诱导细胞的凋亡,且这些效应是由于细胞表达钠钾ATP酶α1(Na+-K+-ATPase α1,NKAα1)亚基的量不同所造成的[6-7]。哇巴因对细胞生长的调节除了具有上述的特异性,对同种细胞还具有双重效应,在低浓度时促进细胞增殖,在较高浓度则促进细胞凋亡,并且在人成纤维细胞、人脐静脉内皮细胞等细胞上均得到证实[9-10]。诸多研究显示CTS在诸多疾病及动物模型中升高,如透析患者及部分肾切除所模拟的慢性肾衰竭模型等[11-12]。我们前期研究[13]证实MBG在尿毒症心肌病变中表达上调,NKAα1亚基的量决定细胞存活和凋亡的方向,更进一步证实了上述研究结果。有研究[14-15]发现MBG能诱导心肾纤维化,抗MBG抗体可减弱纤维化发生。内源性哇巴因在慢性肾脏病(chronic kidney disease,CKD)患者体内表达上调[16],MBG可诱导猪肾小管上皮细胞发生间质细胞转分化(epithelial-to-mesenchymaltransition,EMT),在大鼠体内可诱导肾纤维化[17]。近年研究发现心脏手术前哇巴因高水平患者易发生亚临床肾损害,并极有可能因麻醉或手术而加重,增加心脏手术后急性肾损伤(acute kidney injury,AKI)的发生率,因而术前循环哇巴因水平可强烈预测AKI的发生或作为AKI临床风险评分因子,哇巴因可能直接引起肾损伤[18]。研究还发现,术前和术后哇巴因可作为心力衰竭的标志物,甚至可预测术后发生心血管事件风险,不仅具有诊断性意义,还为心力衰竭的治疗提供了方向[19]。另外,研究还发现哇巴因的持续升高,可降低肌酐清除率,增加尿蛋白排泄,减少选择性足细胞标记蛋白nephrin的表达,引起足细胞损害和蛋白尿[18],关于哇巴因如何调节LN中足细胞nephrin蛋白的表达机制尚不明确。
LN是系统性红斑狼疮累及肾脏的常见及严重的并发症之一,虽然糖皮质激素联合细胞毒药物已广泛应用于治疗中,并被公认为是经典的治疗方案,但持续使用免疫抑制剂带来的不良后果一直是治疗中难以避免的问题。因此,针对LN的发病机制寻找具有多靶点作用、疗效机制明确的新型药物,从而减少对免疫抑制剂的依赖,一直是国内外肾脏病学者最为关注的热点问题。
现有的研究表明,LN的发病机制中除了免疫调节的紊乱外,其肾脏局部细胞的功能失调也是造成疾病进展的重要原因之一,细胞凋亡的异常与LN的发病密切相关已有相关报道[20]。足细胞是肾小球固有细胞的重要组成部分,和内皮细胞、肾小球基底膜共同组成肾小球滤过屏障。足细胞损伤在LN发病过程中有重要作用,可引起足细胞源性的蛋白尿的发生[1]。nephrin蛋白是足细胞裂隙膜关键分子之一,参与构成肾小球滤过屏障,已有研究显示nephrin分子与蛋白尿及滤过屏障密切相关[21-22],nephrin的合成或分布异常是肾小球疾病蛋白尿形成机制中关键的因素之一。在不同肾脏疾病中,nephrin蛋白分布均有异常,除了在阿霉素肾病模型中有报道nephrin蛋白表达是上升的,在常见肾病及模型中表达下降,关于nephrin在LN肾组织中的表达结果不一。Huh等[23]报道显示LN患者肾活检组织中nephrin表达减少。nephrin可通过Src家族激酶起到信号转导作用,NKA在肾脏除了富集于近端肾小管上皮细胞、集合小管细胞外,在足细胞亦表达NKA。目前关于哇巴因在LN中对人足细胞及nephrin表达的作用尚不清楚。基于以上的研究基础,我们设计了此课题,在本结果中采用免疫组织化学法检测到nephrin在正常对照肾组织中沿肾小球基底膜外侧呈均匀、线状分布,在LN肾组织中分布不均,甚至出现线性消失,且LN肾活检组织中nephrin表达较正常对照组明显减弱,这与Huh等[23]的报道是一致的;体外实验研究发现哇巴因可以诱导HPC凋亡,不同浓度的哇巴因刺激HPC不同时间后可观察到哇巴因以时间和剂量依赖的形式诱导足细胞凋亡发生,其中,10 nmol/L哇巴因刺激HPC 24 h后可以观察到细胞中有核固缩现象发生,意味着HPC发生凋亡;蛋白免疫印迹法可以检测到随着哇巴因浓度的增加,NKA α1、p-Src的表达先增加后减少,同时我们也检测到了nephrin的表达逐渐减少,采用Src家族激酶抑制剂PP2预处理HPC,阻断哇巴因对Src的活化,可逆转上述效应,逐渐恢复nephrin的表达,使nephrin表达增加。我们的研究证实了哇巴因可以通过NKA/Src信号通路下调nephrin表达,诱导LN患者足细胞凋亡,参与LN发病,可能是LN发生足细胞源性的蛋白尿的原因之一。
本研究集中在体外实验对部分机制的探讨,虽涉及组织标本,但是仍缺乏狼疮动物模型对该机制的进一步证实,不过这也是我们接下来需要深入研究的部分。另外,该研究对LN中哇巴因诱导的足细胞凋亡的机制探讨尚不完全,需要进一步深入研究,为LN的治疗提供更多的治疗靶点。产生蛋白尿机制的研究表明nephrin表达减少会造成足细胞凋亡、脱落和融合,采取有效的措施保护足细胞,阻断nephrin的减少,将为治疗LN患者足细胞源性的蛋白尿提供新的可能靶点,有助于延缓LN患者病情进展。
[1] Rezende GM, Viana VS, Malheiros DM, et al. Podocyte injury in pure membranous and proliferative lupus nephritis: distinct underlying mechanisms of proteinuria?[J]. Lupus, 2014, 23(3): 255-262.
[2] Gutierrez S, Petiti JP, De Paul AL, et al. Lupus-related podocytopathy. Could it be a new entity within the spectrum of lupus nephritis?[J]. Nefrologia, 2012, 32(2): 245-246.
[3] Wang HY, O’doherty GA. Modulators of Na/K-ATPase: a patent review[J]. Expert Opin Ther Pat, 2012, 22(6): 587-605.
[4] Lingre JB. The physiological significance of the cardiotonic steroid/ouabain-binding site of the Na,K-ATPase[J]. Annu Rev Physiol, 2010, 72:395-412.
[5] Tian J, Cai T, Yuan Z, et al. Binding of Src to Na+/K+-ATPase forms a functional signaling complex[J]. Mol Biol Cell, 2006, 17(1): 317-326.
[6] Tian J, Li X, Liang M, et al. Changes in sodium pump expression dictate the effects of ouabain on cell growth[J]. J Biol Chem, 2009, 284(22): 14921-14929.
[7] Chen Y, Li M, Li Z, et al. Bufalin induces apoptosis in the U2OS human osteosarcoma cell line via triggering the mitochondrial pathway[J]. Mol Med Rep, 2016, 13(1): 817-822.
[8] Allen JC, Abramowitz J, Koksoy A. Low concentrations of ouabain activate vascular smooth muscle cell proliferation[J]. Ann N Y Acad Sci, 2003, 986: 504-508.
[9] Ren YP, Zhang MJ, Zhang T, et al. Dual effects of ouabain on the regulation of proliferation and apoptosis in human umbilical vein endothelial cells: involvement of Na+-K+-ATPase alpha-subunits and NF-kappaB[J]. Int J Clin Exp Med, 2014, 7(5): 1214-1222.
[10]Winnicka K, Bielawski K, Bielawska A, et al. Dual effects of ouabain, digoxin and proscillaridin A on the regulation of apoptosis in human fibroblasts[J]. Nat Prod Res, 2010, 24(3): 274-285.
[11]Tian J, Shidyak A, Periyasamy SM, et al. Spironolactone attenuates experimental uremic cardiomyopathy by antagonizing marinobufagenin[J]. Hypertension, 2009, 54(6): 1313-1320.
[12]Kolmakova EV, Haller ST, KennedyDJ, et al. Endogenous cardiotonic steroids in chronic renal failure [J]. Nephrol Dial Transplant, 2011, 26(9): 2912-2919.
[13]LiuC, Bai Y, Chen Y, et al. Reduction of Na/K-ATPase potentiates marinobufagenin-induced cardiac dysfunction and myocyte apoptosis[J]. J Biol Chem, 2012, 287(20): 16390-16398.
[14]Haller ST, Drummond CA, Yan Y, et al. Passive immunization against marinobufagenin attenuates renal fibrosis and improves renal function in experimental renal disease[J]. Am J Hypertens, 2014, 27(4): 603-609.
[15]Haller ST, Kennedy DJ, Shidyak A, et al. Monoclonal antibody against marinobufagenin reverses cardiac fibrosis in rats with chronic renal failure [J]. Am J Hypertens, 2012, 25(6): 690-696.
[16]Stella P, Manunta P, Mallamaci F, et al. Endogenous ouabain and cardiomyopathy in dialysis patients[J]. J Intern Med, 2008, 263(3): 274-280.
[17]Fedorova LV, Raju V, El-okdi N, et al. The cardiotonic steroid hormone marinobufagenin induces renal fibrosis: implication of epithelial-to-mesenchymal transition[J]. Am J Physiol Renal Physiol, 2009, 296(4): F922-F934.
[18]Bignami E, Casamassima N, Frati E, et al. Preoperative endogenous ouabain predicts acute kidney injury in cardiac surgery patients [J]. Crit Care Med, 2013, 41(3): 744-755.
[19]Simonini M, Pozzoli S, Bignami E, et al. Endogenous Ouabain: An Old Cardiotonic Steroid as a New Biomarker of Heart Failure and a Predictor of Mortality after Cardiac Surgery[J]. Biomed Res Int, 2015, 2015:714793.
[20]Makino H, Sugiyama H, Yamasaki Y, et al. Glomerular cell apoptosis in human lupus nephritis[J]. Virchows Arch, 2003, 443(1): 67-77.
[21]Shankland SJ. The podocyte's response to injury: role in proteinuria and glomerulosclerosis[J]. Kidney Int, 2006, 69(12): 2131-2147.
[22]Rajj L, Tian R, Wong JS, et al. Podocyte injury: the role of proteinuria, urinary plasminogen, and oxidative stress[J]. Am J Physiol Renal Physiol, 2016, 311(6): F1308-F1317.
[23]Huh W, Kim DJ, Kim MK, et al. Expression of nephrin in acquired human glomerular disease[J]. Nephrol Dial Transplant, 2002, 17(3): 478-484.
Molecular mechanism of ouabain-induced apoptosis in human podocytes
LOUMei-yu,LIUChang-xuan,CHENWen-li.
DepartmentofNephrology,WuhanCentralHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430014,China
CHENWen-li,E-mail:whwenli@163.com
Objective Podocyte apoptosis is involved in lupus nephritis (LN). Endogenous ouabain (EO), one of cardiotonicsteroids (CTS), is markedly up-regulated in chronic kidney disease (CKD) patients and is associated with epithelial-to-mesenchymal transition during renal fibrosis in the remnant kidney of 5/6 nephrectomy rats. This study is to explore the molecular mechanism of ouabain-induced apoptosis of human podocytes in LN.Methods (1) In the in vivo experiment, the expression of nephrin protein was detected by immunohistochemistry in renal biopsy specimens from patients with active LN whose SLEDAI scores were more than 5 and those as control group from normal renal tissues in patients with renal tumor after resection of the tumor tissues. (2) In the in vitro experiment, cultured podocytes were treated with different doses of ouabain (0, 0.1, 1, 5, 10 and 100 nmol/L) for different durations (24, 48 and 72 h). The MTT method was applied to assay cell proliferation and apoptosis. The apoptosis of podocytes was assessed by Hoechst 33258 staining. Western blotting was used to measure Na+-K+-ATPase α1 (NKAα1), p-Src and nephrin. The PP2 (1 μmol/L) was administered from 1 h before the addition of ouabain and continued throughout the 24 h. Western blotting was then employed to examine the expression of proteins above.Results (1) Ouabain induced human podocyte apoptosis in a dose- and time-dependent manner; (2) Nephrin staining showed an even pattern and the expression of nephrin decreased in LN as compared with controls whose nephrin showed an even and linear pattern; (3) Ouabain reduced the expression of nephrin through changing the expression of NKAα1 and p-Src; (4) Inhibition of Src kinase by PP2 increased the expression of p-Src and restored nephrin-expression.Conclusions Ouabain induced human podocyte apoptosis by NKAα1/Src complex decreasing nephrin.
Ouabain; Podocyte; Apoptosis; Lupus nephritis; Na+-K+-ATPase
10.3969/j.issn.1671-2390.2017.03.004
国家自然科学基金(No.81400734);湖北省自然科学基金(No.2015CFB241)
430014 武汉,华中科技大学同济医学院附属武汉中心医院肾内科
陈文莉,E-mail:whwenli@163.com
2017-01-22
2017-02-28)
